茄子反向温敏雄性不育系可溶性糖含量及相关基因表达分析
李冰 潘秀清 武彦荣 高秀瑞 张敬敬 史宇凡 赵建军 申书兴

摘 要: 为揭示茄子反向温敏核雄性不育(rTGMS)发生与糖类代谢的关系,以茄子rTGMS系‘05ms及温度不敏感系‘S63为试材,对不育期和可育期的叶片及花蕾的可溶性糖含量进行比较,结果表明,‘05ms在不育和可育时期叶片和花蕾中的可溶性糖含量均显著低于‘S63;进一步对‘05ms花蕾进行转录组测序及对其糖类代谢相关途径进行分析,发现差异表达基因主要富集在3个通路:淀粉和蔗糖代谢、糖酵解/糖异生和氨基糖和核苷酸糖代谢,其中淀粉和蔗糖代谢通路的差异基因最多且大部分在低温条件表达下调,主要影响了葡萄糖和半乳糖醛酸的合成。此结果初步揭示了茄子反向温敏雄性不育系中糖类代谢响应温度变化的特点,为茄子雄性不育杂交育种提供理论依据。
关键词: 茄子;反向温敏核雄性不育;糖类代谢;基因表达
中图分类号:S641.1 文献标志码:A 文章编号:1673-2871(2020)05-018-06
Abstract: In order to reveal the relationship between the carbohydrate metabolism and the reverse thermosensitive genic male sterility (rTGMS) of eggplant, the rTGMS line ‘05msand the temperature-insensitive line ‘S63were used as experimental materials. The contents of soluble sugar in leaves and floral buds were compared during the anther development stages under low-temperature and high-temperature conditions. The results showed that the soluble sugar content of leaves and floral buds in ‘05mswere significantly lower than those in ‘S63during sterile and fertile periods. To make further study the biochemical mechanism of male sterily in ‘05ms, transcriptome sequencing was completed and the relational approach of carbohydrate metabolism had been analyzed. We found that the differentially expressed genes (DEGs) were enriched in the KEGG pathways ‘starch and sucrose metabolism, ‘glycolysis / gluconeogenesisand ‘amino sugar and nucleotide sugar metabolism. Among the three pathways, the DEGs of ‘starch and sucrose metabolismpathways were most, the expression levels were more lower at low-temperature, and mainly affected the synthesises of glucose and galacturonic acid. The results reveals the characteristics of carbohydrate metabolism response to temperature change in rTGMS lines of eggplant preliminarily, and provided theoretical basis for male sterile hybridization.
Key words: Eggplant; Reverse thermosensitive genic male sterility; Carbohydrate metabolism; Gene expression
茄子是我国重要蔬菜作物之一,杂种优势明显,雄性不育系的利用是配制杂交种的重要途径。光、温敏雄性不育系在适宜的光/温条件下可以恢复育性,既是不育系又是保持系,而且配组自由,不受恢、保关系制约,生产程序更为简单,具有广阔的发展前景,阐明其花药败育机制对于培育新型优良不育系具有重要意义。花药发育需要营养物质的供应,涉及物质代谢、能量代谢、酶活性的变化以及内源激素含量的差异等生理生化过程,它们之间的协同作用是花药正常分化发育所必需的。遇到不利环境,植物通常利用宝贵的资源,通过复杂的机制,包括感知、转导和信号交换等来调节代谢作用,以保护自己免受损伤[1]。植物在生殖发育时期对不适宜的温度环境极为敏感,绒毡层是最敏感的细胞层[2]。据报道,水稻小孢子发育时期對高温胁迫最为敏感,此时绒毡层功能紊乱,花药开裂较差[3]。也有研究指出,水稻生殖生长阶段遇到低温条件往往导致花药发育异常,育性下降和减产明显[4]。许多学者提出了“物质亏损”理论,即结构物质、营养物质、能量物质的亏损对小孢子发育产生严重影响[5]。糖类是植物体内一类主要的有机物,通常占植株干质量的50%以上。国内外学者对许多作物雄性不育系的生理生化特性进行了广泛研究,发现花药败育过程中可溶性糖含量均发生了变化。有研究表明,高温诱导棉花‘H05中酪蛋白激酶I(GhCKI)的表达,并抑制淀粉合酶活性,在花药发育过程中降低葡萄糖水平,最终破坏绒毡层细胞程序性死亡(PCD),导致花药败育或不开裂[6]。对茄子核质互作不育系的研究发现,不育系花蕾中可溶性糖含量高于保持系[7]。但对茄子反向温敏雄性不育系中可溶性糖含量的研究还未见报道,温度对不育系花药发育过程中糖代谢过程的影响还不清楚。
因此,笔者分别在低温不育和高温可育时期对茄子rTGMS系‘05ms叶片和花蕾中的可溶性糖含量进行了测定,并利用RNA-seq法分析了糖代谢通路中差异表达基因的变化规律,旨在探讨茄子rTGMS系‘05ms响应温度的物质能量代谢特点,丰富茄子雄性不育的理论基础,加快茄子两系杂交育种进程。
1 材料与方法
1.1 材料
供试材料为河北省农林科学院经济作物研究所选育的长茄rTGMS系‘05ms和雄性可育系‘S63,其中不育系‘05ms原始株是从‘S63自交系中自然突变而来,在低温下不育、高温下可育,临界温度为18℃。2016年1月4日于河北省农业科学院温室播种,穴盘育苗,3月20日定植,大棚种植,常规管理。
1.2 方法
1.2.1 可溶性糖含量的测定 分别采集‘S63和‘05ms在春季低温不育阶段和夏季高温可育阶段的减数分裂期、小孢子时期和成熟花粉粒时期这3个花药发育时期的花蕾和从顶部向下第3~4片叶,采用硫酸蒽酮法测定可溶性糖含量[8]。
1.2.2 糖类代谢相关基因分析 分别采集‘05ms在ML(春季低温不育阶段,4—6月份)、MH(夏季高温可育阶段,7—9月份)、MZ(秋季低温不育阶段,10—11月份)3个时期处于减数分裂时期的花蕾0.2 g,3次重复,迅速剥去萼片后投入液氮中放-80 ℃冰箱保存待用。RNA提取采用多糖多酚植物总RNA提取试剂盒(DP441)提取(TIANGEN,China)。转录组测序由北京诺禾致源生物科技股份有限公司进行并在Illumina HiSeq 4000平台上完成。通过前期对RNA-seq测序结果进行生物信息学分析,筛选出1 771个基因为可能的低温不育相关基因,并且KEGG通路分析发现差异表达基因(DEGs)显著富集到了淀粉和蔗糖代谢通路中[9]。本研究进一步分析糖代谢相关通路中DEGs,并以基因的FPKM值作为表达水平,利用Heatmap软件包进行层次聚类分析绘制热图。
1.2.3 数据分析 采用Microsoft Excel 2007和 SPSS 18.0软件数据对进行处理和差异显著性分析。
2 结果与分析
2.1 不育系和可育系可溶性糖含量比较
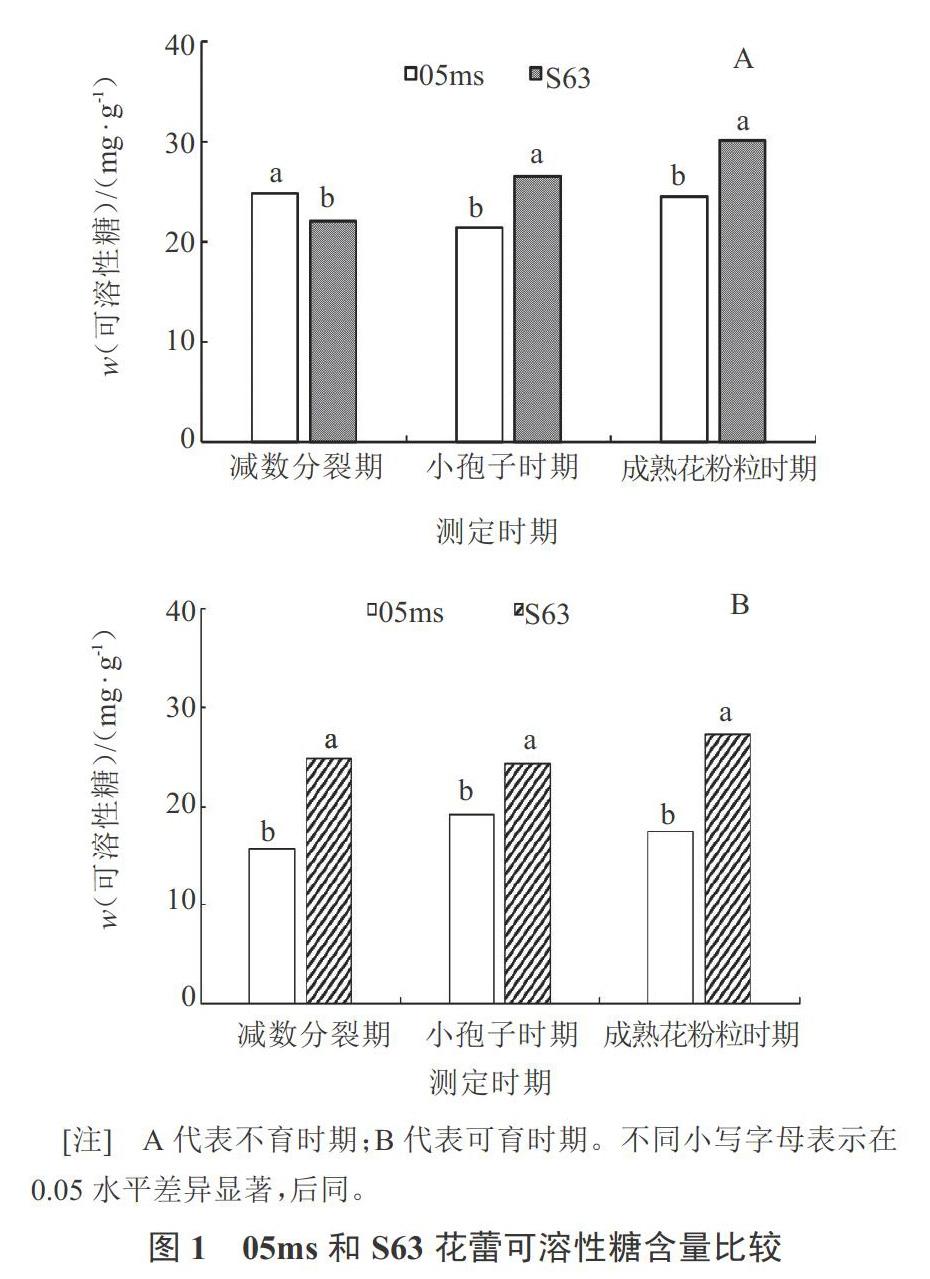
在花药发育时期对不育系和可育系进行比较发现,在花蕾中,不育阶段除减数分裂时期外,‘05ms在小孢子发育和成熟花粉粒时期可溶性糖含量(w,后同)(21~24 mg·g-1)显著低于‘S63(27~30 mg·g-1);可育阶段,‘05ms在减数分裂期、小孢子期和成熟花粉粒时期可溶性糖含量(16~19 mg·g-1)均显著低于‘S63(24~27 mg·g-1)(图1)。在叶片中,‘05ms中可溶性糖含量在不育阶段和可育阶段均显著低于‘S63(图2)。
2.2 不育系在不育期和可育期糖类相关代谢途径差异表达基因分析
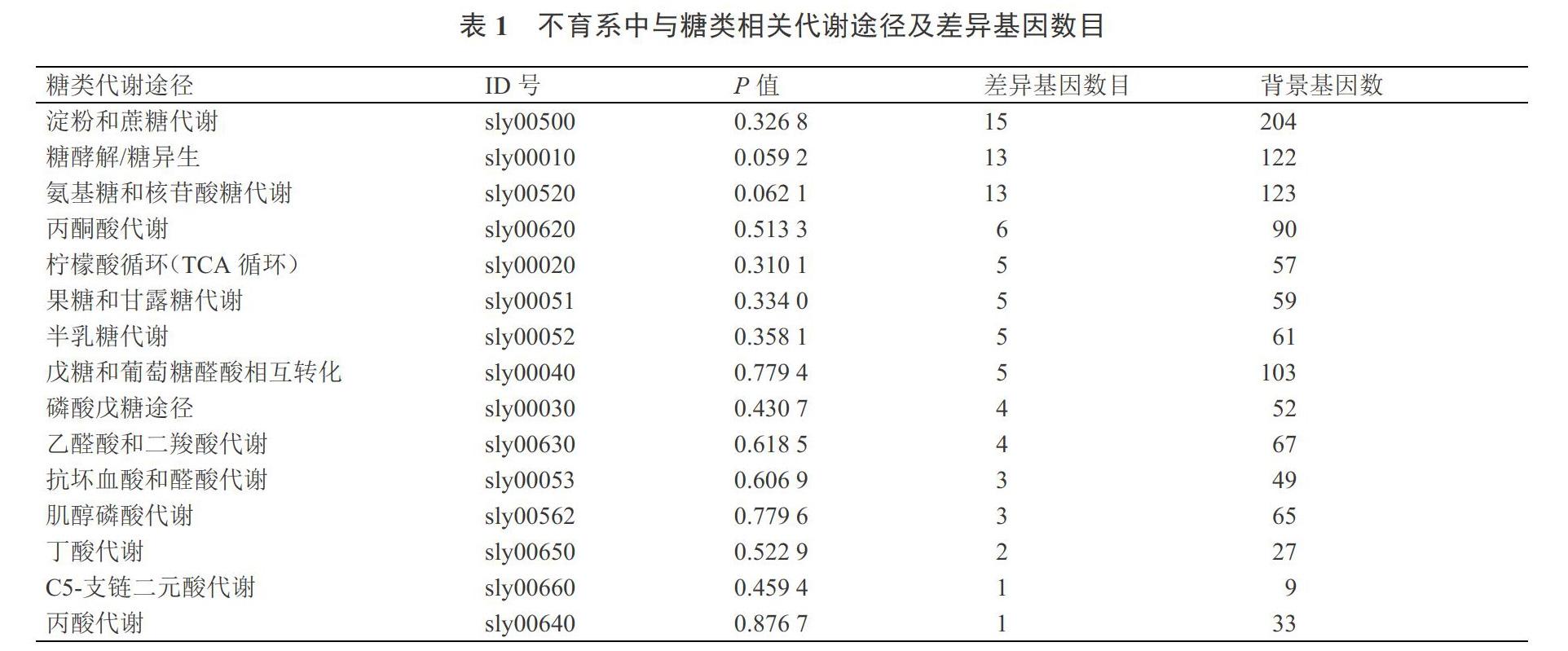
为了明确前期筛选出的1 771个与低温不育相关的DEGs的功能,以KEGG注释结果为参考,进一步统计分析与糖类代谢相关的DEGs,结果显示(表1)共有85个DEGs与糖类代谢相关,涉及到15条糖类代谢途径,DEGs数目排名前3位的依次是:淀粉和蔗糖代谢、糖酵解/糖异生、氨基糖和核苷酸糖代谢,表明这3条通路与温敏雄性不育的关系更为紧密。
2.3 不育系在不育和可育时期淀粉和蔗糖代谢通路差异基因表达分析
对不育系在ML、MH和MZ这3个育性阶段的15个淀粉和蔗糖代谢通路中DEGs进行分析,依据RNA-seq测序结果的基因表达量FPKM值进行聚类并用热图展示(图3)。结果发现DEGs被分为2类,第1类共涉及3个基因,高温低表达,低温高表达,只涉及葡萄糖合成通路;第2类共涉及12个基因,高温高表达,低温低表达,主要涉及到葡萄糖、果胶和半乳糖醛酸合成通路,麦芽糖合成通路和海藻糖合成通路各涉及1个基因。
在通路中进一步对DEGs进行功能分析,发现主要影响两类代谢物的合成途径(表2)。一类是葡萄糖合成途径,有7个基因参与,约占总数的46.7%;另一类是半乳糖醛酸和果胶合成途径,有6个基因参与,占总数的40.0%。其中基因Sme2.5_12729.1_g00004.1隨温度变化表达水平变化最为剧烈,ML、MH和MZ阶段表达量分别为0.46、139.03和0.17,此基因编码β-葡萄糖苷酶,是一种水解酶,为β-D-葡萄糖生成的最后一步。
对淀粉和蔗糖代谢通路进行研究,发现UDP-葡萄糖醛酸4-差向异构酶(EC:5.1.3.6)有3个基因(表2),均表现为低温低表达,高温高表达;此酶主要影响半乳糖醛酸途径(图4),此途径中6个DEGs在低温不育条件下表达水平均下调(表2,图3),果胶合成和水解受阻。
3 讨论与结论
糖类是植物体内的主要有机物,对植物的生长发育、应激反应和产量形成等生命活动均起着重要作用[10]。花药发育过程中花药壁细胞会积累一些营养物质(如核酸、蛋白质、碳水化合物和脯氨酸等)以供小孢子发育,而在不育系花药或花粉中则相对缺乏[11]。可溶性糖和淀粉是花药发育所需的主要营养物质,而且花药壁细胞主要为果胶和纤维素。番茄温敏雄性不育系‘T-4在夜温为18 ℃的可育条件下,淀粉和糖含量均高于夜温为12 ℃及24 ℃的不育条件下[11]。对辣椒细胞核雄性不育(GMS)系‘G06-77-2AB及细胞核质互作雄性不育(CMS)系‘C06-77-2A花蕾各发育时期的可溶性糖含量进行测定,发现均低于可育系,但在两种不育系间无规律可循[12]。但对茄子CMS系可溶性糖、淀粉的研究表明,花蕾发育时期不育系可溶性糖含量高于保持系,推测可能是由于糖转运受阻所致[13]。对小麦花药中可溶性糖含量进行测定,发现不育系高于可育系,推测蔗糖的水解过程受阻导致糖积累异常,从而引起花药败育[14]。笔者研究发现,茄子rTGMS系‘05ms在低温不育和高温可育阶段叶片和花蕾中可溶性糖含量均低于相应可育系‘S63,推测由于营养物质不足导致花药败育。综上所述,不育系中可溶性糖含量高或低均有可能造成雄性不育,但均说明花药发育过程中糖代谢发生了紊乱。
糖类不仅是植物生长发育的碳源和能量来源,还可作为信号物质调节相关基因的表达和酶活性[9];同时,还可作为抗氧化物质调节植物对不良环境的适应能力[15]。糖代谢途径在雄性器官发育中起着至关重要的作用,并保护雄配子体免受各种环境压力[16-17]。研究发现,在花发育过程中,花药吸收能力很强,温度激活高代谢活性,通过消耗大量的糖来支持早期的花粉发育[18]。此外,葡糖糖是花药中最重要的糖能量形式,淀粉作为花粉成熟的标志,为花粉萌发提供了能量储备。无论是葡萄糖的减少,还是花药中淀粉的亏缺,都会显著损害花粉发育,导致雄性不育[19]。对棉花高温敏感株系‘H05花药进行RNA-seq测序,结果显示DEGs在淀粉和蔗糖代谢通路显著富集,高温下可溶性糖含量明显减少,蔗糖转化为葡萄糖和果糖的途径受阻,高温扰乱了糖类代谢通路[20]。笔者对茄子rTGMS系‘05ms在不同温度下的花蕾进行RNA-seq测序,对糖类相关代谢途径进行深入分析,发现涉及到15条糖类代谢通路,其中差异基因富集最多的为淀粉和蔗糖代谢通路。在此通路中,有3个DEGs属于β-葡萄糖苷酶(EC: 3.2.1.21),其功能是将纤维素二糖和纤维素寡糖水解成为葡萄糖,在低温下Sme2.5_00140.1_g00012.1表达水平升高,然而Sme2.5_12729.1_g00004.1和Sme2.5_00021.1_g00012.1的表达水平降低,可见低温下不育系花蕾中β-葡萄糖苷酶表达紊乱,其中,随温度变化最大的基因是Sme2.5_12729.1_g00004.1,高温时期是低温时期表达量的几百倍,低温不育时期几乎不表达,推测β-葡萄糖苷酶表达受到强烈抑制,导致小孢子发育过程中葡萄糖缺乏,营养和能量不足,可能是引起小孢子败育的重要原因之一。相似的,有研究报道西瓜细胞核不育系花蕾中β-葡萄糖苷酶不表达,可能导致小孢子发育过程中营养物质不足,最终导致小孢子败育[21]。笔者还发现蔗糖转移酶β-果糖呋喃苷酶(EC: 3.2.1.26),其功能是催化蔗糖分解为葡萄糖和果糖,在低温下低表达,高温下高表达。汪月[22]对小麦胞质不育系研究发现,β-果糖呋喃苷酶在花药发育的单核期表达上调,蔗糖分解代谢比较旺盛,可能与绒毡层的降解关系密切;在二核期表达下调,蔗糖分解代谢减弱,可能与绒毡层提前降解完成有关。因此,笔者推测‘05ms低温不育期β-果糖呋喃苷酶表达下调,仅为高温时期的20%,不育系中绒毡层延迟降解完成[9],可能与蔗糖分解代谢受抑制有关。
糖类在调控植物生长发育、逆境响应和生物防御反应等生理过程中发挥重要作用。尽管目前对糖代谢在花药发育中的研究已经取得了许多进展,但是对于植物体内糖种类的多样性及其生理功能的复杂而精细的调节机制来说,许多详细的信息仍不明确。笔者将进一步研究茄子温敏不育系在同一生长阶段不同温度下糖类代谢的变化,深入探讨糖类调控花药发育的机制,为推进茄子雄性不育系利用提供有力支撑。
笔者通过对茄子反向温敏不育系‘05ms在不育期和可育期的花蕾进行生理指标测定和转录组测序分析,发现不育系在低温环境下可溶性糖含量降低,糖类代谢通路基因变化较多,淀粉和蔗糖代谢途径基因大部分表达下调,表明糖类代谢对花药发育起重要作用。
参考文献
[1] SUZUKI N,KOUSSEVITZKY S,MITTLER R,et al.ROS and redox signalling in the response of plants to abiotic stress[J].Plant Cell and Environment,2012,35(2):259-270.
[2] SUZUKI K,TAKEDA H,TSUKAGUCHI T,et al.Ultrastructural study on degeneration of tapetum in anther of snap bean(Phaseolus vulgaris L.)under heat stress[J].Sexual Plant Reproduction,2001,13(6):293-299.
[3] ENDO M,TSUCHIYA T,HAMADA K,et al.High temperatures cause male sterility in rice plants with transcriptional alterations during pollen development[J].Plant and Cell Physiology,2009,50(11):1911-1922.
[4] OLIVER S N,DONGEN J T V,ALFRED S C,et al. Cold-induced repression of the rice anther-specific cell wall invertase gene OSINV4 is correlated with sucrose accumulation and pollen sterility[J].Plant Cell and Environment,2005,28(12):1534-1551.
[5] 夏濤,刘纪麟.玉米细胞质雄性不育系物质代谢系统的研究[J].华中农业大学学报,1993,12(1):1-6.
[6] MIN L,LI Y,HU Q,et al.Sugar and auxin signaling pathways respond to high-temperature stress during anther development as revealed by transcript profiling analysis in cotton[J].Plant Physiology,2014,164(3):1293-1308.
[7] 郭丽娟,申书兴,张成合,等.茄子雄性不育系的可溶性糖、淀粉、氨基酸分析[J].河北农业大学学报,2004,27(4):34-36.
[8] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:195-197.
[9] LI B,CHEN X P, WU Y R,et al.Gene characterization and molecular pathway analysis of reverse thermosensitive genic male sterility in eggplant(Solanum melongena L.)[J].Horticulture Research,2019,11(6):118.
[10] 何亞飞,李霞,谢寅峰.植物中糖信号及其对逆境调控的研究进展[J].植物生理学报,2016,52(3):241-249.
[11] 王先裕,梁聪耀,邓廖芬,等.番茄温敏雄性不育系T-4生理生化特性研究[J].北方园艺,2011(15):29-31.
[12] 黄巍,缪武.辣椒两种雄性不育系中可溶性蛋白质及可溶性糖的变化关系[J].辣椒杂志,2017,15(2):29-32.
[13] 郭丽娟.茄子种间杂交创建的雄性不育系及保持系生理生化特性研究[D].河北保定:河北农业大学,2004.
[14] DORION S,LALONDE S,SAINI H S.Induction of male sterility in wheat by meiotic-stage water deficit is preceded by a decline in invertase activity and changes in carbohydrate metabolism in anthers[J].Plant Physiology,1996,111(1):137-145.
[15] 朱晔荣,刘苗苗,李亚辉,等.植物淀粉生物合成调节机制的研究进展[J].植物生理学报,2013,49(12):1319-1325.
[16] FRANK G,PRESSMAN E,OPHIR R,et al.Transcriptional profiling of maturing tomato(Solanum lycopersicum L.)microspores reveals the involvement of heat shock proteins,ROS scavengers,hormones,and sugars in the heat stress re-sponse[J].Journal of Experimental Botany,2009,60(13):3891-3908.
[17] MIN L,ZHU L F,TU L L,et al.Cotton GhCKI disrupts normal male reproduction by delaying tapetum programmed cell death via inactivating starch synthase[J].Plant Journal,2013,75(5):823-835.
[18] OLIVER S N,DENNIS E S,DOLFERUS R.ABA regulates apoplastic sugar transport and is a potential signal for cold-induced pollen sterility in rice[J].Plant and Cell Physiology,2007,48(9):1319-1330.
[19] DATTA R,CHAMUSCO K C,CHOUREY P S.Starch biosynthesis during pollen maturation is associated with altered patterns of gene expression in maize[J].Plant Physiology,2002,130(4):1645-1656.
[20] MIN L,LI Y Y,HU Q,et al.Sugar and auxin signaling pathways respond to high-temperature stress during anther development as revealed by transcript profiling analysis in cotton[J].Plant Physiology,2014,164(3):1293-1308.
[21] 张彦萍,刘海河,谢彬,等.西瓜细胞核雄性不育系雄花蕾的mRNA差异表达分析[J].果树学报,2010,27(6):1037-1041.
[22] 汪月.小麦K型胞质雄性不育花药差异蛋白质组学的研究[D].山东泰安:山东农业大学,2018.

