毛霉诱导脐橙产抗病物质对指状青霉和酸腐菌的抑制
熊 琪,杨书珍,曹正清,张美红,程运江,彭丽桃
毛霉诱导脐橙产抗病物质对指状青霉和酸腐菌的抑制
熊 琪1,杨书珍1,曹正清1,张美红1,程运江2,彭丽桃1※
(1. 华中农业大学食品科技学院,武汉 430070;2. 华中农业大学园艺林学学院,武汉 430070)
绿霉和酸腐是柑橘果实采后主要的病害,生产上迫切需要化学杀菌剂的替代方法。该研究对毛霉诱导脐橙果皮产生的具有抗病活性的红色物质(Citru Peel Red-substance Extract,CPRE)进行部分分离纯化,评价了CPRE对指状青霉和酸腐菌的抑菌活性,分析活性成分对两病原真菌菌丝细胞壁与膜功能的影响。结果表明,在50~200g/mL的质量浓度下,CPRE对指状青霉和酸腐菌的孢子萌发,芽管伸长,菌丝生长有强烈的抑制作用,并且呈现剂量效应,最低抑菌浓度均为200g/mL。进一步研究表明,与空白对照比较,50、100g/mL抗菌活性成分处理明显改变指状青霉和酸腐菌菌丝细胞壁中几丁质分布,降低了细胞壁中几丁质含量、促进了质外体碱性磷酸酶的释放,表明CPRE严重损伤两致病真菌菌丝的细胞壁功能;CPRE处理还明显损伤两病菌菌丝的细胞膜通透性(<0.05),刺激菌丝膜外电导率显著上升(<0.05),加剧细胞内蛋白和核酸的丢失,降低了菌丝细胞膜总脂质含量,影响了细胞膜的正常功能。上述结果表明,红色抗菌成分在防控柑橘采后绿霉病和酸腐病中有潜在应用前景。
菌;果皮红色抗菌成分;指状青霉;酸腐菌;抑菌;细胞膜;细胞壁
0 引 言
柑橘营养丰富,深受广大消费者喜爱,中国是柑橘产销的大国[1],每年柑橘因绿霉病、酸腐病为主的采后损失严重[2]。目前,控制柑橘采后腐烂的方法以抑霉唑、嘧霉胺、咪鲜胺和咯菌腈等化学杀菌剂为主,对绿霉病有较好的抑制效果,但对酸腐病不理想,生产上不断加大使用剂量,对人类健康、生态环境,病菌抗药性造成了潜在的风险[3]。随着国家、消费者对食品安全问题的重视,农药杀菌剂的使用要求越来越严格,许多国家和地区已严格限制使用[4]。因此,寻找安全,高效,广谱的采后防治技术具有重要意义,应用植物免疫激发子激发植物自身防御体系,诱导抗病性,抵御病原菌侵染,更加高效和安全,已成为研究热点[5]。
外源物质的刺激或病原菌的侵染后,植物启动相应的防御反应系统,刺激产生次生代谢物如植保素等,对入侵病原菌直接抑制[6]。瓜枝孢弱致病菌株诱导黄瓜产生的次生代谢物质,具有明显的抑菌活性[7]。真菌、酵母菌、细菌、发酵液和菌丝中的多糖,诱导玉米生长植保素的累积,植保素在玉米上喷施后,抗病性提高,产量增加7%~10%[8]。草本植物叉毛蓬里的活性物质鼠李黄素对番茄疮痂病菌和番茄早疫病菌有较强的抑制作用[9]。脐橙经过紫外线照射后,果皮会产生并积累植保素滨蒿内酯和东莨菪碱,可以抑制或延缓病原菌生长[10]。柑橘产生的次生代谢产物与抗病密切相关。目前,酵母菌和芽孢杆菌主要诱导采后柑橘果实抗病性,对于毛霉诱导研究鲜见报道。课题组前期已发现,脐橙经扎孔接种毛霉后,伤口附近会产生环状红色物质,再接种意大利青霉,脐橙不发病[11]。并且红色物质抗病组分对意大利青霉生长有明显的抑制作用[12]。本文探究毛霉诱导脐橙产生红色物质对柑橘采后主要致病菌指状青霉和酸腐菌的抑制作用,并探讨其可能作用机制,为开发新型柑橘防腐保鲜技术提供思路。
1 材料与方法
1.1 材料与试剂
赣南脐橙()从华中农业大学中百超市采购后运送至实验室进行相关处理。毛霉()由华中农业大学食品科技学院实验中心提供,马铃薯葡萄糖琼脂(Potato Dextrose Agar,PDA)培养基4 ℃保存备用。指状青霉(),酸腐菌()购自国家菌种保藏中心,PDA培养基4 ℃保存。
甲醇(色谱纯)、二氯甲烷、石油醚、正庚烷、氯仿、浓硫酸、氢氧化钾、次氯酸钠溶液、无水乙醇购自国药集团化学试剂有限公司;磷酸香草醛、D-硫酸盐葡糖胺等购自上海甄准生物科技有限公司。
1.2 仪器与设备
旋转蒸发仪(上海爱明仪器有限公司,R-1001-VN);光学显显微镜(宁波舜宇仪器有限公司,EX-20);荧光显微镜(德国莱卡仪器公司,DM3000);恒温光照培养箱(国华电器有限公司,HH-4);高效液相色谱仪(日本岛津公司,LC-20A);真空冷冻干燥机(北京松源华兴科技发展有限公司,LGJ-10)。
1.3 分析方法
1.3.1 抗病性红色物质的制备、分离及纯化
参考彭洋等[12]的方法,脐橙用2%质量分数的次氯酸钠溶液清洗后再用清水清洗两次,晾干;用无菌移液枪枪头在每个果实赤道等距离扎直径2~3 mm,深度为1.5~2 mm的伤口,用移液枪注射20L浓度为1×107CFU/mL毛霉孢子悬浮液后,将果实置于26 ℃生化培养箱光照培养4~5 d。在伤口部位形成成肉眼可见的环状红色物质时,取红色果皮,液氮研磨,冷冻保存备用。
取样品粉末,加入甲醇,超声浸提,4 ℃、10 000 r/min离心20 min,收集上清液,重复提取2次。提取液浓缩后用石油醚除去脂溶性成分,再用二氯甲烷萃取,萃取相过C18柱后冷冻干燥得到果皮红色抗菌成分(Citrus Peel Red-substance Extract,CPRE)。提取及分离纯化过程中采用高效液相色谱检测以确保所提物质为CPRE。
1.3.2 指状青霉和酸腐菌孢子萌发及芽管伸长的测定
参考柳丽梅等[13]的方法,取红色物质溶液(体积分数20%甲醇溶液溶解)与培养基混匀,使培养基中红色物质的最终质量浓度分别为12.5、25、50、100、200g/mL,以无菌水作为空白对照(CK),将培养基涂于载玻片上,分别取20L指状青霉和酸腐菌孢子悬浮液,滴于凝固的含红色物质的培养基上,放在26 ℃培养箱中培养,指状青霉在7~8 h,酸腐菌5~6 h后观察孢子萌发情况,孢子芽管长度大于孢子半径视为萌发,按下述公式计算孢子萌发率及抑制率。芽管伸长试验操作步骤同上,在26 ℃培养12 h后在光学显微镜下结合电脑Vibao1.0U软件测量芽管长度。


1.3.3 指状青霉和酸腐菌菌丝生长量的测定
参考Yang等[14]的菌饼试验方法。取适量红色物质溶液与培养基混匀,使得培养基红色物质的质量浓度分别为25、50、100、200g/mL,在马铃薯葡萄糖琼脂(Potato Dextrose Agar,PDA)培养基上分别培养36和8 h的指状青霉和酸腐菌用打孔器打出直径5 mm的菌饼,将菌饼反贴在含红色物质的培养基上,每个培养皿贴3块,26 ℃培养,每24 h采用十字交叉法用直尺测量菌斑直径。
1.3.4 CFW染色观察几丁质转移现象
参考Viragh等[15]的方法,进行细胞壁钙荧光白(Calcofluor White,CFW)染色,将指状青霉和酸腐菌孢子悬浮液分别涂布于红色物质质量浓度分别为50、100g/mL的25 mLPDA平板上,以无菌水作为空白对照(CK),斜插无菌盖玻片后封口,26 ℃倒置培养24 h,取出长有菌丝的盖玻片,置于洁净的载玻片上,滴加足量CFW染液和质量分数10 % KOH溶液混合液(现配现用)充分浸润菌丝,室温染色1 min,蒸馏水洗去多余染液,免疫荧光显微镜(Immuno Flurorescence Microscopy,IFM)下观察。病菌菌丝细胞壁中暴露的几丁质与CFW结合,受紫外光激发,呈现蓝色荧光,未暴露的几丁质不能与CFW结合,显微镜下观察无蓝色荧光。
1.3.5 几丁质含量的测定
参考Viragh等[15]和Stalhberger等[16]的方法。将指状青霉和酸腐菌孢子悬浮液接种于马铃薯葡萄糖肉汤培养基(Potato Dextrose Broth,PDB)中,加入适量红色物质溶液,控制浓度分别为50、100g/mL,以无菌水作空白对照(CK),26 ℃、125 r/min振荡培养24 h,过滤菌丝,0.1 mol/L pH值7.0磷酸盐缓冲液(Phosphate Buffered Saline,PBS)冲洗2次,滤干。将菌丝除去蛋白质、脂质后冷冻干燥,取10 mg冻干粉末于10 mL离心管中,向各管中加2 mol/L浓硫酸0.5 mL,沸水浴4 h充分裂解。收集裂解产物,4 ℃、12 000 r/min离心5 min,上清液用2 mol/L KOH调pH值至3,取100L加1 mL乙酰丙酮,摇匀,沸水浴25 min,冷却后加1.5 mL对二甲胺基苯甲醛溶液和3.0 mL无水乙醇,摇匀,60 ℃水浴1 h,测定各样品在520 nm波长处的吸光度,用D-硫酸盐葡糖胺做标准计算几丁质含量。
1.3.6 菌丝AKP渗出的测定
参考Shao等[17]的方法。0.1 mL1×107CFU/mL的指状青霉和酸腐菌孢子悬浮液加入10 mL PDA培养1 d,加入红色物质使浓度分别为50、100g/mL,对照组加无菌水,菌丝4 000×,离心10 min,取上清液,按检测试剂盒说明(南京建成生物工程研究所)测定AKP酶活性,以37 ℃下与基质反应15 min释放1 mg酚为1活性单位。
1.3.7 PI染色观察菌丝体细胞膜的完整性
参考Ouyang等[18]的方法,菌丝培养同前。取出盖玻片,置于长有菌丝的洁净载玻片上,滴几滴50g/mL碘化丙啶(Propidium Iodide,PI)染色液(PBS配制),避光染色10 min,用蒸馏水洗去多余染色液,置于IFM下观察。
1.3.8 总脂质含量的测定
参考Ahmad等[19]的方法。培养的菌丝采用真空冷冻干燥方法,-18℃预冻2 h,真空度15 Pa,15℃冷冻干燥20 h,液氮研磨成干粉,4 ℃保存备用。精确称取0.10 g菌丝干粉于10 mL离心管中,依次加入0.8 mL蒸馏水、1 mL甲醇、2 mL氯仿,漩涡振荡,65 ℃水浴30 min,6 000×离心,吸取全部氯仿相到另一离心管中,加入0.2 mL生理盐水,漩涡振荡后静置分层,取氯仿相到玻璃试管中,加入500L浓硫酸,沸水浴10 min后加入3 mL磷酸香草醛,以无菌水作空白对照(CK)。测定520 nm波长处吸光度,用胆固醇做标准曲线,计算总脂质含量。
1.3.9 菌丝膜外电导率的测定
参考Tao等[20]的方法。菌丝培养方法同前。称取2.00 g湿菌丝于50 mL洁净离心管中,用20 mL双蒸水重悬,加入适量CPRE,控制最终质量浓度为50、100g/mL,以无菌水作空白对照(CK),用DDS-11A电导率仪测定加入红色物质后0~48 h内溶液的电导率。
1.3.10 菌丝蛋白质、核酸渗出的测定
参考Paul等[21],Aligiannis 等[22]方法,菌丝培养方法同前,收集菌丝,0.1 mol/L pH值 7.0磷酸盐缓冲液冲洗2次,再重悬浮于20 mL磷酸缓冲液中,分别加入CPRE使其浓度为50、100g/mL,以不加红色物质作对照,每个浓度3个平行。取上清液12 000×离心10 min后,用紫外分光光度计测定0~48 h内,260、280 nm波长下溶液的吸光度值(260nm,280nm)。280 nm、260 nm分别是蛋白质和核酸的最高吸收峰的吸收波长,测定溶液中对应波长的光吸收,反映菌丝蛋白和核酸渗漏情况。
1.4 数据处理与分析
所有试验设置3次平行、重复3次。数据用SPSS18.0软件进行单因素方差分析及Excel绘图。
2 结果与分析
2.1 CPRE对指状青霉和酸腐菌的孢子萌发和芽管伸长的影响
红色物质可以抑制2种供试菌孢子萌发和芽管伸长(表1)。随着加入CPRE的浓度增加,指状青霉和酸腐菌孢子萌发率逐渐降低。当CPRE为25g/mL时,指状青霉和酸腐菌的萌发率仅(50.61%±0.06)%、(61.35%±0.06)%,相比于对照组下降了46.79%、33.49%。
各浓度处理下的芽管长度明显低于指状青霉和酸腐菌对照组(26.29±1.87)m、(15.59±1.81)m,200g/mL浓度下,指状青霉和酸腐菌未见芽管生长,与孢子萌发结果相印证。
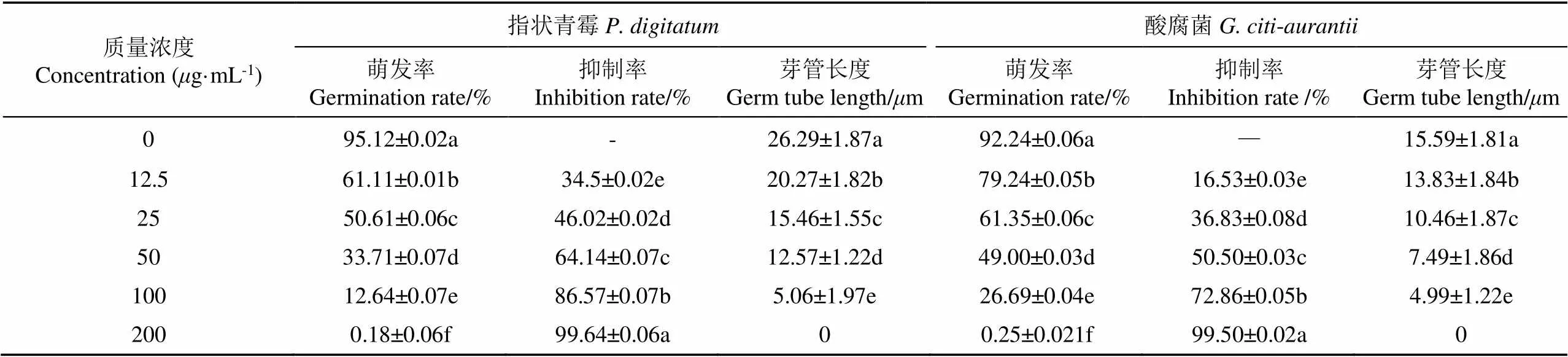
表1 CPRE对指状青霉和酸腐菌孢子萌发和芽管伸长的影响
注:同列标小写字母不同表示差异显著(<0.05),下同。
Note: Different letters in the same column mean significant differences(<0.05), the same as below.
2.2 CPRE对指状青霉和酸腐菌菌丝生长的影响
PDA中加入CPRE可抑制指状青霉和酸腐菌菌丝的生长(图1)。指状青霉在培养48 h后,红色物质浓度50、100、200g/mL与空白组有显著差异(<0.05),培养96 h时,100、200g/mL高浓度下,指状青霉菌饼几乎没有生长(0.62±0.07)cm、(0.55±0.06)cm,显著低于空白对照组(2.61±0.06)cm(<0.05)。培养的整个过程中,酸腐菌在100、200g/mL浓度下生长明显低于其他处理组和空白组(<0.05)。200g/mL下培养至96 h,CPRE可完全抑制指状青霉和酸腐菌生长。
2.3 CPRE对菌丝几丁质分布和含量的影响
CFW与真菌细胞壁几丁质结合,生成亮蓝色荧光[23]。图2可以看出,蓝色荧光随着CPRE浓度增加而增强,明场下对照组中指状青霉、酸腐菌菌丝形态完整,暗场下几乎没有蓝色荧光,而处理组明显分支较多,生成分生孢子梗,100g/mL处理下里菌丝呈现强蓝色荧光。酸腐菌表现出相似的量效关系,50g/mL浓度下,有微弱的蓝色荧光,100g/mL时,强烈蓝色荧光。表明CPRE处理,改变了细胞壁组成和几丁质分布。

图1 CPRE处理对指状青霉和酸腐菌菌丝生长的影响
进一步分析菌丝细胞璧几丁质含量发现(图2c),CPRE处理24 h后,2种病原菌菌丝的细胞壁几丁质含量下降。在100g/mL浓度下,指状青霉、酸腐菌几丁质质量分数(21.9±0.69)g/mg、(5.12±0.46)g/mg比对照组(31.41±0.31)g/mg、(10.81±0.91)g/mg,分别下降了30.29%,52.64%。这表明,CPRE处理造成病原菌菌丝细胞壁主要成分缺失,使细胞壁完整结构破坏,与CFW荧光观察的结果一致。
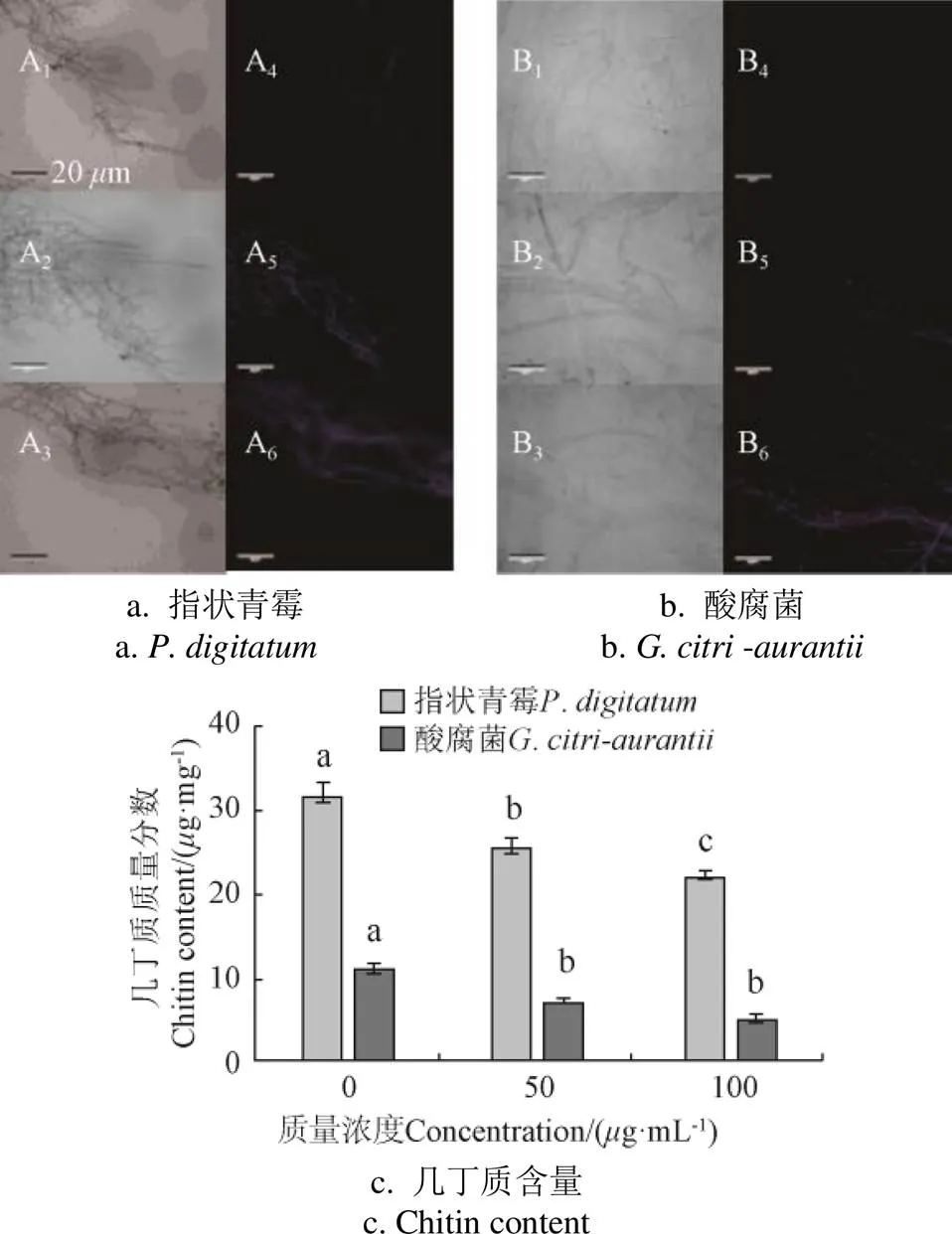
注:下标1~3为明场下CK和50、100 μg·mL-1处理组菌丝,4~6为暗场下CK和50、100μg·mL-1处理组菌丝,图a、b、c均是处理24 h的结果。下同。
2.4 CPRE对细胞壁AKP泄露的影响
碱性磷酸酶(Alkaline Phosphatase,AKP),由细胞质产生,分泌在细胞壁内的周质空间。当细胞壁破裂后,AKP可由壁膜间隙释放到细胞外[24]。因此,可通过测定细胞外AKP变化反映细胞壁的完整性。如图3所示,CPRE处理指状青霉和酸腐菌,在12 h内胞外AKP活性上升缓慢,12~48 h迅速增加。CPRE处理指状青霉24 h时,100g/mL处理组显著高于50g/mL处理组和对照组(<0.05);酸腐菌中50g/mL处理组变化趋势与对照组相似,显著低于100g/mL处理组(<0.05)。说明CPRE处理24 h后,指状青霉和酸腐菌细胞壁完整性明显破坏,造成了AKP大量泄漏。
2.5 CPRE对菌丝PI染色和总脂质的影响
PI是一种在细胞膜受损后,能进入细胞中对DNA染色的细胞核染色试剂,可直观反映细胞膜完整性[18]。由图4可以看出:明场中指状青霉和酸腐菌菌丝有完整结构,菌丝光滑,边缘整齐(图4A1,B1);而处理组菌丝多分生孢子,菌丝内部多隔膜,多分枝(图A3、B3)。暗场中对照组几乎无荧光(图A4、B4),50g/mL处理组有微弱红色荧光(图A5、B5),而100g/mL处理组呈明显红色荧光(图A6、B6),且强度远远高于50g/mL处理组。说明CPRE能够破坏膜完整性且具有浓度效应。

图3 CPRE对指状青霉和酸腐菌菌丝细胞壁AKP泄露影响
如图4c,空白组指状青霉的总脂质质量分数(267.59±5.69)mg/g,50、100g/mL CPRE处理组总脂质质量分数为(203.51±2.51)mg/g,(164.21±4.16)mg/g,分别下降23.69%、38.69%。酸腐菌对照组总脂质质量分数(146.21±2.61)mg/g,50、100g/mL处理组总脂质下降17.16%、23.49%。这表明CPRE处理造成指状青霉和酸腐菌的细胞膜主要成分总脂质降低,影响了细胞膜正常功能。
2.6 CPRE对菌丝膜外电导率的影响
由图5可知,在CPRE处理12 h后,50、100g/mL处理组菌丝膜外电导率与对照组差异显著(<0.05)。尤其是指状青霉,急剧上升。48 h后,100g/mL处理组指状青霉、酸腐菌的膜外电导率(472.6±0.5)、(124.7±0.9)S/cm是对照组(80.4±1.1)、(74.6±0.4)S/cm的5.8、1.7倍。说明CPRE损伤了2种菌细胞膜通透性,增加了细胞内金属离子Na+,K+等的渗出[20]。
2.7 CPRE对膜外核酸和蛋白质的影响
为进一步评价CPRE处理对细胞膜功能的影响,检测了细胞内主要大分子,蛋白质和核酸的渗漏情况。结果表明(图6),指状青霉、酸腐菌经CPRE处理后,随时间延长,处理组细胞内蛋白质和核酸的渗出显著高于对照组组(<0.05)。指状青霉中,100g/mLCPRE处理6 h时,胞外溶液中蛋白(280),核酸(260)的光吸收分别为(0.469±0.008),(0.567±0.014),48 h时急剧增加到(1.37±0.012),(1.513±0.022),分别增加了191%、167%。酸腐菌中,100g/mL处理组胞外溶液中蛋白质,核酸光吸收在12~48 h内分别增加了0.301、0.894。这些结果表明,CPRE处理前6 h内,指状青霉和酸腐菌的膜内蛋白质和核酸泄露较少,6~48 h膜内重要大分子物质大量流失,与膜外电导率6 h后开始急剧增加相互验证,说明CPRE对细胞膜完整性造成严重伤害。

图4 CPRE对指状青霉和酸腐菌PI染色观察细胞膜完整性及对细胞总脂质含量的影响

图5 CPRE处理对指状青霉和酸腐菌菌丝膜外电导率的影响

图6 CPRE处理对指状青霉和酸腐菌菌丝蛋白质与核酸渗漏的影响
3 讨 论
近年来,植物源提取物质抑菌活性的研究已有很多报道[25]。CPRE作为一种脐橙果皮提取物,对指状青霉和酸腐菌的抑菌浓度在12.5~200g/mL具有明显的浓度效应,200g/mL时可以完全抑制指状青霉和酸腐菌的孢子萌发和芽管伸长。远远低于常见的化学杀菌剂如500 mg/L抑霉唑或咪鲜胺[26]。CPRE的抑菌活性,与其他天然植物提取物相似,如紫苏叶中紫苏醛对黑曲霉的最低抑菌浓度和最低杀真菌浓度分别为0.25和1L/mL[27];25 mg/mL的川芎提取液抑制指状青霉和意大利青霉菌落生长,并显著降低脐橙腐烂率,保持营养品质[28];经1.25%壳聚糖石榴皮提取物复合溶液处理可延长草莓保鲜2 d[29]。目前国内外柑橘对酸腐病防治手段比较单一,主要采用双胍盐类杀菌剂进行处理[30],CPRE对柑橘主要采后病原菌指状青霉、酸腐菌、意大利青霉[12]强烈的抑菌活性,显示了其潜在的应用开发价值。
真菌细胞壁为细胞提供保护,对真菌的通透性非常关键[31],抗菌物质如茶树精油、肉桂醛、抗菌肽、多聚赖氨酸等严重影响细胞壁结构与功能[32-34]。本试验结果显示,红色抗菌物质改变了2种菌细胞壁中几丁质的分布,显著增强了CFW的染色强度(图2),表明该处理改变了细胞壁的结构,与香蕉中分离的Thaumatin蛋白对扩展青霉菌丝细胞壁结果一致[31]。AKP酶是细胞质中产生的,正常情况下存在于周质空间,在红色物质处理后,AKP释放到培养介质中,表明细胞壁的完整性受到影响,与CFW染色结果一致。茶树油处理灰霉菌菌丝也促进AKP释放,破坏细胞壁结构[16]与本文结果相似。红色抗菌物质处理24 h后指状青霉和酸腐菌几丁质含量比对照减少30.29%、52.64%(图2c),再次印证红色抗菌物质对细胞壁结构造成严重损伤。茴香精油活性组分茴香脑主要通过抑制几丁质合成酶影响毛霉细胞壁几丁质的合成[35],转录组分析发现抑制芒果炭疽菌的抗菌成分二甲基三硫可抑制菌丝几丁质和葡聚糖相关基因的表达[36]。这些结果表明,抑制细胞壁合成,影响细胞壁功能是活性成分重要的作用机制。
细胞膜完整性在维持细胞活性所需胞内物质水平方面有十分关键的作用,细胞膜完整性的破坏打乱了各种代谢平衡,最终引起细胞死亡[37]。PI是核荧光染料,可以进入膜受损细胞并结合核酸产生红色荧光[18],染色结果显示,抗菌红色物质破坏细胞膜完整性,并表现浓度剂量效应(图4)。与过氧化氢对构巢曲霉氧化伤害与细胞膜损伤相似[38]。膜结构的破坏必然导致胞内离子和大分子物质的渗漏,本研究检测结果表明,抗菌物质处理6 h,膜外电导率显著上升(图5)(<0.05),说明细胞内外离子平衡被破坏,影响膜功能;同时大分子物质蛋白质和核酸也在处理6 h后大量渗漏(图6),加剧细胞代谢失调,最终导致菌丝死亡。Cui等研究表明鼠尾草精油影响大肠杆菌膜结构和功能[39]。Hajime等发现表儿茶素没食子酸酯破坏细菌细胞膜,诱导小分子从内膜中流出[40]。细胞膜组分总脂质检测表明,经抗菌物质处理24 h后,指状青霉和酸腐菌的总脂质含量降低(图4C),表明抗菌物质也通过损伤细胞膜结构和功能发挥抑菌作用。
4 结 论
1)通过孢子萌发、芽管伸长、菌饼生长等试验,证实毛霉诱导的脐橙果皮红色抗菌成分(Citrus Peel Red-substance Extract,CPRE)对指状青霉和酸腐菌具有良好的抑制作用,呈现剂量效应,对2种致病菌的最低抑菌浓度均是200g/mL。
2)CPRE处理会造成指状青霉、酸腐菌病菌菌丝细胞膜总脂质显著下降(<0.05),细胞膜结构受损,蛋白质、核酸严重泄露,通透性增加;并改变菌丝细胞壁中几丁质分布,降低细胞壁几丁质含量,增加细胞壁通透性,严重影响了细胞膜和细胞壁的功能,从而有效抑制了2种病原真菌的生长。
研究结果表明CPRE抗菌物质对柑橘果实采后主要病害绿霉、青霉和酸腐病原菌有强烈的抑制作用,显示其在采后柑橘保鲜中高的应用开发价值。后续将进一步分离鉴定其功能成分,并探究毛霉诱导柑橘诱导产生红色物质,对果实品质和生理生化的影响,为柑橘采后病害的安全、高效防治提供理论依据和基础。
[1] 李世忠,黄建国,李治玲,等. 柑橘皮渣降解菌的筛选及特性[J]. 食品科学,2014,35(23):188-192. Li Shizhong, Huang Jianguo, Li Zhiling, et al. Screening of two bacterial strains capable of degrading citrus pomace and their characteristics[J]. Food Science, 2014, 35(23): 188-192. (in Chinese with English abstract)
[2] 李鸿筠,姚廷山,王联英,等. 5种药剂对柑橘贮藏病害的防控效果评价[J]. 食品工业科技,2014,35(11):319-323. Li Hongyun, Yao Tingshan, Wang Lianying, et al. Evaluation on the control effect of 5 fungicides against citrus storage diseases[J]. Science and Technology of Food Industry, 2014, 35(11): 319-323. (in Chinese with English abstract)
[3] 赵一洁,唐毅,王威浩,等. 蜜橘酸腐病病原菌的分离鉴定以及不同抑菌剂处理对其控制效果[J]. 食品科学,2017,38(7):230-237. Zhao Yijie, Tang Yi, Wang Weihao, et al. Isolation and identification of sour rot pathogen of satsuma mandarin and inhibitory effects of three antifungal substances on it[J]. Food Science, 2017, 38(7): 230-237. (in Chinese with English abstract)
[4] Hao W N, Li H, Hu M Y, et al. Integrated control of citrus green and blue mold and sour rot byin combination with teas aponin[J]. Postharvest Biology & Technology, 2011, 59(3): 316-323.
[5] 张杰,董莎萌,王伟,等. 植物免疫研究与抗病虫绿色防控:进展、机遇与挑战[J]. 中国科学:生命科学,2019,49(11):1479-1507. Zhang Jie, Dong Shameng, Wang Wei, et al. Plant immunity and sustainable control of pests in China: Advances, opportunities and challenges[J]. Scientia Sinica (Vitae), 2019, 49(11): 1479-1507. (in Chinese with English abstract)
[6] 陈东菊,安敏敏,李丽兰,等. 植保素及其在增强作物抗性中的作用[J]. 分子植物育种. 2017,15(2):774-780. Chen Dongju, An Minmin, Li Lilan, et al. The mechanism of phytoalexin enhancing crop disease resistance[J]. Molecular Plant Breeding, 2017, 15(2): 774-780. (in Chinese with English abstract)
[7] 石延霞,关爱民,李宝聚. 瓜枝孢弱致病菌诱导黄瓜植保素的积累及抑菌活性[J]. 园艺学报,2007,34(2):361-365. Shi Yanxia, Guan Aimin, Li Baoju. Accumulation and activity of phytoalexins in cucumber induced by pathogenicity-imparired strain of[J]. Acta Horticulturae Sinica, 2007, 34(2): 361-365. (in Chinese with English abstract)
[8] 李珂,马良,杜鹏飞,等. 玉米萜类植保素代谢关键基因对小斑病侵染的防御响应分析[J]. 西北植物学报,2015,35(9):1776-1780. Li Ke, Ma Liang, Du Pengfei, et al. Gene expression of maize terpenoid phytoalexin metabolism in response to southern leaf blight[J]. Acta Botanica Boreali-Occidentalia Sinica, 2015, 35(9): 1776-1780. (in Chinese with English abstract)
[9] 王莹,孙文,张静晗,等. 叉毛蓬化学成分的体外抗菌及抗氧化活性研究[J]. 天然产物研究与开发,2015,27(2):251-254. Wang Ying, Sun Wen, Zhang Jinghan, et al. Antibacterial and antioxidant properties of compounds extracted fromL[J]. Natural Product Research and Development, 2015, 27(2): 251-254. (in Chinese with English abstract)
[10] Arras G, Cicco V D, Arru S, et al. Biocontrol by yeasts of blue mould of citrus fruits and the mode of action of an isolate of[J]. The Journal of Horticultural Science and Biotechnology, 1998, 73(3): 413-418.
[11] 蒋丹丹. 不同真菌诱导柑橘抗病性研究[D]. 武汉:华中农业大学,2015:42-43. Jiang Dandan. Study on the Resistance of Citrus Induced by Different Fungi[D]. Wuhan: Huazhong Agricultural University, 2015: 42-43. (in Chinese with English abstract)
[12] 彭洋,杨书珍,张美红,等. 橙子果皮诱导抗病组分对意大利青霉的抑菌活性及作用机制[J]. 食品科学,2019,40(9):1-6. Peng Yang, Yang Shuzhen, Zhang Meihong, et al. Antifungal activity and possible mode of action of induced disease-resistant components in orange peels against[J]. Food Science, 2019, 40(9): 1-6. (in Chinese with English abstract)
[13] 柳丽梅,张强,杨书珍,等. 碳酸铵和碳酸氢铵对柑橘青霉病的抑制作用[J]. 华中农业大学学报,2014,33(2):65-69. Liu Limei, Zhang Qiang, Yang Shuzhen, et al. Inhibitory effect of ammonium carbonate and ammonium hydrogen carbonate on blue mold of citrus fruits[J]. Journal of Huazhong Agricultural University, 2014, 33(2): 65-69. (in Chinese with English abstract)
[14] Yang S Z, Liu L M, Li D M, et al. Use of active extracts of poplar buds againstand possible modes of action[J]. Food Chemistry, 2016, 196: 610-618.
[15] Viragh M, Marton A, Vizler C, et al. Insight into the antifungal mechanism of Neosartorya fischeri antifungal protein[J]. Protein & Cell, 2015, 6(7): 518-528.
[16] Stalhberger T, Simenel C, Clavaud C, et al. Chemical organization of the cell wall polysaccharide core of Malassezia restricta[J]. Journal of Biological Chemistry, 2014, 289(18): 12647-12656.
[17] Shao X, Cheng S, Wang H, et al. The possible mechanism of antifungual action of tea tree oil on Botrytis cinereal[J]. Journal of Applied Microbiology, 2013, 114(6): 1642-1649.
[18] Ouyang Q, Tao N, Zhang M. A damaged oxidative phosphorylation mechanism is involved in the antifungal activity of citral against[J]. Frontiers in Microbiology, 2018, 9: 1-8.
[19] Ahmad A, Khan A, Kumar P, et al. Antifungal activity of Coriaria nepalensis essential oil by disrupting ergosterol biosynthesis and membrane integrity against Candida[J]. Yeast, 2011, 28(8): 611-617.
[20] Tao N G, Ouyang Q L, Jia L. Citral inhibits mycelial growth ofby a membrane damage mechanism[J]. Food Control, 2014, 41(2): 116-121.
[21] Paul S, Dubey R C, Maheswari D K, et al.Lfruit essential oil influencing on membrane permeability and surface characteristics in inhibiting food-bornepathogens[J]. Food Control, 2011, 22(5): 725-731.
[22] Aligiannis N, Kalpoutzakis E, Mitaku S, et al. Composition and antimicrobial activity of the essential oils of two Origanum species[J]. Journal of Agricultural and Food Chemistry, 2001, 49(9): 4168-4170.
[23] 张阳,王智群,邓世靖,等. 涂片真菌荧光染色法对真菌性角膜炎诊断价值的研究[J]. 中华眼科杂志,2019,51(8):601-608. Zhang Yang, Wang Zhiqun, Deng Shijing, et al. Diagnostic value of fungal fluorescence staining on corneal scrapings for fubgal keratitis[J]. Chinese Journal of Ophthalmology, 2019, 51(8): 601-608. (in Chinese with English abstract)
[24] 赵志刚,王学军,康殿民,等. 溴氰菊酯对德国小蠊碱性磷酸酶抑制效应[J]. 中国公共卫生,2018,34(11):1520-1522. Zhao Zhigang, Wang Xuejun, Kang Dianmin, et al. Inhibitory effect of deltamethrin on alkaline phosphatase in Blattella germanica[J]. Chinese Journal of Public Health, 2018, 34(11): 1520-1522. (in Chinese with English abstract)
[25] 关文强,李淑芬. 天然植物提取物在果蔬保鲜中应用研究进展[J]. 农业工程学报,2006,22(7):200-204. Guan Wenqiang, Li Shufen. Research advances in applicatlon of natural plant extracts to postharvest preservation of fruits and vegetables[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2006, 22(7): 200-204. (in Chinese with English abstract).
[26] Dou S, Liu S, Xu X, et al. Octanal inhibits spore germination ofinvolving membrane peroxidation[J]. Protoplasma, 2017, 254(4): 1539-1545
[27] Tian J, Wang Y Z, Zeng H, et al. Efficacy and possible mechanisms of perillaldehyde in control ofcausing grapedecay[J]. International Journal of Food Microbiology, 2015, 202: 27-34
[28] 邓利珍,刘可,冷飞凡,等. 川芎提取液对脐橙的防腐保鲜效果[J]. 农业工程学报,2016,32(7):296-302. Deng Lizhen, Liu Ke, Leng Feifan, et al. Effect of Ligusticum chuanxiong hort extract for antisepsis and preservation of navel orange[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(7): 296-302. (in Chinese with English abstract)
[29] 张立华,张元湖,曹慧,等. 石榴皮提取液对草莓的保鲜效果[J]. 农业工程学报,2010,26(2):361-365. Zhang Lihua, Zhang Yuanhu, Cao Hui. Effects of pomegranate peel extract on keep-freshing of strawberry[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2010, 26(2): 361-365. (in Chinese with English abstract)
[30] Liu S, Wang W J, Deng L L, et al. Control of sour rot in citrus fruit by three insect antimicrobial peptides[J]. Postharvest Biology and Technology, 2019, 149: 200-208.
[31] Klis F M. Review: Cell wall assembly in yeast[J]. Yeast, 1994, 10(7): 851-869.
[32] Jiao W X, Li X X, Zhao H D, et al. Antifungal activity of an abundant thaumatin-like protein from banana agaisntand its possible mechanism of action[J]. Molecules, 2018, 23(6): 1442-1457.
[33] Puig M, Concepció M, Lídia R, et al. Interaction of antifungal peptide BP15 with Stemphylium vesicarium, the causal agent of brown spot of pear[J]. Fungal Biology, 2015, 120(1): 61-71.
[34] Wei M L, Ge Y H, Li C Y, et al. Antifungal activity of epsilon-poly-L-lysine on Trichothecium roseum in vitro and its mechanisms[J]. Physiological and Molecular Plant Pathology, 2018, 103: 23-27.
[35] Hashimoto Y, Akira O, Toshio T, et al. Involvement of inhibition of chitin synthase activity in anethole-induced morphological changes of filamentous fungus[J]. Journal of Biotechnology, 2008, 136: S739.
[36] Xu X, Lei H, Ma X, et al. Antifungal activity of 1-methylcyclopropene (1-MCP) against anthracnose () in postharvest mango fruit and its possible mechanisms of action[J]. International Journal of Food Microbiology, 2017, 241(16): 1-6.
[37] Regnier T, Combrinck S, Veldman W, et al. Application of essential oils as multi-target fungicides for the control ofand other postharvest pathogens of citrus[J]. Industrial Crops and Products, 2014, 61: 151-159.
[38] Li Y, Chang W, Zhang M, et al. Diorcinol d exerts fungicidal action against candida albicans through cytoplasm membrane destruction and ROS accumulation[J]. Plos One, 2015, 10(6): e0128693.
[39] Cui H Y, Zhang X J, Zhou H, et al. Antimicrobial activity and mechanisms of salvia “sclarea” essential oil[J]. Botanical Studies, 2015, 56(1): 1-8.
[40] Hajime I, Taiji N, Yukihiko H, et al. Bactericidal catechins damage the lipid bilayer[J]. Biochimica et Biophysica Acta, 1993, 1147(1): 132-136.
Inhibition of induced citrus peel disease-resistant components againstand
Xiong Qi1, Yang Shuzhen1, Cao Zhengqing1, Zhang Meihong1, Cheng Yunjiang2, Peng Litao1※
(1. College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070; 2. College of Horticulture and Forestry Science, Huazhong Agricultural University, Wuhan 430070, China)
Citrus are popular worldwide fruits due to the high nutritional value and special flavor, but they are easy to decay during storage and transportation, particularly on green mold, blue mold and sour rot. Alternatively, disease controlling methods are also necessary to protect from the bandage of synthetic chemical fungicides due to the health and environmental concerns. In a previous study, the fruits cannot decay when red pigment substances were accumulated in the fruit peels around wounding sites after inoculation with Actinomucor elegan, indicating the Citrus Peel Red-substances Extract (CPRE) has strong antifungal activity against Penicillium italicum. Here, this study aims to assess antifungal effects of the partially purified CPRE on Penicillium digitatum and Geotrichum citri-aurantii, the casual agents for green mold and sour rot, respectively. To further explore the possible inhibition mechanism of the substance against the pathogens, the damage on cell wall was evaluated by chitin content and distribution, and leakage of alkaline phosphatase, while the interferences on cell membrane were investigated to assess membrane integrity, release of proteins and nucleic acids, extracellular electronic conductivities and contents of lipids in the hyphae cells of both paghogens. The results showed that at the concentration of 50 to 200 μg/mL, CPRE exhibited strong inhibitory effects on spore germinations, elongations of germ tubes, and mycelia growth of P.digitatum and G. citri-aurantii, in a concentration dependent manner, with the Minimal Inhibitory Concentration (MIC) at 200 μg/mL for both pathogens. Calcofluor white staining, an agent which specifically binds to chitin exposed, revealed that the chitin distribution and cell wall integrities of the hyphae of both pathogens were markedly interfered when incubated with CDPC at 1/2 MIC for 24 hours. CPRE treatments also made chitin contents decrease by 30.29%, 52.64%, and accelerate the release of alkaline phosphatase in the mycelia of both pathogens, indicating that cell wall structures and functions were disturbed by the active components in CPRE. Furthermore, membranes of the hyphae cells of both pathogens can be deteriorated after CPRE treatments at the concentration of 100g/mL, as indicated by propidium iodide staining, which emits red fluorescence when entered into dead cells and bind with nucleic acids. The extracellular electronic conductive of the hyphae cells of both pathogens increased significantly after 6 hours of incubation with CPRE within the concentrations tested, indicating that the metal ion balance was disrupted in the treated cells. There were significant differences in leakages of soluble proteins and nucleic acids from hyphae cells with CPRE treatments, showing a consistence with that of extracellular conductivity assays. Moreover, CPRE treatments reduced the total contents of cell lipid in hyphae of both pathogens. These results demonstrated that CPRE can effectively inhibit both pathogens by damaging or interfering with the cell membranes and cell walls of the hyphae. The powerful antifuangal effects of CPRE against P. digitatumand G. citri-aurantii can offer the great potential application prospects in control of postharvest decay of citrus fruits, and futher provide a theoretical basis for the development of natural products with antifungal effects.
bacteria; Citru Peel Red-substance Extract(CPRE);Penicillium digitatum;Geotrichum citri-aurantii; antifungal; cell membrane; cell wall
熊琪,杨书珍,曹正清,等. 毛霉诱导脐橙产抗病物质对指状青霉和酸腐菌的抑制[J]. 农业工程学报,2020,36(9):315-322.doi:10.11975/j.issn.1002-6819.2020.09.036 http://www.tcsae.org
Xiong Qi, Yang Shuzhen, Cao Zhengqing, et al. Inhibition of induced citrus peel disease-resistant components againstand[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(9): 315-322. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.09.036 http://www.tcsae.org
2020-01-13
2020-04-17
国家自然科学基金资助项目(31871850)
熊琪,从事果蔬贮藏与保鲜方面研究。Email:2428316399@qq.com
彭丽桃,博士,教授,博士生导师,主要从事果蔬贮藏与保鲜工作。Email:penglt12@mail.hzau.edu.cn
10.11975/j.issn.1002-6819.2020.09.036
S609+.3; S666.4
A
1002-6819(2020)-09-0315-08

