野外模拟扰动方式对太湖浮游植物群落结构的影响
潘雯雯,杨桂军*,芮 政,钟春妮,秦伯强,杨宏伟
1.江南大学环境与土木工程学院,江苏 无锡 214122 2.中国科学院南京地理与湖泊研究所,湖泊环境与科学国家重点实验室,江苏 南京 210008
浮游植物作为水生生态系统的重要初级生产者[1],在水体物质运输和能量传递过程中发挥着重要作用[2-3]. 一般而言,为了应对外界环境条件的变化,浮游植物能够迅速做出响应,所以水体的特征状况可以通过浮游植物表现出来[4]. 自然水体中,浮游植物群落除受光照、营养盐及pH等环境条件的影响外[5],同时也会受到不同时间和空间尺度上扰动过程的控制[6]. 风和水流造成的水环境扰动是水体的固有特征,扰动能够通过影响光照、营养盐、浮游动物等直接或间接作用于浮游植物[7-8],对浮游植物的生长和群落结构的演替等均有至关重要的影响[9-11].
扰动可以影响浮游植物的空间分布[12-13]以及蓝藻水华[14]的形成. 研究[12,14-15]发现,太湖中蓝藻的集聚(消散)与风速(或波高)有关,蓝藻在风速<3 m/s(或波高<6.2 cm)时以水平迁移为主,并易堆积集聚形成蓝藻水华;蓝藻在风速>3 m/s(或波高>6.2 cm)时以垂直迁移为主,不利于蓝藻聚集于水面形成水华. 扰动能够影响藻类的营养盐吸收速率,不同形态、大小的藻类受扰动影响不同,营养盐吸收速率也不同[16-18]. 此外,一些大个体浮游植物细胞容易受到较强扰动条件的影响. 如抑制藻细胞的分裂增殖、造成细胞的机械损伤、改变浮游植物沉降量和生物量等[19-21]. 扰动还可以直接影响藻类的光合作用,即提高藻类的光合效率或电子传递速率[22]. 研究[20-21]发现,扰动过程中个体较大的浮游植物种类的沉降量减少,而光合活性和生物量则显著增加,个体较小浮游植物种类则相反. 不同浮游植物种类对不同强度和方式扰动的耐受能力和敏感度也不同[23]. Ptacnik等[24]试验表明:在较强扰动条件下,体型小、不具上浮能力的浮游植物种类占据优势;而较弱扰动条件下,体型较大、上浮能力强的种类占优势. Cardoso[25]研究发现,在浅水湖泊中,扰动可以控制和决定浮游植物的群落结构.
太湖是中国第三大淡水湖,水域面积 2 338 km2,位于长江下游的三角洲平原地区,其对于周围城市的经济发展,有着举足轻重的地位,但发展的同时也带来了湖泊富营养化、蓝藻水华频频暴发等环境问题[26-28]. 太湖平均深度1.9 m,最大深度2.6 m,作为一个典型的大型富营养浅水湖泊,太湖受风浪扰动的影响很大[26]. 关于风浪扰动对太湖浮游植物影响的已有研究主要集中在微囊藻,并且大多为室内试验研究,野外模拟扰动对浮游植物影响的研究相对较少,且野外模拟扰动都是单一的间歇扰动或者单一持续扰动模式. 在自然条件下,相比于持续流动的河流,间歇式风浪扰动的太湖蓝藻水华暴发更为频繁. 笔者推测不同的扰动方式可能是影响浮游植物群落结构变化,导致太湖蓝藻水华暴发的重要原因之一. 然而,到目前为止,未见野外模拟不同扰动方式(如间歇扰动和持续扰动)对浮游植物尤其是微囊藻生长的影响研究. 因此,该研究以太湖浮游植物为研究对象,开展野外模拟试验探讨扰动方式对浮游植物群落结构尤其是微囊藻的影响,该研究结果将有助于提高人们对太湖蓝藻水华形成机理的认识,并为防治太湖蓝藻水华暴发提供理论依据.
1 材料与方法
野外模拟试验在江南大学试验平台进行. 试验从2017年5月9—31日,一共进行了22 d. 试验分别设置对照组、持续扰动组和间歇扰动组,每组3个平行. 取太湖梅梁湾远离岸边水面下20 cm的湖水,放置在相同干净的试验装置(直径为50 cm、高为60 cm)中,装置中水深均为50 cm. 试验前对原水样进行各项理化指标的测定和计算,最终通过添加营养盐(TN用NaNO3配制、TP用K2HPO4·3H2O配制)使所有试验水样的ρ(TN)和ρ(TP)一致,分别为10、0.5 mg/L(氮、磷质量浓度设置参考杨桂军等[29]研究). 水样静置1 d后正式开始试验,其中对照组不扰动,持续扰动组每天扰动〔变频造浪泵(WP-60, DC60W, 中山市捷宝电子电器有限公司)设置S2、W1档,获得水平方向约5 cm高波浪,使用手持式声学多普勒流速仪(FlowTracker, 测速范围0.001~4.5 m/s, 准确度1%, 上海捷辰仪器有限公司)测定装置中心位置处水流速度,得出流速的均方根(root mean square velocities,U)为0.53 cm/s,在太湖水动力范围(0.49~7.69 cm/s)[3]内;间歇扰动组则在试验第1、5、9、13、17、21天扰动(造浪泵设置与持续扰动组相同,可获水平方向约5 cm高波浪),每次扰动时间为24 h,其他时间关闭造浪泵,不进行扰动. 为避免生物黏附,每天18:30用软刷轻刷装置内壁(底部除外).
在试验第0、1、5、9、13、17、21天每天09:00采集混合均匀的水样 1 000 mL,并测定相关指标,主要包括物理指标、化学指标和生物指标. 每天09:00测定每个试验装置中水温(WT)、pH、光照强度(装置中心水面下25 cm)等,样品带回实验室后及时测定ρ(DTN)(DTN表示溶解性总氮)、ρ(NH4+-N)、ρ(NO3--N)、ρ(DTP)(DTP表示溶解性总磷)、ρ(PO43--P)、浮游植物等. 水样理化指标测定方法见文献[30]. 浮游植物用鲁哥试剂(最终浓度1%)进行固定和保存,样品固定保存后需静置2 d(48 h),再去掉上清液将其浓缩为原水样体积的10%. 然后,吸取100 μL混合后的浓缩样品,均匀放置在浮游植物计数框中,并在显微镜(E200, 日本尼康公司)400倍下进行分类计数,浮游植物的鉴定参考《中国淡水藻类:系统、分类及生态》[31]. 浮游植物的生物量由不同种类浮游植物的细胞数与细胞大小计算所得. 浮游植物群落的生物多样性采用Shannon-Wiener指数(H)表征,计算公式:
(1)
Pi=ni/N
(2)
式中,S为浮游植物群落中物种总数,Pi为第i种的个体数占总个体数的比例,ni为浮游植物群落中第i物种的个体数,N为所有浮游植物物种的个体数之和.
数据处理过程中,使用Origin 8.0软件制图,采用单因素方差分析(one-way ANOVA)方法分析不同处理组间物理、化学和浮游植物的差异,使用SPSS 22.0软件对数据进行统计分析,依据P<0.05或P<0.01判断显著性差异水平.
2 结果与分析
2.1 野外模拟试验的环境特征
试验期间,各处理组中的环境条件如表1所示. 由表1可见,所有试验装置内水温(WT)的变化范围为18.7~28.5 ℃. 光照强度、ρ(SS)、ρ(Chla)在各处理组之间均存在极显著性差异(P<0.01). 持续扰动组ρ(DTN)、ρ(DTP)、ρ(NO3--N)、ρ(PO43--P)、pH与对照组之间存在显著性差异(P<0.05). 持续扰动组ρ(NO3--N)间歇扰动组之间存在极显著性差异(P<0.01);间歇扰动组ρ(PO43--P)与对照组之间存在极显著性差异(P<0.01). 结果表明,扰动方式显著影响了光照强度和营养盐质量浓度,进而影响了浮游植物的生长.
由图1可见,试验过程中,各处理组ρ(DTN)均呈现逐渐下降的变化趋势,而ρ(DTP)在试验前5 d内快速下降,之后趋于稳定. 试验期间,各处理组中ρ(Chla)变化不同,到达峰值的时间也不同. 在对照组中,ρ(Chla)增长较为缓慢,在试验第5天达到峰值(0.051 mg/L);与对照组相比,持续扰动组和间歇扰动组ρ(Chla)在试验开始时快速增长,并分别在试验第9天和第5天达到峰值,分别为0.279和0.165 mg/L.ρ(SS)在各处理组中变化与ρ(Chla)相似,对照组中ρ(SS)相比于试验组变化并不明显;持续扰动组和间歇扰动组ρ(SS)在试验开始后快速增长,峰值分别达135.33和122.33 mg/L,远高于对照组(47.33 mg/L). 试验期间,各处理组光照强度一直处于剧烈波动的状态,且对照组和间歇扰动组光照强度远大于持续扰动组(P<0.01).

表1 试验期间不同处理组水样理化指标特征
注:字母相同表示无显著性差异,字母不同表示差异性显著(P<0.05).
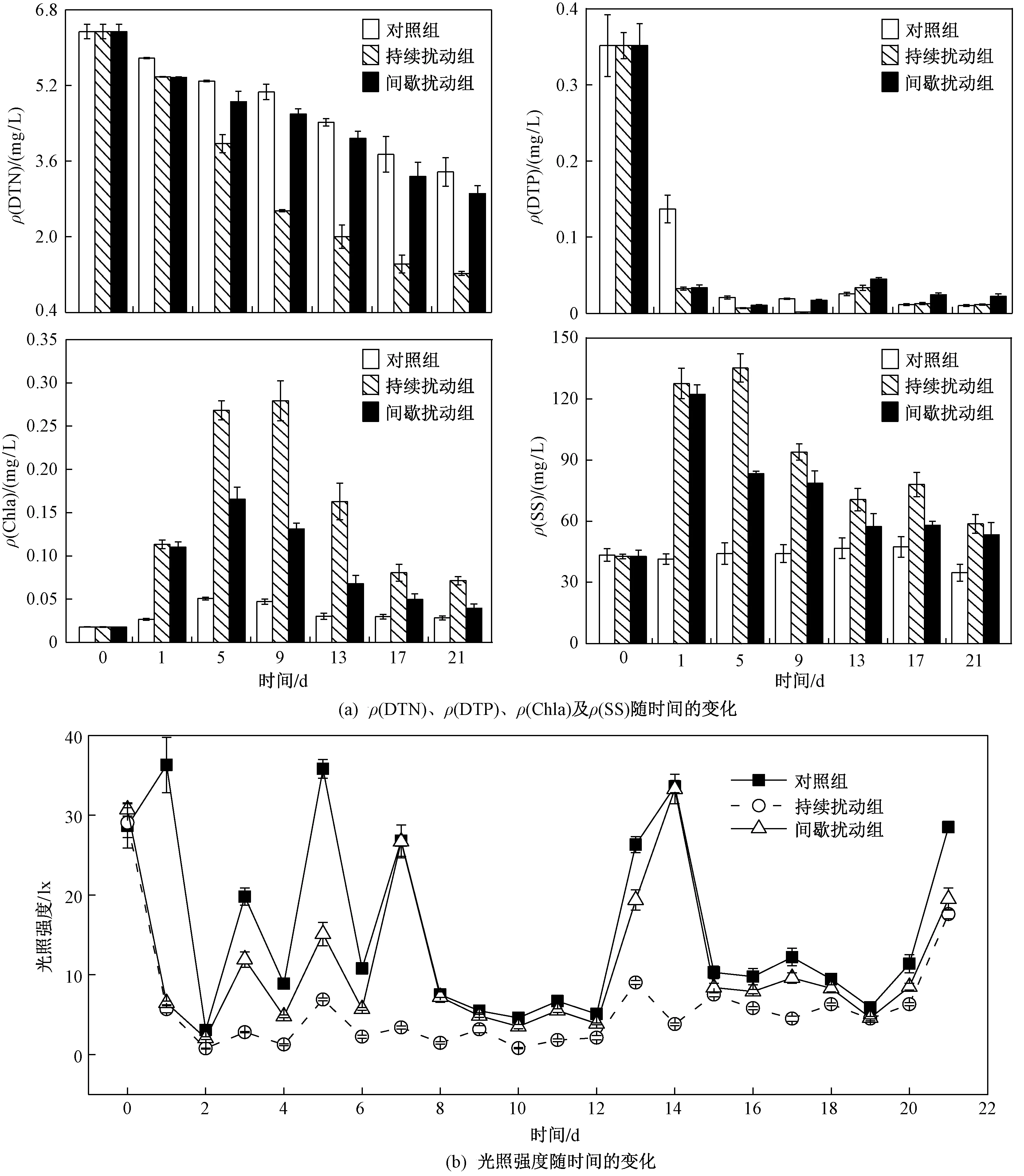
图1 试验期间各处理组主要理化参数随时间的变化Fig.1 The main physical and chemical parameters of all treatment groups change with time during the experiment period
2.2 扰动方式对浮游植物群落生长的影响
整个试验期间,浮游植物主要由蓝藻、绿藻和硅藻组成,其中蓝藻和绿藻占大多数(见图2). 各处理组中,持续扰动组平均细胞密度和生物量最高,分别达3.48×108L-1和58.27 mg/L; 其次是间歇扰动组,分别为1.23×108L-1和19.42 mg/L; 对照组最低,分别为1.06×108L-1和5.92 mg/L. 各处理组浮游植物平均细胞密度和生物量均存在极显著性差异(P<0.01). 总体来看,所有处理组中,蓝藻的平均细胞密度占比最大,为83.28%~95.52%,其次是绿藻,为3.84%~14.83%;但绿藻的平均生物量占比最大,为46.65%~73.06%,蓝藻只占14.57%~36.83%;硅藻和其他藻类的平均细胞密度和生物量占比均相对较少.
由图3可见,试验期间蓝藻细胞密度在所有处理组的藻类中始终是最高的,但变化趋势不同. 对照组中蓝藻细胞密度在前13 d一直处于上升状态,第13天达到最大值(3.16×108L-1),之后逐渐降至0.74×108L-1;持续扰动组中蓝藻细胞密度在整个试验期间一直上升,试验结束时达6.27×108L-1,值得注意的是,在试验第9~13天,上升趋势相对平缓,通过进一步鉴定分析发现,试验期间蓝藻中主要优势种发生了改变,由微囊藻逐渐转变为湖生伪鱼腥藻;间歇扰动组中蓝藻细胞密度在试验前5 d快速上升,第9天达到最大值(1.70×108L-1),随后降至0.71×108L-1. 与蓝藻相比,绿藻、硅藻及其他藻细胞密度变化并不显著. 所有处理组中,浮游植物生物量均呈先增后降的趋势(P<0.01). 与对照组和间歇扰动组相比,持续扰动组中浮游植物的生物量更高,且在试验的第9天达到最高值(129.72 mg/L),对照组中浮游植物在试验开始的2 d快速增长并达到最大值(12.67 mg/L);而间歇扰动组则在试验第5天生物量最高(39.53 mg/L),且试验组生物量均远高于对照组. 结果表明,相比于对照组,不同扰动方式均能够促进浮游植物藻类的生长. 另外,所有处理组中,绿藻的细胞密度占比低于蓝藻,但绿藻的生物量占比却高于蓝藻,尤其是持续扰动组.
2.3 扰动方式对浮游植物优势种的影响
试验开始时,浮游植物由微囊藻、四尾栅藻、湖生伪鱼腥藻和其他藻类组成,占比分别为77.84%、2.20%、0.55%、19.41%,其中微囊藻为浮游植物优势种(见图4). 在对照组中,试验前5 d浮游植物优势种均为微囊藻,占比为75.59%~83.88%,而后快速降至4.72%,失去群落中优势地位,逐渐被湖生伪鱼腥藻取代,试验结束时湖生伪鱼腥藻成为浮游植物主要优势种,占比为62.93%~94.40%;在持续扰动组中,从试验开始至试验第9天,微囊藻始终是浮游植物优势种,占比为47.81%~77.84%,试验第5天,绿藻中的四尾栅藻与微囊藻同时成为浮游植物优势种,占比分别为36.22%、47.81%,随后微囊藻和四尾栅藻失去其优势并分别降至5.62%、0.66%,湖生伪鱼腥藻逐渐取代微囊藻和四尾栅藻成为浮游植物优势种,占比为52.81%~90.52%. 而在间歇扰动组中,试验期间微囊藻始终是浮游植物优势种,占比平均值为84.61%,试验结束时为86.22%. 该研究结果表明,间歇扰动最有利于微囊藻维持其在浮游植物群落中的优势.

图2 各处理组蓝藻、绿藻、硅藻和其他藻平均细胞密度和平均生物量Fig.2 Mean algal cell density and biomass of Cyanophyta, Chlorophyta, Bacillariophyta and others in all treatment groups
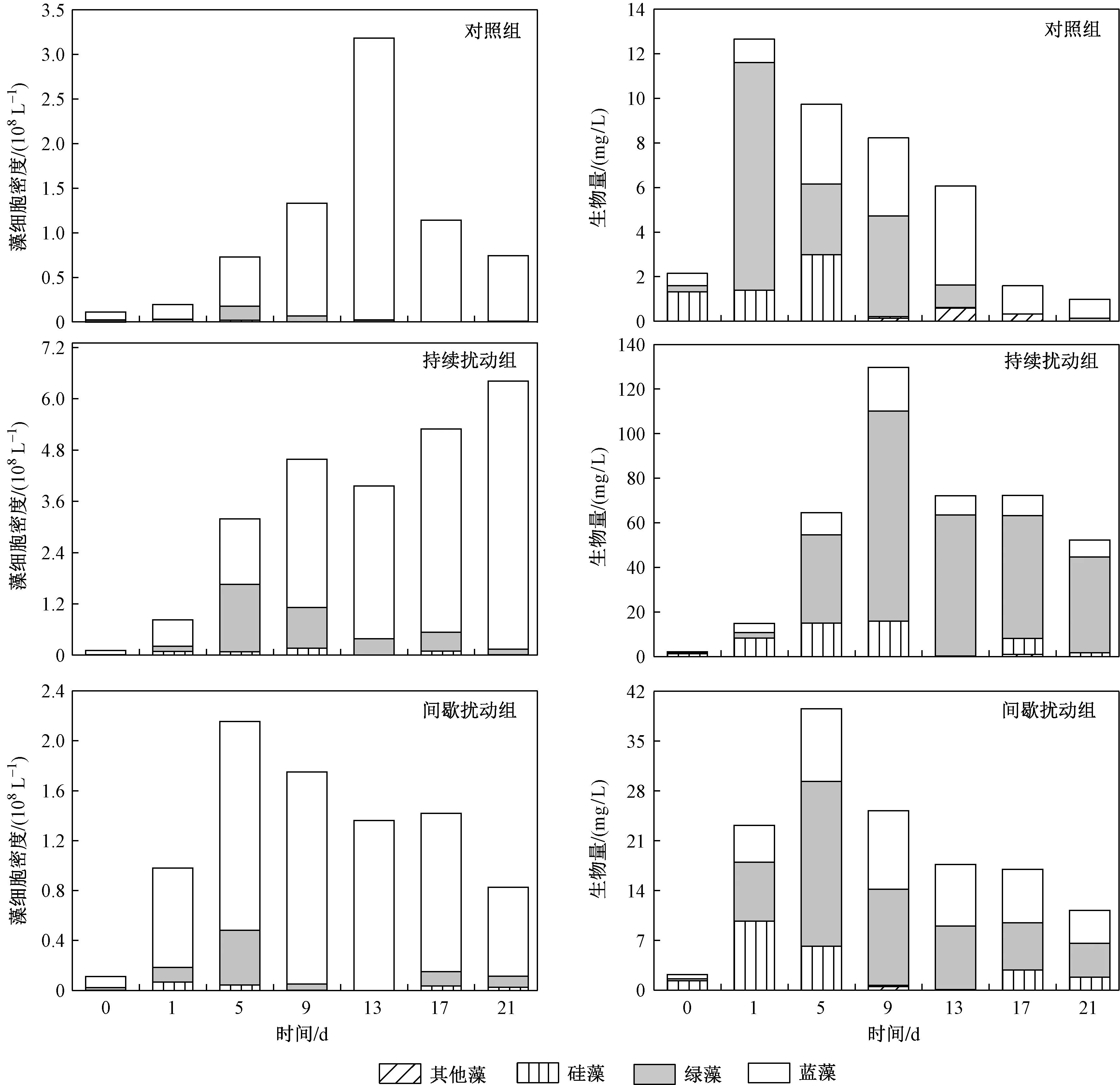
图3 试验期间蓝藻、绿藻、硅藻及其他藻的细胞密度和生物量在各处理组中的变化Fig.3 Changes in cell density and biomass of Cyanophyta, Chlorophyta, Bacillariophyta and others during the experiment period

图4 试验期间浮游植物优势种(微囊藻、湖生伪鱼腥藻、四尾栅藻)在各处理组中的变化Fig.4 Changes of the dominant species of phytoplankton (Microcystis spp., Pseudanabaena limnetica, and Scenedesmus quadricauda) during the experiment period
2.4 扰动方式对浮游植物群落生物多样性的影响
试验期间,各处理组共发现43种浮游植物. 由图5可见,持续扰动组中Shannon-Wiener指数显著高于对照组和间歇扰动组(P<0.01),持续扰动组中Shannon-Wiener指数平均值为1.63,间歇扰动组和对照组分别为1.03和1.02. 试验开始后5 d内,对照组、持续扰动组和间歇扰动组中Shannon-Wiener指数变化均呈先降后升的趋势,第5天后各处理组Shannon-Wiener指数的变化各不相同,且持续扰动组与对照组和间歇扰动组之间存在极显著性差异(P<0.01),对照组在第5天达到最大值(1.54),试验结束时降至0.35;持续扰动组中,Shannon-Wiener指数在第13天达到最大值(2.21),之后降至0.65;间歇扰动组中,Shannon-Wiener指数在第5天达到最大值(1.75),随后呈先降后升的趋势,在试验第13天降至最低值(0.24). 所有处理组浮游植物种类如表2所示. 由表2可见:试验开始时,浮游植物种类均为13种,主要是蓝藻门、硅藻门和绿藻门的藻类;试验结束时,对照组和间歇扰动组浮游植物种类数均有所下降,分别为4和7种,持续扰动组浮游植物种类为15种.

图5 各处理组Shannon-Wiener指数平均值及其试验期间变化Fig.5 The mean of Shannon-Wiener index and the variation of all treatment groups during the experiment period
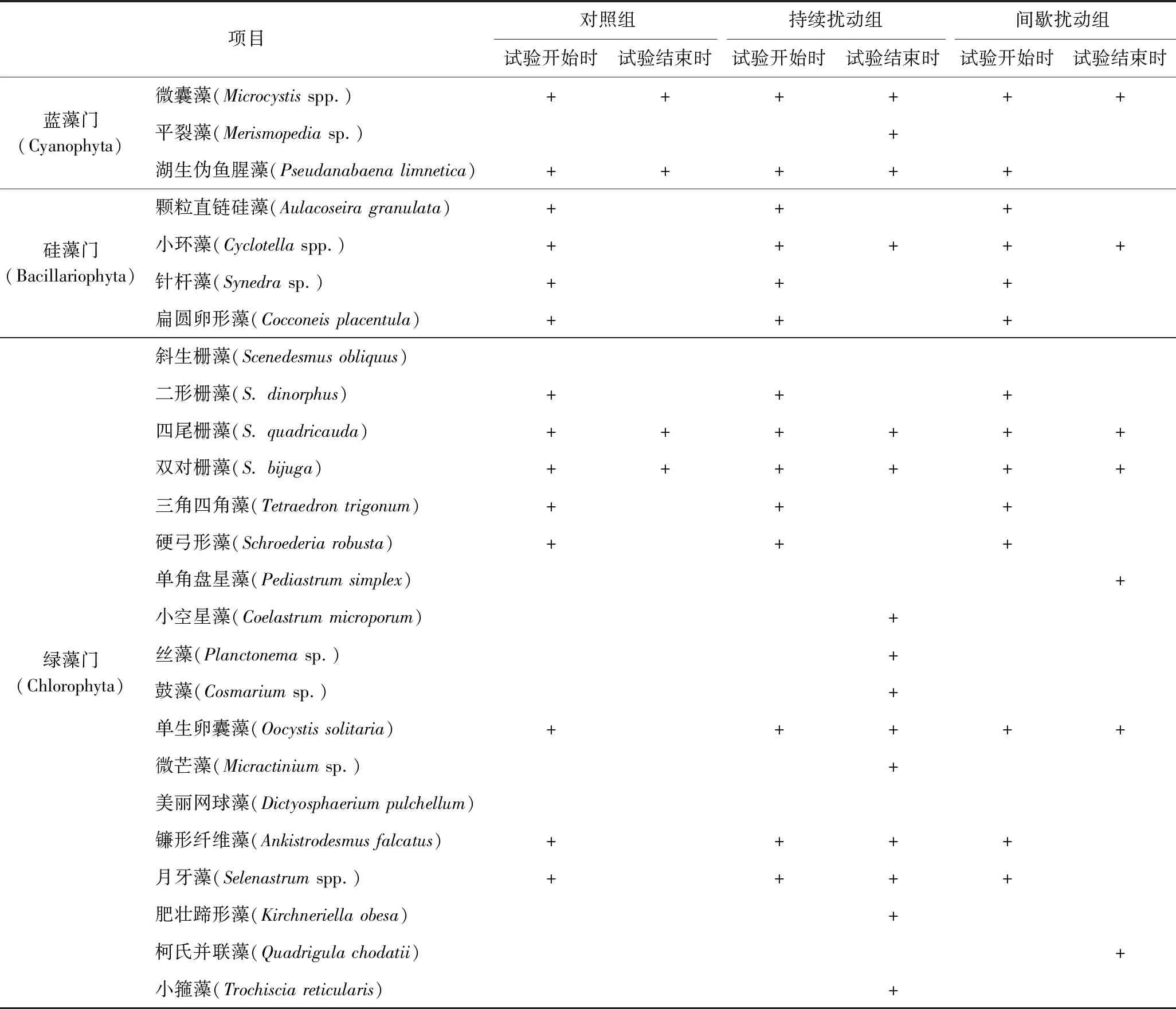
表2 各处理组试验开始和结束时浮游植物种类组成
3 讨论
3.1 扰动方式对浮游植物生物量的影响
该研究发现扰动方式显著影响了浮游植物的生物量,试验中持续扰动组浮游植物生物量显著高于间歇扰动组和对照组. 在自然水体中,浮游植物生物量的增加途径主要为生产量和再悬浮量,损失途径主要为沉降量和被捕食量,这些过程与浮游植物优势种群构成密切相关[32-33]. 该试验中,扰动组引起的颗粒物再悬浮虽然降低了光强强度,但促进了氮、磷营养盐的传递速率[34],促进了浮游植物对营养盐的吸收[35],增加了藻类的再悬浮量,降低了藻类沉降损失[36]. 另外,持续扰动组浮游动物密度为436 L-1,显著低于间歇扰动组(805.4 L-1)(数据来源于笔者的毕业论文,暂未发表),表明持续扰动组浮游植物被浮游动物摄食损失要小于间歇扰动组,以上因素可能是该试验持续扰动组浮游植物生物量显著高于间歇扰动组和对照组的原因. 该试验研究结果与周健等[3,37]野外模拟试验结果类似,即扰动处理组浮游植物生物量显著高于静止组. 然而,也有不同的研究结果,李林等[38]室内扰动试验发现,间歇性扰动条件下微囊藻密度较连续性水流条件下的高;颜润润等[39]认为,在富营养条件下扰动对微囊藻的生长和生物量的影响不大;芮政等[40]认为,间歇扰动组水华微囊藻生物量显著高于静止组和持续扰动组,且持续扰动组微囊藻生物量显著低于静止组. 该试验为野外模拟试验,试验环境和条件设置(如扰动强度、扰动时间、营养盐浓度、光照及藻类的组成等因素)与其他试验的差异可能是导致试验结果不同的原因.
3.2 扰动方式对浮游植物群落结构的影响
该研究发现,在该试验条件下,间歇扰动有利于维持微囊藻在浮游植物竞争中的优势地位,持续扰动组浮游植物Shannon-Wiener指数显著高于对照组和间歇扰动组. 扰动作为水体中重要的物理因素,其不仅会改变光照环境和营养盐供给从而促进或抑制浮游植物的初级生产量[41-42],而且还直接影响浮游植物细胞的沉降通量[37],以及通过影响浮游动物牧食能力从而间接作用于浮游植物的现存量和群落结构[43]. 自然水体中浮游植物不同种类间相互竞争,只有最适应所生活的特定环境条件的种类才能成为优势种. 该研究中,微囊藻因为具有伪空泡,可以根据水下光强自主上浮或下沉以获得最适光照. 试验期间,间歇扰动组水下光照强度显著低于对照组(见表1),表明扰动引起水下光强降低,当扰动停止后,微囊藻快速上浮到水面以获取光照,从而在与其他藻的竞争中占据优势地位. 另外,芮政等[40]研究发现,间歇扰动有利于微囊藻生长和保持大群体形态. 浮游动物比较喜欢摄食小个体的藻类,而微囊藻群体因为个体太大不容易被浮游动物所摄食,所以微囊藻在与其他藻类的竞争中获得进一步的优势. 这可能是间歇扰动组微囊藻成为优势种并维持优势地位的原因. 而对照组和持续扰动组下,湖生伪鱼腥藻因其丝状结构具有更好的营养盐吸收速率[44],有利于丝状湖生伪鱼腥藻的生长. 另外,丝状湖生伪鱼腥藻因其丝状形态特点不利于轮虫(该试验中浮游动物优势类群)的捕食,XIAO等[44]研究发现,持续扰动对丝状藻的生长速率具有促进作用,因而在浮游植物竞争中具有一定的优势,所以在持续扰动组和对照组中丝状湖生伪鱼腥藻最终取代微囊藻成为优势种.
由于浮游植物繁殖速率较高,一般为数小时到数天,而扰动引起的沉积物再悬浮的持续时间一般在数天,所以能够显著影响浮游植物在短时间尺度上的特征(如生产力、现存量和群落构成)[45],还能够干扰较长时间尺度的变化(如季节演替)[43]. 扰动引起的沉积物再悬浮作为一种环境干扰,其将促进浮游植物群落的多样性,削弱某一种群优势的稳定性[46]. 扰动通过影响不同藻类对营养盐和光的竞争优势,改变浮游植物物种间的竞争平衡[47-48],使水生生态系统中浮游植物生物多样性发生改变. 这可以解释该研究中持续扰动组浮游植物生物多样性高的原因,另外,间歇扰动组中,微囊藻始终是试验期间浮游植物的优势种,大量微囊藻漂浮在水体表面将抑制其他藻的生长,导致浮游植物生物多样性指数降低;对照组相对稳定的光照和营养盐条件不利于浮游植物的生长和生物多样性的维持. Padisak等[49]对Balaton湖的研究显示,群落多样性指数在风浪发生时增加,在风平浪静时则降低. 林秋奇等[46,50]研究发现,在持续扰动的作用下,浮游植物群落难以形成相对稳定的结构,不利于优势种群生长繁殖,减缓了物种间的竞争压力,使群落生物多样性指数上升. 然而,也有不同的研究结果,许炎生[51]野外模拟试验显示,试验开始时优势类群为绿藻,试验结束时静止组优势种仍是绿藻,而扰动组为绿藻或隐藻;宋晓兰[37]野外模拟试验报道,试验开始时优势类群为隐藻,试验结束时静止组绿藻占优势,而扰动组则为隐藻或绿藻占优势;周健[3]野外模拟试验发现,试验开始时优势类群为蓝藻和硅藻,试验结束时静止组是微囊藻占优势,而所有扰动组则是硅藻占优势. 野外条件如温度、光照以及扰动强度、扰动时间和试验开始时浮游植物组成的差异,可能是该研究与其他研究结果不同的原因.
太湖是典型的大型浅水湖泊,风浪扰动频繁,风浪扰动必然对浮游植物群落结构产生重要影响. 由于该试验扰动强度和扰动时间等只反映了太湖扰动的部分情况,太湖风浪扰动对浮游植物,尤其是微囊藻水华形成的影响还需要更加深入的研究.
4 结论
a) 所有处理组中,持续扰动组浮游植物生物量和ρ(Chla)增长最为显著,对照组、间歇扰动组和持续扰动组浮游植物平均生物量分别为5.92、19.42、58.27 mg/L(P<0.01),表明在该试验条件下适宜强度的持续扰动促进浮游植物的生长,有利于浮游植物生物量的积累.
b) 试验期间,间歇扰动组浮游植物优势种始终是微囊藻,对照组和持续扰动组中微囊藻最终被湖生伪鱼腥藻取代. 试验结束时,对照组、持续扰动组和间歇扰动组中微囊藻占比分别为4.72%、5.62%、86.22%,表明在该试验条件下,扰动方式显著影响浮游植物优势种,间歇扰动有利于微囊藻维持其在浮游植物竞争中的优势.
c) 对照组、间歇扰动组和持续扰动组中Shannon-Wiener指数分别为1.02、1.03和1.63,持续扰动组显著高于对照组和间歇扰动组. 试验结束时,对照组、间歇扰动组和持续扰动组浮游植物种类数分别为4、7和15种,表明在该试验条件下,扰动方式显著改变浮游植物生物多样性,适宜强度的持续扰动有利于浮游植物维持其生物多样性.

