污泥腐殖酸对Cd2+的吸附特性
张 康,戴 亮,赵伟繁,王 刚,未碧贵,任 珺
兰州交通大学环境与市政工程学院, 甘肃 兰州 730070

Cd是环境中典型的重金属污染物[9],化学毒性强,易通过食物链和被Cd污染的空气等方式进入人体,且在人体内代谢缓慢,对人体具有极大危害. 据统计,全世界每年向环境中排放Cd的量高达2.2×104t[10],我国黄河、淮河、滦河等水系Cd污染超标在16%以上[11],Cd污染形势已十分严峻. 常用的去除水中Cd2+的方法有吸附法、离子交换法、化学沉淀法和生物法等[12]. 吸附法是通过吸附剂吸附、螯合和离子配位等作用去除水中重金属的方法,具有吸附剂来源广、重金属去除率高、操作简单等优点,被认为是去除水中重金属最理想的方法. 目前,活性炭作为吸附水中重金属最常用的吸附剂,其能够吸附多种重金属,具有吸附能力强、吸附容量大,去除率高的特点,但价格较贵且吸附一段时间后需要再生,当前技术条件下再生效率较低,使其应用受到一定的限制. 因此,寻找一种高效、价廉的吸附剂成为研究人员关注的热点.
HA (humic acid, 腐殖酸)是有机质的重要组成部分,含有丰富的活性官能团,如酚羟基、酮基、羧基、甲氧基等[13],使其可以通过范德华力、表面吸附、络合作用等机制与重金属离子相互作用,对重金属离子具有较强的结合能力,是具有发展前景的吸附重金属离子的环境功能材料[14-15]. 杨毅等[16]用河流底泥提取的HA吸附水中的Cd,结果表明,投加Cd2+总浓度为10 μmol/L、溶液pH为6.0时,Cd2+的去除率为71.4%. 陆中桂等[17]用风化煤中提取的HA吸附水中的Cd和Pb,结果表明,HA对Cd和Pb的吸附为物理吸附和化学吸附的复合吸附过程. 陈盈等[18]从草炭、褐煤和风化煤中提取了3种来源的HA,研究其在不同pH下对Pb和Mn吸附率的变化规律,发现pH显著影响HA与Pb和Mn的络合反应. 当前国内外学者对于提取自矿物(如褐煤、风化煤)、土壤、底泥中的HA作为吸附材料的研究相对较多,而关于S-HA (sludge-based humic acid,污泥腐殖酸)的研究相对较少,且主要集中在污泥堆肥过程中HA组分和结构的变化[19-20],以S-HA为吸附剂吸附水中重金属Cd的研究更是鲜见报道.
该研究采用碱溶酸析法对污水厂剩余污泥中的HA进行提取纯化,通过元素分析、FT-IR(傅里叶红外光谱分析)、SEM-EDS(外观形态分析)等方法,分析S-HA的表面特性和结构特征,并通过静态吸附试验,研究S-HA对溶液中Cd2+的吸附性能,利用等温吸附模型、吸附动力学模型和吸附热力学模型分析试验数据,揭示S-HA对Cd2+的吸附机制,以期为污泥的资源化利用和水体Cd2+的去除提供新的途径.
1 材料与方法
1.1 S-HA的提取与纯化
该试验污泥采自兰州市七里河-安宁污水处理厂浓缩池,污水主要来源于城市生活污水. 将污泥置于阴凉通风处,风干后研磨过100目(0.149 mm)筛. S-HA 的提取采用国际腐殖酸协会(IHSS)推荐的方法. 将一定量的污泥放入Na4P2O7/NaOH混合溶液中,60 ℃下恒温振荡12 h. 静置2 d后弃去沉淀物,将提取液过0.45 μm滤膜,向滤液中加入浓盐酸,调节滤液pH为1,放入70 ℃恒温水浴中1 h后离心,弃去上清液,下层沉淀即为S-HA粗品. 将提取的S-HA 粗品溶于KOH溶液中,并加入固体KCl后静置6 h,离心后弃去下层沉淀,上清液用浓盐酸调节pH为l,70 ℃水浴恒温1 h,离心并弃去上清液. 下层沉淀中加入一定体积的0.3 mol/L HF和0.1 mol/L HCl(体积比为1∶1)溶液后倒入渗析袋密封,然后置于去离子水中,以去除HA中的Cl-和灰分,最后倒入表面皿中置于鼓风干燥箱45 ℃烘干即得S-HA纯品.
1.2 S-HA的表征
S-HA的元素组成采用元素分析仪(Vario EL,德国Elementar公司)测定;表面官能团利用红外-拉曼光谱仪(VERTEX 70,德国布鲁克公司)测定;使用冷场扫描电镜(JSM-6701F,日本JEOL公司)、X射线能量色散谱仪(X-Max Extreme,英国牛津公司)和场发透射电子显微镜(TECNAIG2,美国FEI公司)观察吸附前后S-HA的表面形貌和微观结构的变化.
1.3 S-HA对Cd2+的吸附试验
1.3.1吸附动力学试验
取2组各12个50 mL的具塞锥形瓶,加入0.1 g S-HA,再依次加入20 mL质量浓度分别为50和100 mg/L的Cd2+溶液,该试验所用Cd2+溶液均用0.01 mol/L NaNO3作支持电解质,并用0.1 mol/L HNO3和0.1 mol/L NaOH调节溶液pH为5.0,在25 ℃恒温振荡器中以180 r/min的速率振荡一定时间(0.3~24 h),振荡结束后将溶液过0.45 μm滤膜,滤液中ρ(Cd2+)采用原子吸收分光光度计(220FS,美国瓦里安公司)测定.
1.3.2等温吸附试验
取10个50 mL的具塞锥形瓶,加入0.1 g S-HA,再依次加入20 mL质量浓度分别为10、20、30、40、50、100、150、200、250、300 mg/L的Cd2+溶液,在25 ℃恒温振荡器中以180 r/min的速率振荡24 h,振荡结束后将溶液过0.45 μm滤膜,滤液中ρ(Cd2+)采用原子吸收分光光度计测定,在35、45 ℃下用同样方法进行等温吸附试验.
1.3.3pH对吸附的影响
取2组各9个50 mL的具塞锥形瓶,加入0.1 g S-HA,再依次加入20 mL质量浓度分别为50和100 mg/L的Cd2+溶液. 用0.1 mol/L HNO3和0.1 mol/L NaOH调节溶液pH为2.0~6.0,在25 ℃恒温振荡器中以180 r/min的速率振荡24 h,振荡结束后将溶液过0.45 μm滤膜,测定滤液中ρ(Cd2+).
1.3.4共存阳离子对吸附的影响
取3组各7个50 mL的具塞锥形瓶,每组加入0.1 g S-HA后,再依次加入20 mL浓度分别为0、0.01、0.03、0.05、0.08、0.1、0.2 mol/L的Na+、NH4+和Ca2+溶液.ρ(Cd2+)为100 mg/L,溶液在25 ℃恒温振荡器中以180 r/min的速率振荡24 h,振荡结束后将溶液过0.45 μm滤膜,测定滤液中ρ(Cd2+).
试验数据的处理、拟合及作图采用Origin 8.1软件,每个试验设置3个平行,结果取平均值.
2 结果与讨论
2.1 元素分析
元素组成分析可得到HA化学结构与官能团方面的信息,通过计算HA的H/C(原子比,下同)、O/C(原子比,下同)和C/N(原子比,下同),可得到HA的结构和性质差异[21],S-HA的元素组成见表1. O/C通常用来表示HA中含氧官能团的含量[22],该试验提取S-HA的O/C为0.37,略高于刘超超等[21]从西安四座污水处理厂剩余污泥中提取HA的O/C平均值(0.34). H/C可以用来判断HA的芳香度和脂肪度[23],H/C较大,则表明HA的芳香度高,H/C较小,则说明脂肪化程度高. 该试验提取S-HA的H/C为1.79,高于李会杰[24]从湖泊底泥中提取HA的H/C(1.36~1.69). Hargitai[25]认为,S-HA的C/N与其腐殖化程度有关,C/N越高,表明S-HA的腐殖化程度越低. 该试验提取S-HA的C/N为9.50,低于张静茹[26]从包头矿区土壤中提取HA的C/N(0.37). 与不同来源的HA相比,该试验提取的S-HA富含含氧官能团,芳香度和腐殖化程度高,有利于对重金属的吸附.
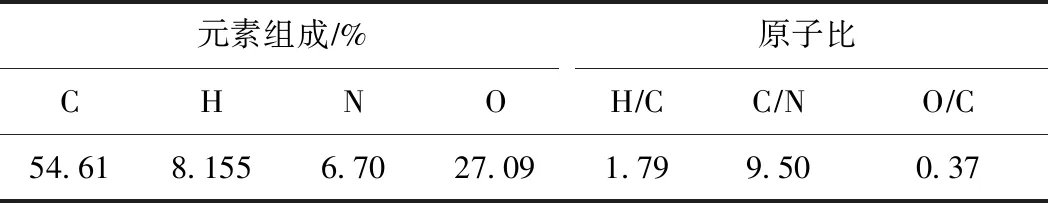
表1 S-HA的元素组成
2.2 溶液pH的影响
溶液的酸碱性是影响吸附的重要因素之一[27],会影响重金属离子在溶液中的存在状态,也会影响吸附剂的表面结构和官能团形态. 由于过高的溶液pH会使Cd2+产生水解沉淀,造成计算所得吸附量高于实际吸附量的结果[28],该试验主要考察溶液pH在2.0~6.0范围内对S-HA吸附Cd2+的影响. 由图1可见,溶液pH对S-HA吸附Cd2+的影响较大,随着溶液pH升高,S-HA对Cd2+的吸附量也逐渐增加.ρ(Cd2+)为50 mg/L时,溶液pH从2.0增至4.0,S-HA对Cd2+的吸附量增加较快;溶液pH超过4.0后,吸附量增加逐渐缓慢;溶液pH增至5.0,吸附量基本达到平衡.ρ(Cd2+)为100 mg/L时,溶液pH从2.0增至5.0,吸附量增加较快且在pH为5.0时吸附量基本达到平衡.

图1 溶液pH对S-HA吸附Cd2+的影响Fig.1 Effect of solution pH value for Cd2+ adsorption on S-HA
S-HA表面丰富的官能团(羧基、酚羟基等)能够给Cd2+提供吸附位点,当溶液pH较低(pH为2.0~3.0)时,溶液中H+浓度较高,占据S-HA表面官能团上的吸附位点;而且由于S-HA表面带正电荷,与Cd2+产生静电斥力,从而抑制了S-HA对Cd2+的吸附,使得在低pH时吸附在S-HA上的Cd2+较少. 随着溶液pH升高(pH为3.0~5.0),溶液中OH-浓度逐渐增大,与占据在S-HA表面官能团吸附位点上的H+结合,使吸附位点增多[29];同时,S-HA表面的负电荷增加,Cd2+与S-HA间的静电斥力减小,Cd2+更易与S-HA表面带负电荷的结合位点结合,从而使吸附量增大,且在pH达到5.0以后吸附量趋于平稳.
2.3 共存阳离子的影响
吸附体系中的阳离子会对重金属离子在吸附剂上的吸附造成影响. 在ρ(Cd2+)为100 mg/L的溶液中分别加入浓度为0~0.2 mol/L的Na+、NH4+和Ca2+溶液,研究共存阳离子对S-HA吸附Cd2+的影响(见图2). 由图2可见,随着溶液中c(Na+)、c(NH4+)和c(Ca2+)的增大,S-HA对Cd2+的吸附量逐渐减小,说明溶液中共存阳离子的存在不利于S-HA对Cd2+的吸附. 这是由于共存阳离子会与Cd2+产生竞争吸附,争夺S-HA上的吸附位点,从而导致吸附量下降. 在同浓度共存阳离子条件下,Na+、NH4+和Ca2+对S-HA吸附Cd2+的影响依次为Ca2+>NH4+>Na+. 这是因为Ca2+和Cd2+同为二价金属离子,在S-HA吸附Cd2+的过程中,Ca2+和Cd2+发生强烈的竞争吸附[30]. 该研究表明,随着共存阳离子浓度增加,S-HA对Cd2+的吸附量减小,说明吸附过程中S-HA与Cd2+之间的静电引力发挥着重要的作用[31].

图2 共存阳离子对S-HA吸附Cd2+的影响Fig.2 Effect of co-existing cationsfor Cd2+ adsorption on S-HA
2.4 吸附动力学模型
为深入研究S-HA对Cd2+吸附过程的控速步骤和吸附机理,分别采用准一级动力学模型〔见式(1)〕、准二级动力学模型〔见式(2)〕和颗粒内扩散模型〔见式(3)〕对S-HA吸附Cd2+的试验数据进行拟合,拟合曲线见图3,拟合参数见表2和表3.
(1)
(2)
qt=Kdit1/2+Fi(i=1,2)
(3)
式中:qe、qt分别为吸附平衡时和任意t时刻S-HA对Cd2+的吸附量,mg/g;k1为准一级动力学模型常数,h-1;k2为准二级动力学模型常数,g/(mg·h);Kdi为颗粒内扩散模型速率常数,mg/(g·h1/2);Fi为截距,mmol/g,其与边界层厚度有关,若Fi不为零,则边界层向颗粒表面的扩散过程不可以忽略,且Fi越大,边界层对吸附的影响也越大[32].
从图3(a)可以看出,吸附过程呈先快后慢趋势,吸附初始阶段,随着吸附时间增加,S-HA对Cd2+的吸附量增加且增幅较快,随后增幅逐渐减慢. 由表2可见,准二级动力学模型对S-HA吸附Cd2+过程的模拟优于准一级动力学模型.ρ(Cd2+)分别为50和100 mg/L时,准二级动力学模型对S-HA吸附Cd2+的动力学数据拟合的相关系数(R2)分别为 0.949 2 和 0.990 1,且通过准二级动力学模型拟合得到的理论吸附量(qm2)和试验所得数据基本一致,说明准二级动力学模型能很好地描述S-HA吸附Cd2+的过程. 准二级动力学模型假设吸附的主要机制是化学键的形成[33],说明S-HA对Cd2+的吸附是一个以化学吸附为主的过程,这种吸附主要是S-HA中丰富的官能团与Cd2+发生配合作用,从而在S-HA和Cd2+之间产生化学键力. 从颗粒内扩散模型拟合动力学曲线〔见图3(b)〕可以看出,S-HA对Cd2+的吸附过程分为2个阶段. 第1阶段为Cd2+通过液膜扩散到S-HA表面(液膜扩散阶段);第2阶段为Cd2+从S-HA表面向其内部孔隙扩散(颗粒内扩散阶段).
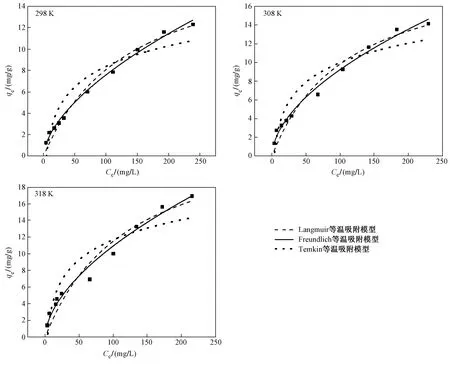
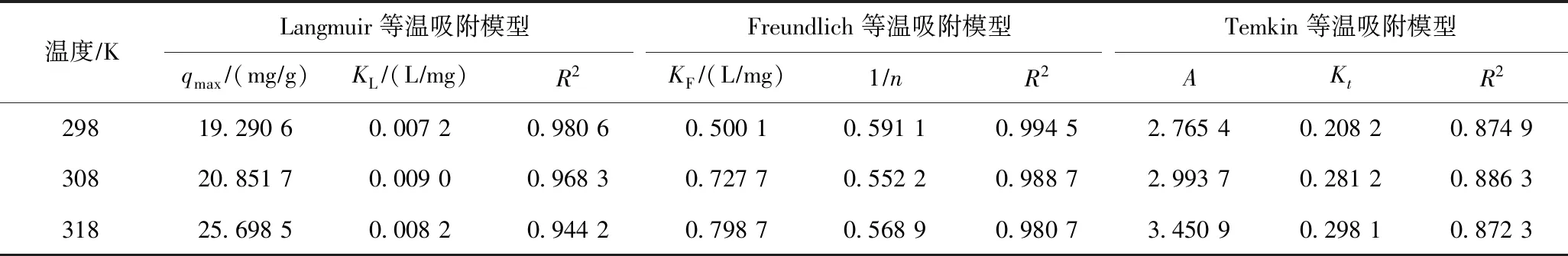
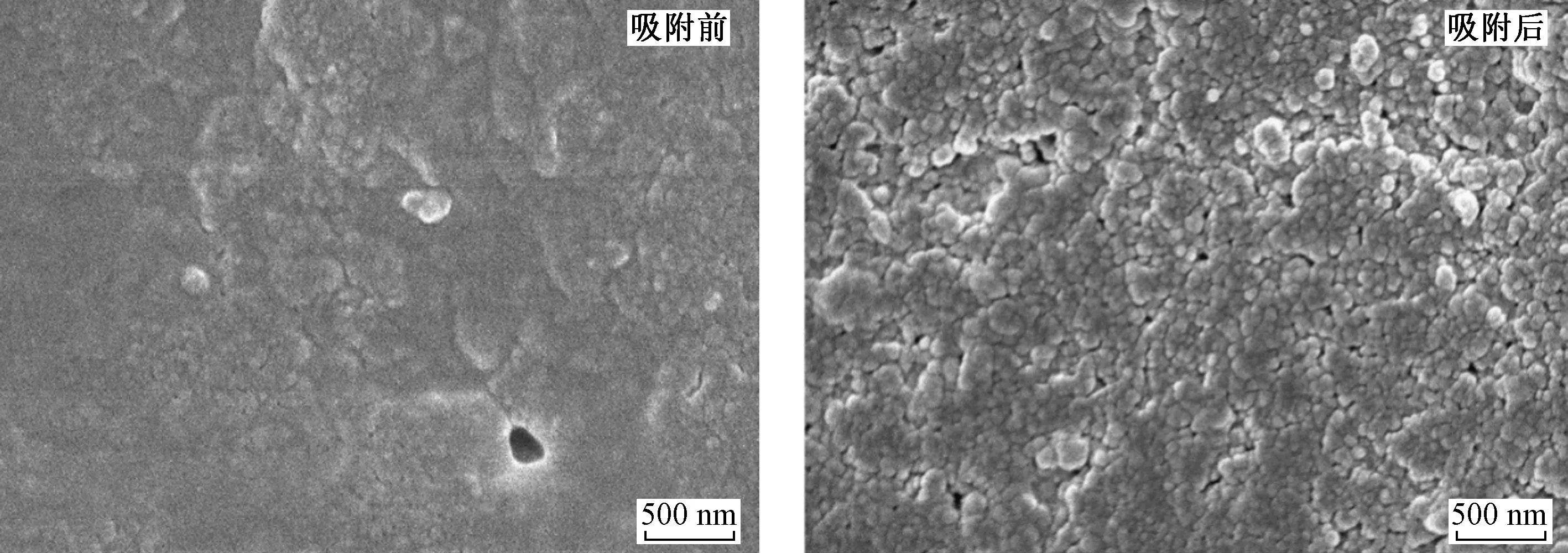
由表3可见,颗粒内扩散模型速率常数Kd2 图3 S-HA对Cd2+的吸附动力学模型拟合曲线和颗粒内扩散模型拟合曲线Fig.3 Adsorption kinetic model fitting curves and intra-particle diffusion model fitting curve of S-HA for Cd2+ 表2 S-HA吸附Cd2+的动力学拟合参数 注:qm1、qm2分别为准一级动力学模型和准二级动力学模型拟合得到的理论吸附量,mg/g. 表3 S-HA吸附Cd2+的颗粒内扩散动力学拟合参数 在一定温度下,吸附达到平衡时,吸附质的平衡浓度(Ce)与平衡吸附量(qe)的关系可以用等温吸附模型来表达. 分别用Langmuir等温吸附模型〔见式(4)〕、Freundlich等温吸附模型〔见式(5)〕和Temkin等温吸附模型〔见式(6)〕对等温吸附数据进行拟合,拟合曲线见图4,拟合参数见表4. (4) qe=KFCe1/n (5) qe=Aln(KtCe) (6) 式中:Ce为吸附平衡时ρ(Cd2+),mg/L;KL为Langmuir等温吸附模型吸附常数,L/mg;qmax为理论最大吸附量,mg/g;KF为Freundlich等温吸附模型吸附容量参数,L/mg;1/n为Freundlich等温吸附模型指数,反映了吸附的难易程度,当0.1<1/n<1时,吸附反应易于进行,当1/n>2时,吸附反应很难进行;A和Kt均为Temkin等温吸附模型参数. 比较3个等温吸附模型拟合的线性相关系数(R2)可以看出,Freundlich等温吸附模型的拟合效果比Langmuir等温吸附模型和Temkin等温吸附模型的拟合效果好,不同温度下的Freundlich等温吸附模型的R2均大于0.980 0,说明Freundlich等温吸附模型能够很好地描述Cd2+在S-HA上的吸附情况,S-HA 对Cd2+为多层吸附. Freundlich等温吸附模型常数1/n值介于 0.552 2~0.591 1 之间,表明吸附反应易于进行. 298 K时,S-HA对Cd2+的最大吸附量为19.29 mg/g,远高于风化煤基腐殖酸[16]对Cd2+的吸附量. 图4 S-HA吸附Cd2+的等温吸附拟合曲线Fig.4 Isothermal adsorption fitting curves of S-HA for Cd2+ 表4 S-HA吸附Cd2+的等温吸附曲线拟合参数 随着温度的升高,S-HA对Cd2+的吸附量随之增大,这表明S-HA对Cd2+的吸附是吸热反应. 随着温度升高吸附量增大,可能原因是:①提升温度增强了Cd2+的活度和扩散速度,从而使更多的Cd2+能够到达S-HA表面和内部结构; ②温度的升高使S-HA结构发生变化,使S-HA表面产生了更多的吸附点位[36]. 不同温度下S-HA对Cd2+的吸附等温模型如图5所示. 从图5可以看出,S-HA对Cd2+的吸附量随着温度的升高而增大,这说明S-HA对Cd2+的吸附是一个吸热过程. 根据Gibbs方程、Vant′Hoff方程、Gibbs-Helmhotz 方程,由表观平衡常数可求出热力学参数,吸附热力学模型计算公式: ΔG0=-RTlnMd (7) ΔG0=ΔH0-TΔS0 (8) (9) 式中:R为气体常数,8.314 J/(mol·K);T为热力学温度,K;ΔG0为Gibbs自由能,kJ/mol;ΔH0为吸附过程的焓变,kJ/mol;ΔS0为吸附过程的熵变,J/(mol·K);Md为分配系数,其有多种计算方法,通常用吸附分配系数代替,即 Md=qe/Ce (10) 图5 不同温度下S-HA对Cd2+的吸附等温线Fig.5 Adsorption isotherms of S-HA on Cd2+ at different temperatures 图6 S-HA吸附Cd2+前后的SEM图Fig.6 SEM image of S-HA before and after Cd2+ adsorption 不同初始ρ(Cd2+)下,ΔG0<0、ΔH0>0,说明Cd2+在S-HA上的吸附是一个自发进行的吸热反应(见表5). 通常认为,如果是物理吸附过程,则ΔG0范围一般为-20~0 kJ/mol,ΔH0<40 kJ/mol;如果是化学吸附过程,则ΔG0范围为-80~-400 kJ/mol,ΔH0>60 kJ/mol[37]. 该试验ΔH0在8.880~37.915 kJ/mol之间,ΔG0在-16.663~-9.719 kJ/mol范围内,表明S-HA 对Cd2+的吸附主要是物理吸附. 物理吸附主要是吸附剂与吸附质之间范德华力或者氢键的作用,物理吸附的ΔG0和ΔH0较小. 准二级动力学模型假设吸附速率由吸附剂表面未被占有的吸附空位数目的平方值决定,吸附过程受化学吸附机理的控制. 物理吸附和化学吸附在一定条件下可以同时发生,并且在不同情况下,吸附性质也可以发生变化. 该试验通过热力学和动力学角度对吸附机理进行探讨,结果表明,S-HA对Cd2+的吸附过程同时存在着物理吸附和化学吸附. 表5 S-HA吸附Cd2+的热力学参数 2.7.1SEM-EDS(外观形态分析) 吸附前的S-HA表面呈松散的簇团状,孔道结构不发达(见图6). S-HA吸附Cd2+后外观形态明显发生变化,在S-HA表面形成颗粒状覆盖层. 通过EDS分析S-HA表面的元素组成,发现S-HA主要由C、N、O、S和P等元素构成,吸附前S-HA的EDS分析未发现Cd元素,吸附后EDS分析出现了Cd元素,其质量分数约为0.21%(见图7). 从S-HA吸附Cd2+前后的TEM分析(见图8)可以看出,吸附前S-HA呈片状结构,纹理清晰,吸附后S-HA上覆盖了一层黑色颗粒物,是Cd2+吸附在S-HA表面上所形成的. 图7 S-HA吸附Cd2+前后的EDS能谱图Fig.7 EDS spectra of S-HA before and after Cd2+ adsorption 图9 吸附前后S-HA的FT-IR图Fig.9 FT-IR spectra of S-HA before and after adsorption 2.7.2FT-IR(傅里叶红外光谱分析) 通过FT-IR分析,推断HA表面含有大量的羧基、醇羟基和酚羟基等含氧官能团、芳香族与脂肪族化合物,并具有高度芳香化的结构,这些表面官能团的存在为S-HA吸附Cd2+提供了基础. S-HA吸附Cd2+后其红外特征峰发生了明显的变化,3 295 cm-1附近的吸收峰显著的削弱、迁移,说明吸附过程中Cd2+与S-HA中的羟基发生了络合作用;2 352 cm-1附近的吸收峰消失,说明吸附过程中Cd2+与S-HA中的羧基发生反应;1 236 cm-1附近的吸收峰明显减弱,说明S-HA中的酚羟基和羧基参与了Cd2+的吸附反应;而 1 329~1 529 cm-1之间密集吸收峰的改变,说明HA中的芳香环也参与了吸附反应. 通过FT-IR表明,Cd2+与S-HA上的官能团发生表面络合作用,S-HA 和Cd2+之间产生化学键力,这也印证了吸附动力学的研究结论. a) S-HA主要由C、H、O、N等元素组成,表面呈松散簇团状,含有大量的羧基、酚羟基等含氧官能团,芳香度较高,含有较多的脂肪链结构. Cd2+与S-HA表面上的酚羟基、羧基等官能团发生了络合作用. b) 高pH对S-HA吸附Cd2+有促进作用,而高离子强度对S-HA吸附Cd2+有抑制作用. 共存阳离子的存在不利于S-HA对Cd2+的吸附,同浓度共存阳离子对S-HA吸附Cd2+的影响依次为Ca2+>NH4+>Na+. c) S-HA对Cd2+的吸附分别快吸附、慢吸附和吸附平衡3个阶段,吸附平衡时间为12 h;S-HA对Cd2+的吸附受溶液pH的影响较大,S-HA对Cd2+的吸附量随pH增加而增大;S-HA对Cd2+的吸附量随溶液中Cd2+初始浓度的增大而增大,随温度的升高而增大,S-HA对Cd2+的吸附过程为自发吸热反应. d) S-HA对Cd2+的吸附过程符合Freundlich等温吸附模型,298 K下最大吸附量为19.29 mg/g,要远大于风化煤制备的HA对Cd2+的吸附量;吸附动力学的拟合结果符合准二级动力学模型,吸附速率由液膜扩散和颗粒内扩散共同控制. 综合吸附动力学和吸附热力学的结果可知,S-HA对Cd2+的吸附过程同时存在着物理吸附和化学吸附.2.5 等温吸附模型



2.6 吸附热力学模型


2.7 吸附剂吸附前后的表征



3 结论

