模拟酸雨对毛竹入侵阔叶林缓冲区土壤细菌群落多样性的影响
王 楠,王传宽,潘小承,白尚斌
1.东北林业大学生态研究中心, 黑龙江 哈尔滨 150040 2.浙江农林大学, 浙江省森林生态系统碳循环与固碳减排重点实验室, 浙江 杭州 311300
随着氮氧化物、硫化物等污染物排放的急剧增加,酸雨对陆地生态系统的影响已成为全球性环境问题[1]. 浙江省位于我国华东沿海酸雨区的东南部,降水pH年均值为4.88,平均酸雨率为70%,酸雨污染较严重[2]. 酸雨沉降到地表,危害植物生长发育,导致土壤酸化,改变土壤生态环境[3-4],对土壤的理化性质和土壤微生物群落及功能产生深远而复杂的影响[5]. 土壤微生物是生态系统中最活跃的生态因子之一,其通过分解土壤有机质、驱动土壤物质循环,在有机质和无机质转化中起着重要作用[6]. 在森林生态系统中,由于微生物结构相对简单,容易受环境条件的影响而发生变异,并能产生快速而灵敏的应答反应[7]. 张琼等[8]研究发现,不同强度的酸雨对土壤微生物的影响效应不同,其影响机理较为复杂. 因此,土壤微生物群落结构对酸雨的响应机理研究显得尤为必要.
常绿阔叶林作为亚热带独特的地带性植被类型,物种组成丰富,是全球亚热带生物多样性保护中心[9],在全世界生态系统碳、氮循环过程中扮演着重要的角色[10]. 此外,茂密的树冠和巨大的根系在气候调节、涵养水源、水土保持等方面也发挥着重要的生态效能[11],在亚热带地区生态环境平衡的维持中具有不可替代的作用.
常绿阔叶林和毛竹林是浙江省天目山国家级自然保护区典型的植被类型,毛竹(Phyllostachysedulis)为禾本科刚竹属,属于典型的无性系繁殖[12],不仅具有很强的水平扩展能力,而且生长迅速,常绿阔叶林在遭受持续干扰后,很容易被周边毛竹严重入侵,对亚热带常绿阔叶林生态系统稳定性造成潜在的威胁[13]. 因此,该研究以浙江省杭州市临安天目山国家级自然保护区特殊森林类型毛竹入侵常绿阔叶林形成的竹阔混交林为对象,利用新一代高通量基因测序技术,通过分析酸雨胁迫对土壤细菌的种类以及它们之间的相对丰度和进化关系的影响,探讨酸雨胁迫下竹阔混交林土壤细菌多样性与环境因子之间的内在联系,这对我国酸雨背景下常绿阔叶林生态系统微生物群落及功能的研究具有重要的现实及生态意义,可为进一步研究毛竹入侵和酸雨的双重影响奠定理论基础.
1 材料与方法
1.1 研究地区概况
试验区域位于浙江省天目山国家级自然保护区(30°18′30″N~30°21′37″N、119°24′11″E~119°27′11″E),总面积为 4 300 hm2,属于中型野生植物类型自然保护区. 海拔一般在300~500 m之间,中亚热带向北亚热带过渡型气候,该区年均气温8.9~15.8 ℃,最冷月气温2.6~3.4 ℃,极端最低气温-20.2 ℃,最热月气温19.9~28.1 ℃,极端最高气温38.2 ℃. 多年平均降雨量为 1 400 mm,多年平均无霜期为209~235 d. 土壤类型为亚热带红黄壤[14].
1.2 样地的设计及样品的采集
该试验于2017年3月在浙江省杭州市临安天目山国家级自然保护区毛竹向阔叶林扩张区域布设3块试验样地,每个样地宽5 m、长25 m. 采用随机区组设计,在每块样地内各设置3个5 m×5 m的样方,样方间用0.5 cm厚、30 cm高的PVC板隔开,以防止样方之间进行水和营养物质的交换,共计9个模拟酸雨试验样方. 在样方离地高度2 m处设置透明聚氯乙烯遮雨棚,以减少自然降雨对样地的影响. 根据杭州临安酸雨成分配置酸雨母液[15],再用母液与去离子水配成相应pH的模拟酸雨. 设置对照(CK)、T1(pH=4.0)、T2(pH=2.5)3个处理,其中对照为当地的天然湖水,pH为5.5. 根据临安市历年年均酸沉降量,计算得到每次每个样方每10 d喷淋酸雨量为10 L[16].
于2018年6月土壤微生物量较大时进行土壤采集. 分别在每个样方的四角与中心布设5个采样点,采集5~15 cm的土壤样品,挑出石块、凋落物和植物残体等杂物. 将采集的土壤样品分为两份装入无菌自封袋中,一份置于4 ℃电子恒温箱中,用于测定土壤理化性质;另一份过2 mm筛网,并储存于-80 ℃的冰箱中,用于提取土壤基因组DNA[17].
1.3 土壤理化性质分析
土壤pH用土水比1∶2.5浸提,电位法测定;土壤w(TN)、w(OC)采用元素分析仪测定;w(DOC)采用高纯度水浸提,取上清液过0.45 μm滤膜后使用元素分析仪测定;w(AN)采用碱解蒸馏法测定;w(MBC)采用氯仿熏蒸-K2SO4浸提法,通过公式w(MBC)=EC/0.45(EC为熏蒸和未熏蒸样品浸提液测定的有机碳含量差值)计算得出;w(MBN)采用氯仿熏蒸-K2SO4浸提法,通过公式w(MBN)=EN/0.54(EN为熏蒸和未熏蒸样品浸提液测定的有机氮含量差值)计算得出[18-19].
1.4 土壤细菌DNA提取与PCR扩增
按照E.Z.N.A.®Soil DNA试剂盒(Omega U.S. Omega Bio-tek,Norcross,GA,USA)说明书抽提基因组DNA,利用1%琼脂糖凝胶电泳检测DNA提取质量.
引物设计:用338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)引物对V3~V4可变区进行PCR扩增[20]. PCR试验扩增体系为20 μL:4 μL 5×FastPfu Buffer,2 μL 2.5 mmol/L dNTPs,0.8 μL 5 μmol/L正向引物,0.8 μL 5 μmol/L反向引物,0.4 μL FastPfu Polymerase,10 ng 模板 DNA. PCR仪:ABI GeneAmp® 9700型(ABI,USA). PCR反应参数:①95 ℃持续3 min;②95 ℃持续30 s,55 ℃持续30 s,72 ℃持续45 s,27个循环;③72 ℃持续10 min,10 ℃持续到仪器停止运行. 用2%琼脂糖凝胶电泳检测PCR产物,使用AxyPrep DNA凝胶回收试剂盒切胶回收PCR产物[21],Tris_HCl洗脱,2%琼脂糖电泳检测,利用QuantiFluorTM-ST(Promega, USA)进行检测定量,采用Illumina公司的TruSeq Nano DNA LT Library Prep Kit制备测序文库,利用上海美吉生物公司Illumina Miseq平台进行高通量测序.
1.5 数据处理
基于Illumina PE300测序,首先将获得细菌的FASTQ原始序列文件,使用QIIME(version 1.9.1,http://qiime.org)进行序列拆分和质量控制. 利用FLASH(version 1.2.11,http://ccb.jhu.edu)软件对质控序列进行双端拼接,并去除序列长度小于200 bp、平均质量得分小于20 bp的序列信息. 过滤read尾部质量值在20 bp以下的碱基,设置50 bp的窗口,如果窗口内的平均质量值低于20 bp,从窗口开始截去后端碱基,过滤质控后质量在50 bp以下的序列;根据两端序列之间的overlap关系,将成对序列拼接(merge)成一条序列,overlap长度需大于10 bp;拼接序列的overlap区允许的最大错配比率为0.2,筛选不符合序列;根据序列首尾两端的barcode和引物区分样品,并调整序列方向.
全部分析在运算分类单位OTU(operational taxonomic unit)的相似水平为97%条件下进行. 使用USEARCH软件(version 7.0,http://diver 5.com)对所有序列进行OTU划分及生物信息统计;以最小的序列数为标准进行样品序列数取整抽平,用MOTHUR(version 1.30.2,http://mothur.org)软件计算不同随机抽样下的α多样性指数,包括Ace指数、Chao1指数、Shannon-Wiener指数、Simpson指数和Coverage指数,各指数的计算方法见文献[22]. 使用SPSS软件(IBM SPSS Statistics 22 for WINDOWS)进行土壤理化性质的显著性检验,不同处理下的平均值在5%的显著性水平下做LSD(Least significant difference)多重比较. 利用R语言Venn Diagram包绘制文氏图;基于Bray-Curtis距离的主坐标分析(PCoA)使用 R2.15.3 软件的vegan包进行,使用vegan包中的“ANOSIM”和“ADONIS”函数进行细菌群落结构相似性检验. 利用Canoco 4.5软件对细菌群落结构与土壤理化因子进行冗余分析(RDA). 用Pearson相关分析检验土壤细菌群落α多样性与理化性质之间的相关性,细菌相对丰度和土壤理化性质间的相关性采用Spearman进行,利用Python 2.7软件对细菌属水平作LEfSe(LDA Effect Size=4.0)分析.
2 结果与分析
2.1 土壤理化性质
通过表1比较发现,T1处理下土壤平均pH比CK处理低13.77%,T2处理下土壤pH比CK处理低31.36%;T1处理下土壤w(TN)、C/N、w(OC)、w(DOC)、w(AN)、w(MBC)和w(MBN)分别是CK处理的1.38、1.01、1.40、0.81、1.21、0.96和0.84倍,T2处理下土壤w(TN)、C/N、w(OC)、w(DOC)、w(AN)、w(MBC)和w(MBN)分别是CK处理下的1.68、1.03、1.73、0.50、1.40、0.90和0.68倍. 由此可见,酸雨胁迫对毛竹阔叶混交林土壤理化性质和微生物量具有显著影响(P<0.05).
2.2 高通量测序数据分析
经过Miseq高通量测序并优化后,3个不同处理样地的9个土壤样品共获得455 392条修剪序列数,平均碱基长度为412.25 bp,其中碱基长度为401~440 bp的序列数占总序列数的99.81%(见表2).
通过Venn图可以直观比较3种处理下土壤样品OTU组成的相似性和重叠情况. 由图1可见,在97%的相似水平上进行统计发现,土壤OTU数量随着酸雨强度的增加而逐渐降低. 全部样地的土壤细菌OTU分布数目为 4 284 个,其中共有的OTU分布数目为 1 018 个,约占总数的23.76%. T2处理下土壤独有的土壤细菌OTU分布数目最少,约占总数的4.76%;CK处理下土壤独有的土壤细菌OTU分布数目最多,约占总数的40.50%;T1处理下独有的土壤细菌OTU分布数目为241个,约占总数的5.63%. T1处理与CK处理下土壤共有的土壤细菌OTU分布数目约占二者总数的32.92%;T1处理与T2处理下土壤共有的土壤细菌OTU分布数目约占二者总数的64.65%;T2处理与CK处理下土壤共有OTU分布数目约占总数的28.42%. 由此可以看出,T2处理与CK处理下土壤细菌的OTU分布差异最显著.

表1 不同酸雨处理下土壤理化性质和微生物量
注:同列不同小写字母表示不同处理间差异显著(P<0.05). 表中数据为平均值±标准差. 下同.

表2 测序数据统计
2.3 土壤细菌群落多样性分析
2.3.1α多样性分析
如表3所示,在97%分类水平下,不同酸雨处理下竹阔混交林之间的Ace指数和Chao1指数差异显著(P<0.05). Ace指数和Chao1指数反映群落丰富度,CK处理下Ace指数和Chao1指数最大,说明CK处理下菌群丰富度最高. 不同酸雨处理下Simpson指数和Shannon-Wiener指数虽然存在差异,但未达到显著水平. Simpson指数和Shannon-Wiener指数反映群落多样性,CK处理下Simpson指数最大,Shannon-Wiener指数最小,说明CK处理下细菌多样性最大. 各处理土壤样品测序的覆盖度最低为0.990,因此该测序结果能够真实反映供试土壤样品微生物的实际情况.

图1 不同酸雨处理下土壤细菌基因测序获取的基因库中独有和共有OTUs分布的Venn图Fig.1 Venn diagram showing the numbers of shared and exclusive OTUs of soil bacteria identified under the different acid rain treatments
2.3.2β多样性分析
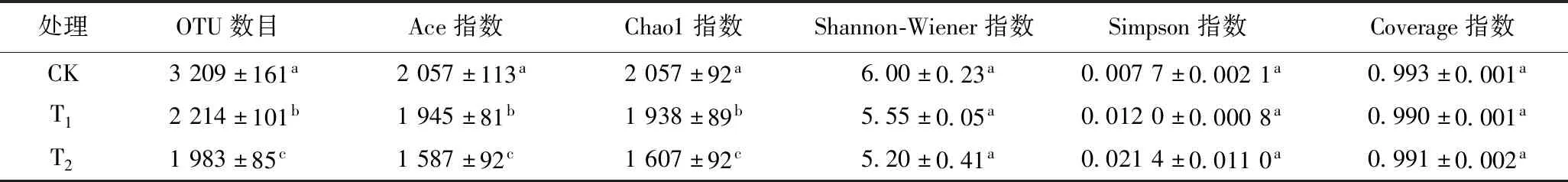
表3 不同酸雨处理下土壤细菌α多样性指数
基于Bray-Curtis距离进行主坐标(PCoA)分析(见图2)发现,主坐标的前两轴共解释了69.04%的总方差,其中第一轴(PC1)和第二轴(PC2)分别解释45.27%和23.77%的总方差. CK处理下土壤细菌OTU聚集在右侧,而T1和T2处理下土壤细菌OTU聚集在左侧. 分别采用ANOSIM和ADONIS方法对CK处理与T1、T2处理下细菌群落进行相似性检验,结果发现细菌群落结构在施用酸雨后发生了显著变化(P<0.05).

图3 不同酸雨处理下土壤细菌门水平群落组成Fig.3 Soil bacteria community composition of phylum level under the different acid rain treatments
2.4 土壤细菌群落结构组成及属水平差异分析
在相似水平为97%的条件下,对OTU的代表序列作分类学分析(见图3). 结果表明,9个土壤样品共检测出 4 284 个OTUs分布,分属于34个菌门. 其中,变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)和放线菌门(Actinobacteria)为3种处理共有的优势菌门(相对丰度>1%). 变形菌门(Proteobacteria)和放线菌门(Actinobacteria)的相对丰度在CK处理下最高,酸杆菌门(Acidobacteria)和绿弯菌门(Chloroflexi)的相对丰度在T2处理下最高.
对于LEFSe分析,首先使用非参数因子检测具有显著丰度差异特征,然后找到与丰度有显著性差异的类群,最后采用线性判别分析(LDA)来估算每个组分(物种)丰度对差异效果影响的大小. 采用all-against-all 多组比较策略,在细菌属水平上取相对丰度最大的前50个属进行LEfSe分析,LDA分值>4.0的物种见图4. 在CK处理土壤中微球菌科、节杆菌属的相对丰度变化显著,为主要差异指示种;在T1处理中Elsterales目、Elsterales科和Elsterales属的相对丰度变化显著,为主要差异指示种.

注:相对丰度没有显著变化的为黄色,圆圈直径的大小表示物种相对丰度的大小. 图4 不同酸雨处理下土壤细菌属水平LEfSe分析(LDA阈值为4.0)Fig.4 LEfSe analysis of genus level of soil bacteria under the different acid rain treatments (LAD score is 4.0)
2.5土壤理化性质对细菌群落和多样性的影响
采用Pearson法分析不同酸雨处理下竹阔混交林土壤理化性质与细菌α多样性指数的相关性(见表4),结果显示,Ace指数、Chao1指数均与pH呈极显著正相关(P<0.01),与w(TN)呈极显著负相关(P<0.01),与w(OC)、w(AN)均呈显著负相关(P<0.05);Simpson指数与w(TN)呈显著正相关(P<0.05),与w(MBC)呈显著负相关(P<0.05).
冗余分析结果表明,4个排序轴的特征值分别为0.469、0.375、0.066、0.042(见图5和表5),其中第一轴是约束性排序轴,第一、第二排序轴共解释了84.5%的胁迫变化,4个排序抽的特征值占总特征值的95.1%,4个排序轴共解释了95.1%的胁迫变化和土壤因子关系. 为了研究影响毛竹阔叶混交林细菌群落结构的主导因素,对8个土壤理化因子的边际作用进行检验(见表6). 结果表明,土壤w(TN)(P=0.015,F=4.28)、w(AN)(P=0.014,F=4.96)和pH(P=0.046,F=3.77)对土壤细菌群落的构建均有显著影响.
Spearman分析反映了相对丰度位于前10位门水平上细菌与土壤理化因子的相关关系(见表7),
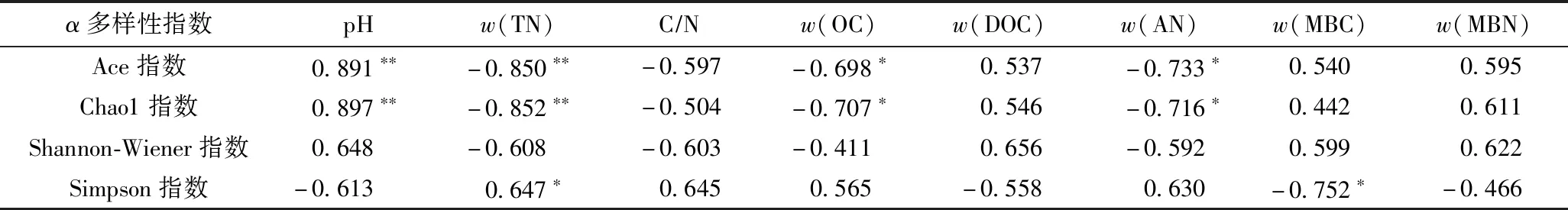
表4 土壤细菌α多样性指数与土壤理化性质、微生物量的相关系数
注:*表示P< 0.05; ** 表示P<0.01. 下同.
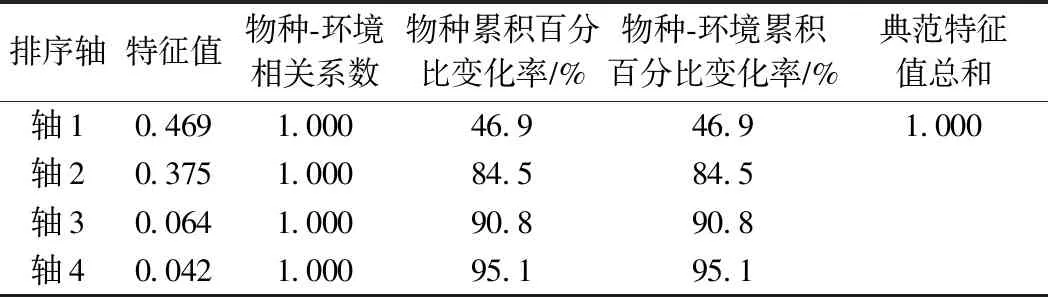
表5 冗余分析(RDA)结果

表6 土壤因子边际作用检验

表7 土壤细菌主要类群相对丰度与土壤理化性质的Spearman相关性
由表7可见,变形菌门(Proteobacteria)和放线菌门(Actinobacteria)的相对丰度均与pH呈显著正相关(P<0.05),与w(TN)呈显著负相关(P<0.05);酸杆菌门(Acidobacteria)和绿弯菌门(Chloroflexi)的相对丰度均与pH呈显著负相关(P<0.05),与w(TN)呈显著正相关(P<0.05).
3 讨论
3.1 不同酸雨处理下土壤细菌α和β多样性
土壤微生物群落是土壤生态功能的基础,在土壤生态系统中起着重要作用. 土壤微生物参与有机质分解、驱动养分循环、活化土壤中的营养元素,被看作是土壤有效养分的源和汇[23]. 但是,土壤微生物群落是易变的,环境条件的变化会引起土壤微生物群落发生改变. 土壤微生物多样性指数被认为是评价土壤生态功能的重要指标[24]. 该研究表明,随着酸雨处理强度的增加,土壤细菌群落α多样性指数发生变化,Ace指数和Chao1指数均显著下降(P<0.05),这与张萍华等[25]的研究结果相似,随着酸雨pH的下降,土壤中细菌数量均呈下降趋势. 孙岩等[26]研究发现,模拟酸雨处理会使玉米根际微生物的总量降低,群落的丰富度也降低. 由此证明,酸雨胁迫会抑制大多数细菌的生长和繁殖,酸雨强度增加会导致土壤细菌丰富度下降,改变土壤细菌群落的组成结构,许多土壤细菌种群因不适宜酸性环境而死亡[27]. Shannon-Wiener指数和Simpson指数受酸雨影响较小,表明土壤细菌的均匀度没有出现显著降低,这可能是由于一部分土壤细菌物种类消失后,土壤微生物对营养物质的竞争强度也随之下降,适应酸雨环境的土壤细菌群落因获得了更多的营养来源而不断发展,使得土壤细菌群落均匀度没有出现显著下降.
主坐标(PCoA)分析表明,酸雨处理组与对照组的土壤细菌群落在位置分布上存在显著差异,表明酸雨胁迫使得土壤细菌群落结构发生了显著变化. 这与王晓彤等[28]的研究结果一致,他们利用主成分分析比较模拟酸雨对土壤稻田细菌群落的影响,发现对照组与酸雨处理组的空间距离相距甚远,模拟酸雨处理显著改变了稻田土壤细菌群落结构. 可见,酸雨胁迫造成的土壤细菌群落结构变化主要是由于环境生态因子改变造成的.
3.2 不同酸雨处理下土壤细菌群落结构特征
土壤细菌群落结构的变化以群落组分改变为基础,不同酸雨处理下土壤细菌群落组分的不同,预示着环境改变为这些细菌提供了特异性的生存条件,从而对菌群进行选择[29]. XIA等[30]对我国115个不同森林类型土壤样品的研究发现,放线菌门和酸杆菌门的相对丰度较高. 高秀宏等[31]对大青山根际土壤细菌群落的研究表明,变形菌门、酸杆菌门和放线菌门为该地区的优势细菌门群落. 王怡等[32]通过对酸性农作物土壤细菌群落结构的研究发现,变形菌门、放线菌门和绿弯菌门的相对丰度约占土壤总细菌的70%. 贺婧等[33]研究表明,秦岭中段北坡不同海拔中变形菌门和酸杆菌门相对丰度最高. 这说明在森林生态系统中变形菌门、酸杆菌门、绿弯菌门和放线菌门生态位较宽,环境适应能力较强. 该研究结果也表明,竹阔混交林土壤中变形菌门、酸杆菌门、绿弯菌门和放线菌门的相对丰度在3个处理中均为最高,是该地区土壤优势细菌群落. 综上,不同类型土壤在门水平上有其自身的优势细菌类群,同时细菌类群也存在高度相似性,但不同类型土壤中细菌类群的相对丰度存在差异. 该研究中,与CK处理相比,模拟酸雨处理降低了变形菌门和放线菌门的相对丰度,提高了酸杆菌门和绿弯菌门的相对丰度.
在属水平上采用LEfSe方法分析不同酸雨处理下土壤细菌群落组成的差异指示种(见图4),能够在一定程度上反映出土壤的基本特征. 该研究中,在LDA分值>4.0的显著性差异水平上,节杆菌属和Elsterales属的相对丰度变化显著,说明不同酸雨处理下二者可作为土壤细菌群落组成的差异指示种. 节杆菌属是根际促生菌[34],可以促进植物生长及其对矿质营养的吸收. 该研究中,节杆菌属的相对丰度在CK处理下最高,模拟酸雨降低了节杆菌属的相对丰度,可能会抑制竹阔混交林根系的生长.
3.3 不同酸雨处理下土壤细菌与环境因子的关系
环境生态因子对土壤微生物群落结构存在显著影响[35]. Siles等[36]对不同pH的高山森林土壤微生物群落结构分析表明,土壤细菌群落结构组成与土壤pH密切相关. SHEN等[37]研究了长白山6种典型植被类型土壤细菌群落组成和多样性随海拔的分布规律,发现土壤pH是驱动土壤细菌分布的重要影响因子. 该研究发现,土壤细菌Ace指数(R=0.891)和Chao1指数(R=0.897)与土壤pH呈显著正相关(P<0.05),由此推测,土壤pH下降会抑制一部分细菌的生长. 尽管土壤氮含量增加,可以为土壤细菌提供更多的营养物质,但由于酸雨作用,土壤细菌丰富度并没有因为土壤氮含量的增加而提高,这说明酸雨是制约土壤细菌多样性的关键因素. 土壤细菌Simpson指数与土壤w(TN)、土壤w(MBC)密切相关,这可能是酸雨导致了土壤氮含量提高,抑制了土壤细菌多样性. 还有研究表明,酸杆菌门属于嗜酸性细菌门,在酸性土壤环境中有较高的丰度[38],这与该研究中酸杆菌门的相对丰度随pH降低而升高的研究结果一致. 冗余分析和相关性分析表明,酸杆菌门相对丰度与土壤pH呈极显著负相关(P<0.01)(见图6和表7),酸杆菌门在3个样地的相对丰度分别为16.16%、21.51%和23.5%,随着酸雨强度增大,酸杆菌门的相对丰度逐渐增加,酸性环境更有利于酸杆菌门细菌的生长繁殖,而变形菌门相对丰度逐渐下降,这可能与酸性条件下变形菌门处于竞争劣势有关[39]. 王霞等[40]研究认为,pH会影响绿弯菌门和放线菌门的分布,这与该研究中绿弯菌门和放线菌门的相对丰度随pH在不同酸雨处理变化结果一致.
同时,土壤w(TN)、w(AN)与土壤细菌群落结构及多样性密切相关. Sarathchandra等[41]研究表明,土壤中氮素含量变化会引起土壤微生物生物量、活性和群落组成的变化. SHEN等[42]在高寒苔原开展的小尺度海拔梯度研究发现,土壤氮是影响土壤细菌海拔梯度分布的关键环境因素. SHI等[43]研究发现,土壤氮的组分可能是影响北极苔原4种植被类型细菌结构的重要影响因子. Magill等[44]研究发现,如果增加森林土壤氮含量,酸杆菌门的多样性也会随之增加. 该研究发现,w(TN)、w(AN)均与变形菌门、酸杆菌门、绿弯菌门和放线菌门的相对丰度存在极显著(P<0.01)相关性,表明土壤w(TN)和w(AN)是影响土壤细菌群落结构的主要因子. 此外,碳底物活性也是影响细菌群落结构的重要因素,该研究发现,土壤w(OC)、w(AN)均与绿弯菌门、酸杆菌门的相对丰度呈显著正相关(P<0.05),这与已有研究结果[45]一致. 综上,土壤细菌的多样性和群落结构均受到土壤环境因子的显著影响,酸雨对毛竹阔叶混交林土壤环境因子的影响,导致土壤细菌群落多样性和结构发生改变,可能会阻碍阔叶林生长和更新,提高毛竹竞争优势,该结果为揭示毛竹入侵机制提供了新的理论依据.
4 结论
a) 与CK处理相比,模拟酸雨显著降低了竹阔混交林土壤细菌群落的OTUs数量、Chao1指数和Ace指数,Simpson指数和Shannon-Wiener指数虽然存在差异,但差异不显著.
b) 不同模拟酸雨处理下竹阔叶混交林土壤细菌的类群和相对丰度存在差别,测序共获得34门96纲247目401科698属,其中,变形菌门、酸杆菌门、绿弯菌门和放线菌门为3种处理共有的优势菌门(相对丰度均大于1%). 变形菌门和放线菌门的相对丰度在CK处理下最高,酸杆菌门和绿弯菌门的相对丰度在T2处理下最高. 节杆菌属和Elsterales属的相对丰度变化显著,可作为酸雨胁迫下土壤细菌群落结构变化的指示种.
c) 土壤细菌结构与土壤理化因子的冗余分析发现,变形菌门和放线菌门的相对丰度均与pH呈显著正相关,与w(TN)呈显著负相关;酸杆菌门和绿弯菌门的相对丰度均与pH呈显著负相关,与w(TN)呈显著正相关,w(TN)、pH是影响竹阔混交林土壤细菌多样性发生变化的重要因子.

