MFC处理人工湿地生物堵塞物及同步产电研究
林莉莉,鲁 汭,龙忆年,陈宇华,肖恩荣,吴振斌
1.武汉理工大学资源与环境工程学院,湖北 武汉 430070 2.中国科学院水生生物研究所,淡水生态和生物技术国家重点实验室,湖北 武汉 430072 3.中国科学院大学,北京 100049
EPS (extracellular polymeric substances,胞外聚合物)是在一定环境条件下由微生物分泌于体外、相互粘附的有机高分子聚合物[1],是微生物聚集体的主要成分. EPS过量积累是导致人工湿地(constructed wetland,CW)生物堵塞的重要因素,基质中的堵塞物质主要由厌氧分解产物〔如多糖类物质、聚脲类物质(EPS中蛋白质类成分)〕以及受低温及其他条件限制未能降解的有机化合物组成[2]. 相较于EPS的含量,EPS的成分和性质对生物堵塞的形成具有更大影响[3]. 研究[4-5]表明,多糖的大尺寸和凝胶化行为以及低生物降解率可能导致基质中多糖的更高积累潜力. TB-EPS (tightly bound EPS,紧密结合EPS)中含有较多的蛋白质,而LB-EPS (loosely bound EPS,松散结合EPS)中的多糖含量较高,因此,与TB-EPS相比,LB-EPS与生物堵塞的相关性更为显著[3,6]. 目前广泛研究的人工湿地生物堵塞防治技术主要包括停床轮休[7-8]、原位化学解堵(化学溶脱剂[9-10]和鼠李糖脂[11])、原位生物解堵(细菌[12]、蚯蚓[13]及酶处理[14])等.
MFC (microbial fuel cells,微生物燃料电池)是一种以微生物作为催化剂氧化有机和无机物质并同步产电的新型产能及废水净化技术[15],对进水要求不高,几乎所有有机物都可作为反应底物. MFC内的产电菌可将EPS中难降解的大分子量的有机物分解成简单的、可溶性的有机物加以利用并产生电能[16]. 大量研究[17-23]表明,MFC产生的微弱电场可以降低EPS含量并改变EPS中有机物的组成,有效控制膜污染. MFC形成的微弱电场对控制LB-EPS中多糖类小分子污染物具有明显优势[22]. 因此,针对人工湿地生物堵塞对湿地寿命和运行效率影响深远的问题,该试验构建了双室MFC系统用于处理EPS主要组分和人工湿地生物堵塞物,分析经MFC处理前后EPS主要组分的含量变化,探究MFC缓解人工湿地生物堵塞的潜力,以期为人工湿地生物堵塞防治提供借鉴.
1 材料与方法
1.1 双室MFC反应器的构建与启动

图1 MFC装置Fig.1 Schematic representation of the two-chambered MFC
试验采用双室MFC(见图1),阴、阳极室均为订制的玻璃瓶(有效容积为300 mL),呈“H”形状连接,之间通过Nafion117质子交换膜(proton exchange membrane,PEM)分隔. 采用石墨毡作为电极材料,阳极有效面积为80 cm2,阴极有效面积为32.5 cm2,石墨毡使用前经1 mol/L NaOH和1 mol/L HCl各处理2 h,并用蒸馏水清洗至pH为7以去除杂质. 阴、阳极之间通过钛丝构成回路,外接变阻箱(外阻,Rex)并通过数据采集系统(data acquisition system,DAS)实时监测电压数据并传输至电脑. 将装置放置在磁力搅拌器上,阴、阳极搅拌转速均为40~50 r/min,以使水样充分混合. 反应器放置在恒温室中,温度保持在(25±2)℃. 阴极室加入50 mmol/L K3[Fe(CN)6]缓冲溶液,当溶液颜色由黄色变为淡绿色时更换阴极液. 设置2个试验组,每组2个平行,分别命名为闭路组(closed circuit MFC,MFC-C)和开路组(open circuit MFC,MFC-O).
接种污泥取自武汉市某污水处理厂的二沉池. 向MFC阳极室加入曝氮气后〔ρ(DO)<1 mg/L〕的活性污泥和营养液的混合液(体积比为1∶2)以驯化产电菌,营养液的成分为CH3COONa、NH4Cl、NaCl、KH2PO4、Na2HPO4、CaCl2·6H2O、MgSO4·7H2O和微量元素[24](营养液用蒸馏水配置,正式试验时不含CH3COONa,以保证除底物外无其他外加碳源). 每隔1周更换阳极混合液,使产电菌在电极上富集,共接种4次,之后每3 d更换1次营养液,单个周期获得稳定电压输出即表示驯化完成. 整个驯化阶段持续约1.5个月.
1.2 试验设计
1.2.1EPS组分降解试验
分别向阳极投加不同浓度的PN (protein,蛋白质)和PS (polysaccharide,多糖)作为反应底物,研究底物类型、底物浓度和外阻(Rex)对MFC系统产电性能的影响及其对底物的利用效率. 每种底物下设置3个处理批次,相应的进水ρ(CODCr)条件见表1,每批次试验周期为1周,每个批次重复3次. PN用牛血清白蛋白(BSA)配制,PS用分析纯葡萄糖配制.

表1 EPS组分降解试验设计
1.2.2人工湿地堵塞物降解试验
依次向阳极投加0.500、1.000、1.667、3.333、6.667 g/L人工湿地堵塞物〔取自某高速公路服务区人工湿地,经烘干研磨过100目(0.15 mm)筛网后使用〕作为反应底物,根据预试验结果将Rex条件设为500 Ω,研究MFC的产电性能及对堵塞物的降解效果. EPS组分降解试验结果表明,在第3天电压开始大幅下降,因此每批次试验周期设置为3 d,试验重复3次. 人工湿地堵塞物以EPS和无机物质的总含量来表征,其中EPS采用“碱洗+热碱+低速离心”方法提取[25]. 试验所用堵塞物中无机物含量为36.50%,EPS组分含量:w(PN)为49.48 mg/g(73.26%),w(PS)为15.44 mg/g(22.86%),w(核酸)为2.62 mg/g(3.88%).
1.3 测定指标与方法
1.3.1产电性能
电压通过数据采集器(型号R6016/U/C3,上海继升电气有限公司)测定,每10 s记录一次并自动存入计算机中,分析数据时取10 min内的平均值,采集精度为0.001 V. 极化曲线和功率密度曲线使用稳态放电法[26]测定,依次调减Rex(从 9 000 Ω降至10 Ω)并记录相应的电压值,采用极化曲线斜率法计算Rint(系统内阻,等于极化曲线斜率和阳极有效面积的比值).
1.3.2EPS组分分析
ρ(PN)采用考马斯亮蓝法测定〔以牛血清白蛋白(BSA)作为标准物质〕[27];ρ(PS)采用葡萄糖氧化法(H2SO4-蒽酮法)测定[1];ρ(核酸)采用二苯胺法测定(以小牛胸腺DNA作为标准物质)[28].
1.3.3水质指标
ρ(CODCr)采用HJ/T 399—2007《水质 化学需氧量的测定 快速消解分光光度法》测定;ρ(TN)采用HJ 636—2012《水质 总氮的测定 碱性过硫酸钾消解紫外分光光度法》测定;ρ(NH4+-N)采用HJ 535—2009《水质 氨氮的测定 纳氏试剂分光光度法》测定;ρ(NO3--N)采用HJ/T 346—2007《水质 硝酸盐氮的测定 紫外分光光度法(试行)》测定. 溶解性有机物通过总有机碳(total organic carbon, TOC)来衡量,采用《TOC分析仪燃烧法》测定.
1.4 数据分析
每个试验组设置2个平行,每组试验重复3次,取数据的平均值进行分析. 所有数据使用Origin 9.0软件绘图,使用SPSS 22.0统计软件中的One-way Anova法进行单因素方差分析.
2 结果与讨论
2.1 EPS组分降解试验
2.1.1产电性能
分别以PN和PS为底物的MFC系统电压输出如图2所示,电压曲线均呈先迅速升高至峰值后稳定一段时间再快速下降的趋势. 在单批次试验临近结束时,电压输出接近于零,说明此时阳极室内的碳源被消耗殆尽,微生物活性下降,几乎不产生电能. 底物为PN时,3个处理批次的最大电压(Vmax)分别为600、635和302 mV,电压稳定时间(stable time,ST)分别持续约2.2、2.0和1.0 d;底物为PS时,相应的Vmax分别为584、590和306 mV,ST分别持续约0.7、1.8和1.2 d. 对比分析可发现,底物类型对系统电压输出有一定影响,底物为PN时MFC的Vmax略高于底物为PS条件下,前者的ST也较后者的略长. 此外,底物为PN时,输出电压受到底物浓度的影响,当底物浓度增加1.5倍(由200 mg/L增至500 mg/L)时,Vmax增加5.8%;而底物为PS时,其浓度对Vmax影响不大. 当保持底物类型和底物浓度不变、Rex增加9倍(由100 Ω增至 1 000 Ω)时,Vmax分别增加110.26%(PN)和92.81%(PS). 同时,ST受Rex的影响,Rex减小时,电路电流增大,ST缩短,底物降解速率加快.

图2 以PN和PS为底物的MFC-C系统输出电压Fig.2 Voltage output of MFC-C system with substrates of PN and PS
以PN和PS为底物的MFC系统极化曲线和功率密度曲线如图3所示. 由图3可见,底物为PN时,3个处理批次的开路电压(OCV)分别为577、767和551 mV,最大功率密度(Pmax)分别为55.88、161.10和77.01 mW/m2,系统内阻(Rint)分别为212.5、112.5和125.0 Ω;底物为PS时,相应的OCV分别为671、660和674 mV,Pmax分别为50.06、112.24、104.40 mW/m2,Rint分别为262.5、125.0和137.5 Ω. 对比分析可知,底物类型对OCV、Pmax和Rint均有一定影响. 底物为PN时,OCV随着底物浓度和Rex的增大而增加,底物浓度增加1.5倍时,OCV增加32.93%;Rex增加9倍时,OCV增加39.20%. 底物为PS时,3个处理批次的OCV并无明显差异.Pmax随底物浓度和Rex的增大而增加,底物浓度增加1.5倍时,Pmax分别增加188.30%(PN)和124.21%(PS);Rex增加9倍时,Pmax分别增加109.19%(PN)和7.51%(PS). 底物为PN时,Pmax随着底物浓度的增大而增加,这与Heilamnn等[29]的研究结论“一定底物浓度范围内,MFC的Pmax与底物浓度成正比”相一致,但Pmax低于单室BSA-MFC的Pmax〔(354±10)mW/m2〕,可能是由于质子交换膜的存在增大了系统内阻.Rint不受Rex影响,但与底物浓度有关,该研究中,底物浓度增加1.5倍时,Rint分别减小47.06%(PN)和52.38%(PS),这与郭昌梓等[30]的研究结果“MFC的Rint随底物浓度的增大而减小”相一致.
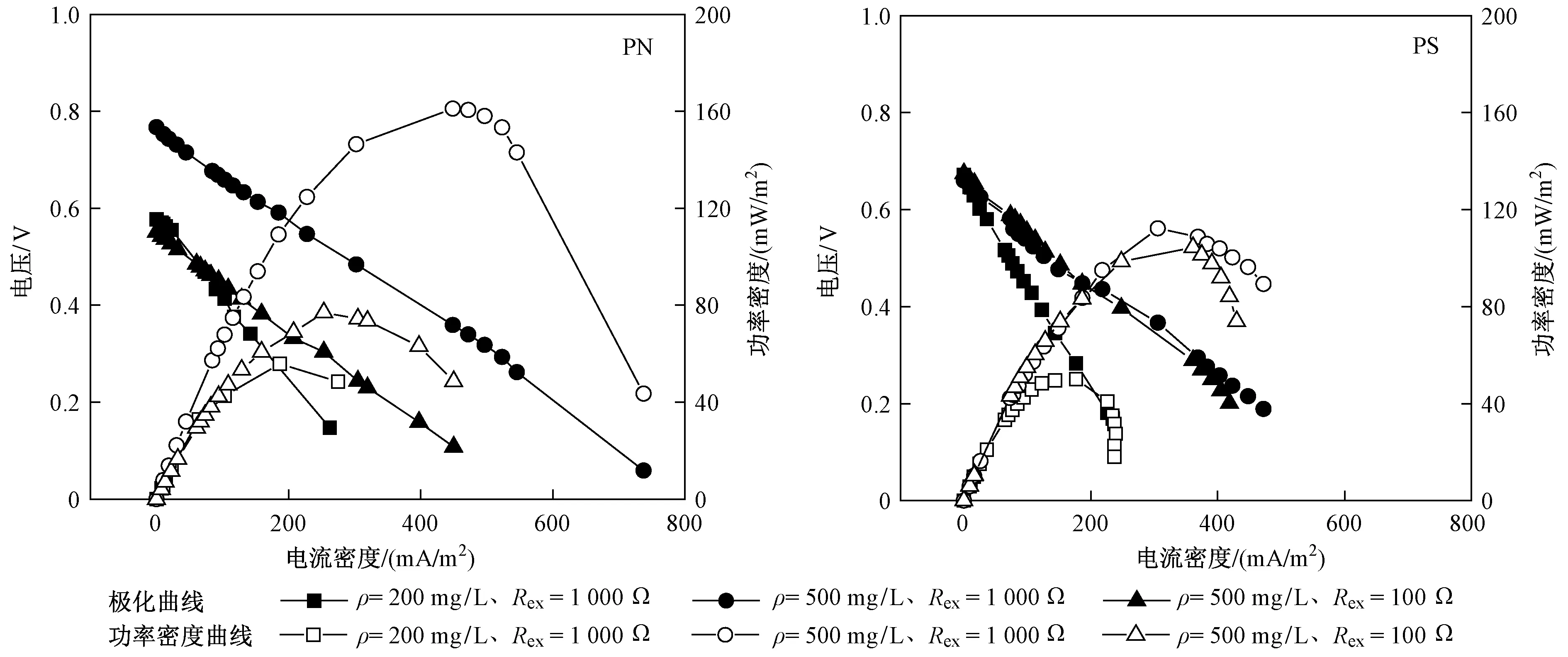
图3 以PN和PS为底物的MFC-C系统极化曲线和功率密度曲线Fig.3 Polarization curves and power density curves of MFC-C system with substrates of PN and PS
该试验结果表明,MFC系统的产电性能受底物类型、底物浓度及Rex的影响较大. MFC阳极微生物对PS的利用速率较快,由于PN需要被分解为小分子含氮物质之后方可为微生物利用,因此以其为底物时MFC可在更长时间内稳定运行. EPS中的主要组分PN和PS均可作为MFC的底物并被有效利用,说明MFC可降解剩余污泥或人工湿地堵塞物等含EPS的物质并同步产能.
2.1.2EPS组分利用效果

图4 以PN和PS为底物的MFC-C和MFC-O系统出水ρ(PS)Fig.4 The PS in the effluent of MFC-C and MFC-O systems with substrates of PN and PS
不论底物为PN还是PS,所有批次的出水中均检测不到PN,PN去除率均达100%,微生物分泌的PN极少. 但以PN为底物时,出水中可检测到PS,应为微生物所分泌. 各批次出水中的ρ(PS)如图4所示. 由图4可以看出,当底物为PN时,各处理批次MFC-C出水ρ(PS)均小于MFC-O,进行显著性分析发现,PN-1和PN-2处理批次MFC-C和MFC-O的出水ρ(PS)之间均不存在显著性差异(P>0.05),PN-3处理批次MFC-C和MFC-O的出水ρ(PS)之间存在显著性差异(P<0.05). 当底物浓度增加1.5倍时,ρ(PS)分别增加107.85%(MFC-C)和78.55%(MFC-O);Rex增加9倍时,ρ(PS)分别增加415.85%(MFC-C)和294.29%(MFC-O). 当底物为PS时,PS去除率均在95%以上,但MFC-C和MFC-O之间不存在显著性差异(P>0.05). 系统对PS的去除率随底物浓度的增大而提高,但几乎不受Rex的影响.
单个试验周期内,PN和PS几乎可以全部被微生物利用,这与单组试验临近结束时系统电压输出为零的试验结果一致. 阳极微生物对PN的利用率高于PS,这可能是由于PS的大尺寸和凝胶化行为导致其更难被生物降解[4-5]. EPS产量随食微比(F/M)的增大而增加[31],底物浓度增大时,出水ρ(PS)增加.Rex较大时,大部分电子消耗在电路的输送过程中,微生物基于自身保护机制,在不利环境条件下倾向于分泌更多的EPS[32],因此出水ρ(PS)随Rex的增大而增加. 底物类型对EPS分泌有一定影响,这与已有研究结果[33-35]一致. 同时,该结果也表明MFC形成的微弱电场在一定程度上可抑制PS的分泌.
2.1.3污水处理性能
测定各处理批次出水pH和电导率(SPC)如图5所示. 由于微生物利用阳极底物进行代谢活动过程中产生H+,因此两个试验组出水pH均低于进水. 各处理批次出水pH和SPC均表现为MFC-O>MFC-C,底物类型、底物浓度和Rex对出水pH和SPC的影响较小. 底物为PN时,各处理批次MFC-C和MFC-O的pH均存在极显著性差异(P均小于0.01),PN-1(P<0.05)和PN-3(P<0.01)的MFC-C和MFC-O的SPC均存在显著性差异. 底物为PS时,PS-3的MFC-C和MFC-O的pH存在极显著性差异(P<0.01),各处理批次MFC-C和MFC-O的SPC均存在极显著性差异(P均小于0.01).Rex减小时,MFC-C和MFC-O的出水pH差值和SPC差值均增大,可能是由于Rex减小导致电流增大,更有利于产电菌的生长繁殖,从而产生更多H+,迁移的电子数也越多. 开路条件下电流几乎为零,因此其出水的pH和SPC均高于MFC-C.

图5 以PN和PS为底物的MFC-C和MFC-O系统出水pH和SPCFig.5 pH and SPC in the effluent of MFC-C and MFC-O systems with substrates of PN and PS
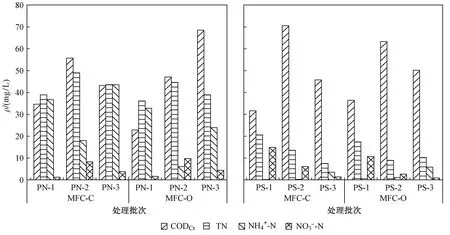
图6 以PN和PS为底物的MFC-C和MFC-O系统出水ρ(CODCr)、ρ(TN)、ρ(NH4+-N)和ρ(NO3--N)Fig.6 ρ(CODCr), ρ(TN), ρ(NH4+-N) and ρ(NO3--N) in the effluent of MFC-C and MFC-O systems with substrates of PN and PS
各处理批次出水ρ(CODCr)、ρ(TN)、ρ(NH4+-N)和ρ(NO3--N)如图6所示. 底物为PN时,各处理批次CODCr去除率均在85%以上;底物为PS时,各处理批次CODCr去除率均在80%以上,这与MFC对PN的利用率略高的结论一致. 底物为PN时,保持底物浓度不变,当Rex减小时,电流增大,阳极生物膜上产电菌的氧化能力增强,氧化阳极底物的能力也增强,对CODCr的去除率提高,这与Jang等[36]的研究结果“CODCr的去除率随Rex的增大而减小”相一致. 除PN-3的MFC-C和MFC-O出水中ρ(NH4+-N)存在显著性差异(P<0.05)外,其余各批次的出水指标之间均不存在显著性差异. 底物为PN时,各处理批次出水的ρ(TN)和ρ(NH4+-N)均表现为MFC-C>MFC-O,ρ(NO3--N)则表现为MFC-C 研究[39]发现,在有机碳源存在的环境中,厌氧氨氧化与反硝化反应能同步进行,且表现出一定的相互促进作用. 阳极室为厌氧环境,硝化反应受到抑制,随着反应进行,阳极液中有机碳源减少,反硝化反应受抑制,脱氮效率下降. 但各试验组的TN和NH4+-N均可实现一定程度的去除,说明阳极室内有可能存在其他的脱氮途径,但是否为厌氧氨氧化途径有待进一步证实,如通过对阳极石墨毡做高通量测序测定是否存在厌氧氨氧化菌[40]. 2.2.1产电性能 EPS可作为微生物的碳源和能量来源,微生物可以利用其他微生物分泌的EPS进行代谢活动[41]. 底物为人工湿地堵塞物时MFC系统的输出电压如图7(a)所示. 由图7(a)可见,电压曲线呈先迅速升至峰值后稳定一段时间再下降的变化趋势,这与底物为PN或PS时的电压变化趋势一致. 除堵塞物投加量为0.5 g/L时Vmax(480 mV)较低外,随着投加量的增加,Vmax(约750 mV)变化均不大,但电压稳定的时间随投加量增加而略有延长,投加量为0.5 g/L时电压几乎没有稳定期,而投加量为6.667 g/L时在单个试验周期内电压几乎不下降. 营养物质充足时,微生物生长活性高,产电量增加,随着营养物质被耗尽,微生物生长延缓,产电量下降. 此外,温度、pH、ρ(DO)等生存因子也会影响微生物生长,即增长到一定量后便进入稳定期,且MFC反应器特性也会制约产电性能,因此产电量不会无限增大. 用蒸馏水配制阳极液,投加的堵塞物是微生物生长的唯一外部碳源. 在无其他外加碳源的条件下,EPS降解产生的小分子物质可以作为细胞生长的碳源和能量来源[42],进一步说明阳极产电菌可以降解CW堵塞物并同步产能. 堵塞物投加量为6.667 g/L时,MFC系统的OCV为0.677 V,Pmax为12.25 mW/m2,Rint为 1 112.5 Ω〔见图7(b)〕. 相较于底物为纯EPS组分,底物为堵塞物时MFC的Rint约为前者的5倍,Pmax约为前者的10%. 进一步说明底物类型会影响MFC产电性能,这是因为人工湿地堵塞物成分复杂,大部分为难降解有机物且被疏水性EPS成分所包裹,不易溶解疏散[11],难以被微生物直接利用,电子传递阻力大,Rint增大,MFC产电性能下降. 图7 以堵塞物为底物的MFC-C系统输出电压、极化曲线和功率密度曲线Fig.7 Voltage output, polarization curve and power density curve of MFC-C system with substrates of clogging matter 堵塞物投加量/(g/L):Ⅰ—0.500; Ⅱ—1.000; Ⅲ—1.667; Ⅳ—3.333; Ⅴ—6.667.图8 以堵塞物为底物的MFC系统进出水ρ(EPS)Fig.8 EPS in the influent and effluent of MFC-C and MFC-O systems with substrates of clogging matter 2.2.2堵塞物EPS组分分析 为分析MFC对堵塞物EPS组分的处理效果,测定了各试验组进出水EPS及TOC浓度. 由图8可见,除堵塞物投加量为0.5和1.0 g/L外,其他试验组出水EPS的含量均表现为MFC-O 图9 以堵塞物为底物的MFC系统进出水ρ(TOC)Fig.9 TOC in the influent and effluent of MFC-C and MFC-O systems with substrates of clogging matter 微生物分泌的EPS可分为可生物降解和不可生物降解两类. 研究[44]显示,从新鲜好氧颗粒污泥中提取的EPS中约50%的PS和30%的PN可被生物降解,50%以上的EPS不可被生物降解,而从放置一段时间的好氧颗粒污泥中提取的EPS几乎不能被生物降解,且PS的平均生物降解速率非常慢. 由于该试验中所用的堵塞物为采样后冷冻保存较长时间且经过烘干研磨等预处理过程的样品,所以对其降解利用率不高. 但若将MFC与CW耦合原位降解堵塞物,则可排除预处理等过程的影响,提高EPS降解利用率. 此外,由于EPS的主要成分为带负电荷的腐殖质、蛋白及多糖类物质,而MFC阳极作为原电池中的负极,形成的微弱电场可通过排斥作用促使负电荷微粒从堵塞物聚集体中反向扩散,加速其分散[17]. 同时,利用脂肪族组分、碳氢化合物和碳水化合物在MFC中更易被水解和生物降解[45],可通过MFC强化去除堵塞物中的芳香族蛋白质和可溶性微生物副产物. 电场的存在可强化微生物代谢的电子传递过程,从而促进新陈代谢,提高微生物活性,加快微生物降解EPS. a) MFC系统的产电性能受底物类型、底物浓度及Rex的影响较大,且以PN为底物时的影响更为明显:底物浓度增加1.5倍时,Vmax和Pmax分别增加5.8%和188.30%;Rex增加9倍时,Vmax和Pmax分别增加110.26%和109.19%. 当底物浓度和Rex在一定范围内时,MFC的产电性能与二者均呈正相关. b) 阳极微生物可完全利用PN,但同时会分泌PS,且分泌量随底物浓度和Rex的增大而增加;此外,MFC-C的出水ρ(PS)低于MFC-O,表明MFC形成的微弱电场在一定程度上抑制了PS的分泌. c) MFC的输出电压随着堵塞物投加量的增加而增加,Pmax为12.25 mW/m2. MFC在降解人工湿地生物堵塞物并同步实现电能回收方面具有较大应用潜力.2.2 人工湿地堵塞物降解试验



3 结论

