枸杞多糖对男性生殖系统的保护作用及其机制实验研究进展
颜 玲,边 璐,庞 萍,谢瑾峰,孙升云
(1.暨南大学 中医学院,广东 广州 510632;2.暨南大学附属第一医院,广东 广州 510632)
枸杞是一种茄科落叶灌木,作为传统中药材已有上千年的历史,深受古今学者的喜爱。在古代,魏晋·陶弘景就在《名医别录》一书中提到:“枸杞,补内伤,坚骨,强阴”;唐·孟冼在《食疗本草》一书中记载:“枸杞,补筋骨、益人、祛劳伤、益肾气。”另外,诸多现代研究发现,枸杞的活性成分包括枸杞多糖(Lycium barbarum polysaccharide,LBP)、类黄酮、类胡萝卜素、甜菜碱、脑苷脂、β-甾醇类等[1]。作为枸杞的主要活性成分,LBP具有保护生殖系统、修复神经、抗缺氧、调节免疫、延缓衰老、保护肝脏、抗辐射、抗疲劳、抗肿瘤等多种生理活性[1-3]。近年来,中医药领域越来越重视LBP的药用价值的研究,其中,LBP对男性生殖系统的保护作用是目前研究的热点[4]。
男性生殖系统的损伤可由多种原因引起,包括放疗、化疗药物的应用,不良生活方式、巨大的生活压力,诸如糖尿病[5]等内分泌疾病,环境暴露如镉、甲醛、已烯雌酚、壬基酚、邻苯二甲酸单(2-乙基)己酯(Mono(2-ethylhexyl)phthalate,MEHP)、邻苯二甲酸单丁酯(monobutyl phthalate,MBP)和全氟辛酸(Perfluorooctanoic acid,PFOA)等。目前,男性生殖系统损伤的病因和发病机制尚未阐明,西医的临床诊疗手段有限,疗效欠佳;中医药在该方面积累了丰富的经验,同时具有不可替代的优势。
本文就近年来应用LBP治疗雄性生殖系统的保护作用及机制进行综述,为更深入研究提供参考。
1 LBP对男性生殖系统保护作用的机制
1.1 抗氧化应激和清除自由基
LBP是一种具有天然活性的植物多糖[6],可以维持正常的细胞形态和结构,修复受损细胞的形态,还能抑制氧化损伤引起的细胞活力下降和凋亡,其机制主要表现为清除多余的脂质过氧化物,如乳酸脱氢酶(Lactic acid dehydrogenase,LDH)、丙二醛(Malondialdehyde,MDA),提高细胞内的超氧化物歧化酶(Superoxide dismutase,SOD)、谷胱甘肽(Glutathione,GSH)等抗氧化物酶水平。
某些疾病如糖尿病[5]、电离辐射[7-9],化疗药物如环磷酰胺[10-11]等的应用,环境暴露如PFOA[12]、镉[13]、甲醛[14]、壬基酚[15]、MEHP和MBP[16]、己烯雌酚(Diethylstilbestrol,DES)[17]等对男性生殖系统的毒性损害主要表现为破坏体内氧化和抗氧化的平衡(以SOD等抗氧化酶活性明显下降,脂质过氧化产物MDA 显著升高为主要特征),从而对睾丸组织造成损伤。LBP通过增加SOD活性、降低MDA含量,发挥抑制细胞死亡,拮抗放疗[9]、化疗药物等因素的毒害作用,从而减轻生精细胞的损伤[4,10,14,16]。
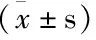

指标宋鹏琰[12]PFOA组80mg/kgLBP+PFOA组ZHAO等[18]模型组LBP+模型组(实验组A)MDA(nmol/mL)1.5±0.50.275±0.02517.62±1.7913.47±1.35SOD(U/mL)75.5±0.5101±150.64±12.9775.04±14.28GSH-PX(U/mL)20.25±0.2533.5±0.5133.22±17.18159.24±17.63
由表1可见,两项研究的LBP+模型组的SOD活性明显高于对应的模型组,而MDA含量均显著低于模型组;此外,宋鹏琰[12]和ZHAO等[18]研究结果证实LBP组GPX的活性高于模型组。
孙晶等[15]研究结果证实:模型组+LBP不同剂量组的SOD表达量均高于模型组,模型组+200 mg/kgLBP组的SOD表达接近于正常对照组;同时,模型组+LBP不同剂量组的MDA表达低于模型组,模型组+200 mg/kg LBP组的SOD表达接近于正常对照组,见图1。
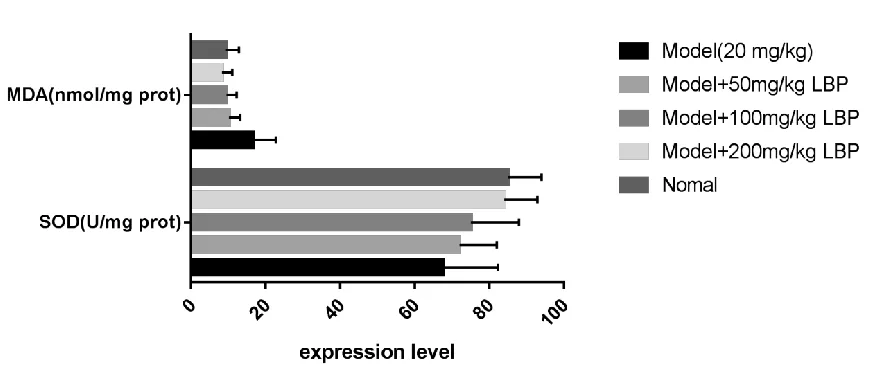
注:Model(20mg/kg),模型组(甲醛20mg/kg腹腔注射);Nomal,正常对照组(生理盐水灌胃)
图1 各组MDA、SOD的结果比较(Mean±SD)
赵亚兵等[7]研究结果显示,80mg/kg LBP+照射组的GSH-Px表达量高于照射组,同时80mg/kg LBP+照射组的GSH-Px表达量与正常对照组的GSH-Px表达量接近,见图2。
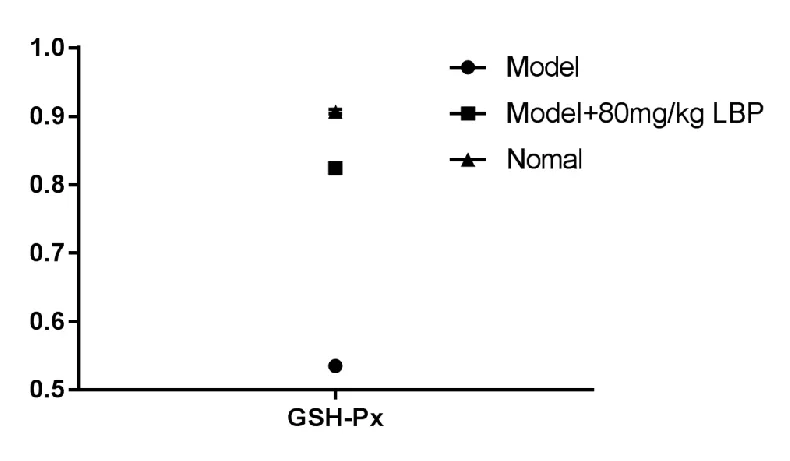
注:Model,照射组(60Co-γ射线照射);Nomal,正常对照组
综上所述,LBP可以通过提高抗氧化酶活性和清除自由基,恢复由PFOA、镉、MEHP和MBP、戊巴比妥钠和辐射对睾丸细胞造成的氧化应激损伤。
1.2 抑制生精细胞凋亡
LBP抑制细胞凋亡的机制可能是通过调节凋亡相关蛋白和基因水平来实现的。在性腺细胞凋亡过程中,促凋亡蛋白Bax主要起促进凋亡的作用,抗凋亡蛋白bcl-2具有抗氧化作用,其中LBP通过抑制促凋亡蛋白的产生来抑制细胞凋亡,维持细胞的稳定性[16]。同时,Bax/bcl-w比值是影响生精细胞凋亡及支持细胞凋亡的决定性因素[10]。
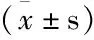

指标黄宗轩[19]Model10mg/kgLBP+ModelLUO等[20]Model10mg/kgLBP+ModelBax187.76±9.15116.04±7.3131.38±4.9719.56±3.54Bcl-2//28.75±3.0619.25±2.69Bcl-w176.15±9.48274.70±15.24//Bax/bcl-2/w1.07±0.020.42±0.010.920.98
黄宗轩[19]研究结果表明,LBP+模型组Bax和Bax/bcl-2/w表达水平较模型组下降,LBP+模型组的bcl-2/w的表达水平较模型组增加;LUO等[20]研究组的实验结果显示LBP+模型组Bax和Bcl-2阳性细胞数比例较模型组显著降低,而Bax/bcl-2较模型组变化不明显,详见表3。
上述结果表明,LBP通过调节bcl-2/w和Bax的表达,对由MEHP和MBP、环磷酰胺、电离照射等诱导的精子细胞凋亡具有保护作用。
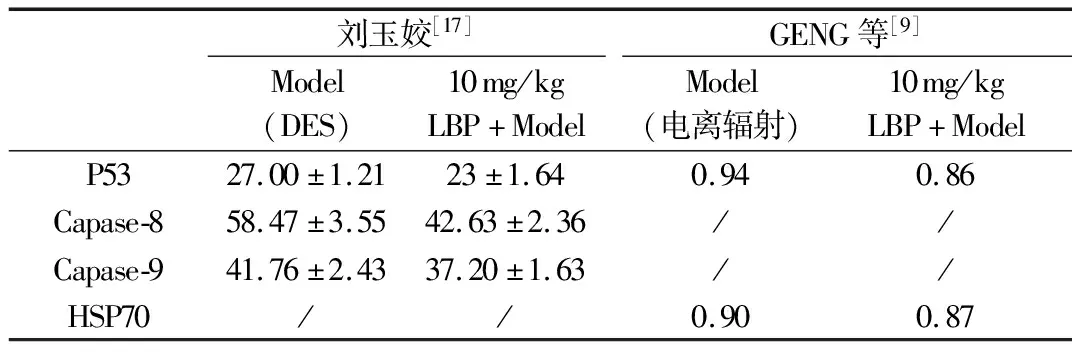
表3 P53,caspase-8,caspase-9,HSP70表达在各研究中的变化
P53基因可以触发细胞凋亡,Caspase-8是Fas/Fas L系统诱导死亡受体通路的下游产物,Caspase-9是bcl-2家族诱导细胞凋亡的下游产物[17]热休克蛋白(Hot shock protein,HSP)在多种有害因素的刺激下表达强烈[9]。
由表3可见,2项研究结果表明,10mg/kg LBP+模型组凋亡蛋白P53、capase-8、capase-9、HSP70的表达低于模型组。
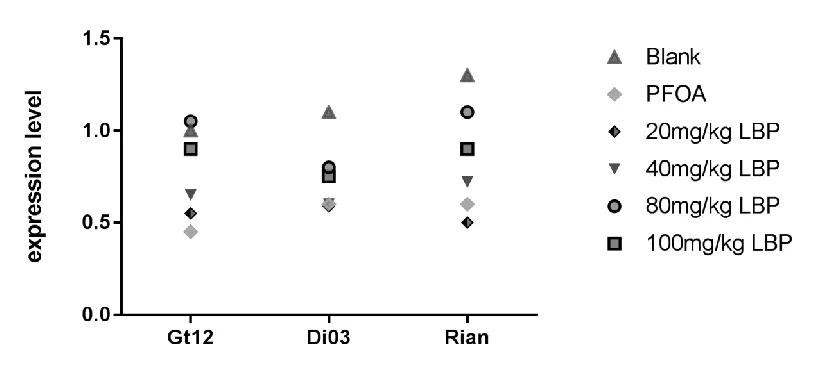
图3 Gtl2,Rian,Dio3基因在各实验组表达变化
宋鹏琰[12]实验结果表明,与PFOA组(模型组)相比,80 mg/kg+模型组和100 mg/kg LBP+模型组可显著上调Gtl2、Rian、Dio3基因mRNA的表达量,见图3。
综上可知,LBP可通过调控bax、bcl-w、P53、capase-8、capase-9、HSP70等凋亡相关蛋白以及Dio3、Gt12、Rian等基因的表达,达到拮抗辐射、MEHP和MBP、DES、环磷酰胺、PFOA等对睾丸组织的凋亡的作用。
1.3 调节性激素平衡
睾丸是性生殖系统的核心,与下丘脑、垂体共同参与雄激素和精子的合成[21]。雄激素主要由睾酮(Testosterone,T)、双氢睾酮(Dihydrotestosterone,DHT)组成。睾丸生精小管中高浓度的T对促进精子形成有良好的作用,T缺乏的患者常表现为睾丸功能障碍。促性腺激素释放激素(Gonadotrophin releasing hormone,GnRH)由下丘脑分泌,通过垂体-门静脉系统作用于垂体,促进垂体前叶分泌卵泡刺激素(Follicle stimulating hormone,FSH)和黄体生成素(Luteinizing hormone,LH)。T由睾丸间质细胞刺激生成,联合FSH共同促进生精细胞的发育成熟,但同时也可负向抑制FSH、LH的分泌,维持三者之间的平衡。由此可知,下丘脑-垂体-性腺轴通过影响T、FSH、LH等性激素的合成和分泌,在性成熟、生殖和性行为等生殖活动的不同阶段发挥着重要作用。
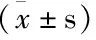
指标宋鹏琰[12]Model(PFOA)80mg/kgLBP+ModelSHI等[5]Model40mg/kgLBP+Model黄宗轩[19]Model10mg/kgLBP+ModelT(ng/mL)0.19±0.021.35±0.210.6±0.11.55±0.153.96±0.125.43±0.30FSH(mIU/mL)//1.5±0.11.7±0.15.73±0.274.96±0.85LH(mIU/mL)//0.835±0.0751.125±0.12512.24±0.3211.25±0.30LH/FSH//0.5±0.050.65±0.050.48±0.030.66±0.06
宋鹏琰[12]、黄宗轩[19]、SHI等[5]3项研究结果表明,LBP+模型组的血清T水平较模型组明显升高,说明LBP可改善链脲佐菌素、环磷酰胺、PFOA诱导的小鼠睾丸功能障碍,详见表4。另外,TANG等[14]通过实验研究证实,LBP可以修复壬基酚(一种类似雌激素的人工内分泌干扰物,干扰激素分泌)对斑马鱼睾丸造成的损伤。
赵亚兵[7]通过实验研究发现,模型组+80mg/kg LBP组的血清T表达水平明显高于模型组,低于正常组,且3组的LH、FSH表达水平差异不大,见图4。
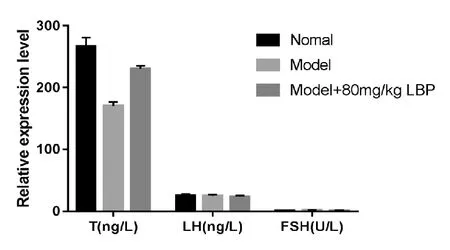
图4 T,LH,FSH结果在各组中的比较
HUANG等[22]实验研究发现,血清T水平在模型组+100 mg/kg LBP组的表达明显高于模型组,见图5。
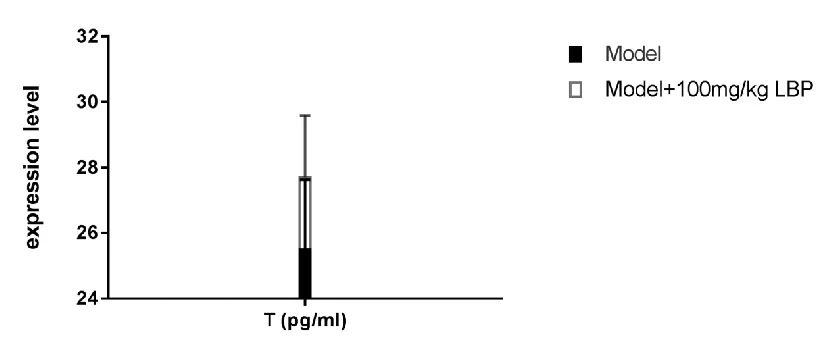
图5 血清T结果在各组中的比较
上述研究结果表明,LBP可通过调控性激素T、FSH、LH的水平修复由链脲佐菌素、环磷酰胺、PFOA、壬基酚、辐射等诱导的小鼠睾丸功能障碍,另外还可在不刺激大鼠的情况下增强大鼠的性行为。
1.4 促进精子发生过程中相关因子的表达
干细胞的发育受其特定的外部环境和内部因素的调控,干细胞生长因子由支持细胞分泌的。因此,我们可以认为血睾丸屏障[20],即一个有利于生精细胞分化发育的微环境,主要由睾丸支持细胞组成,必然对生精细胞的行为产生一定影响。
1.5 对生殖系相关神经的影响
非胆碱能神经和非肾上腺(Noncholinergic and nonadrenal,NANC)神经刺激阴茎勃起;在阴茎海绵体的NANC神经中,存在一氧化氮合酶(Nitric oxide synthase,NOS)和一氧化氮(Nitric oxide,NO)的神经传递过程。NO由NOS催化,广泛存在于睾丸、附睾、阴茎等生殖系统中,激活鸟苷酸环化酶使细胞产生大量的磷酸环鸟苷(Cyclic guanosine phosphate,cGMP),从而迅速降低海绵体平滑肌的张力,使海绵体腔充血,促进阴茎勃起,同时,其在体内的生物学作用取决于NOS的活性[23]。
男性的性行为主要由性动机和性交配两部分组成,同时它们分别由相关神经支配。通过研究LBP对男性性功能的影响,评价神经元NOS在内侧视前区(Medial preoptic area,MPOA)和室旁核(Paraventricular nucleus,PVN)的表达及机制,其中,MPOA和PVN区域负责性启动,HUANG 等[22]实验研究发现,LBP可通过增加雄性大鼠MPOA中神经元NOS的表达而增强性行为。
2 LBP对雄性生殖系统的保护作用
2.1 对男性生殖器官和精子参数的影响
众所周知,睾丸在精子形成和性激素调节中发挥着至关重要的作用。睾丸支持细胞为各级生精细胞提供营养、支持和保护,并可通过紧密连接参与血睾丸屏障的形成,为生精细胞的发育提供良好的微环境。附睾是成熟精子在睾丸中的重要储存部位。睾丸和附睾的形态和组织结构对精子发生有重要影响,同时,精子参数能有效地反映性器官的结构和功能[21]。
刘玉姣[17]实验研究发现,模型组(DES染毒)+10 mg/kg LBP组睾丸及附睾重量明显高于模型组,详见图6。
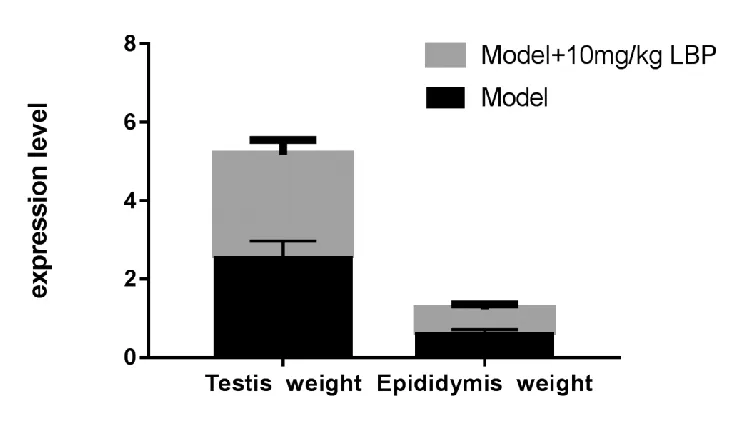
图6 各组中睾丸(Testis)和附睾(Epididymis)体重比较
如图7所示,Luo 等[20]研究发现,模型组(电离辐射)+10 mg/kg LBP组睾丸及附睾重量明显高于模型组。
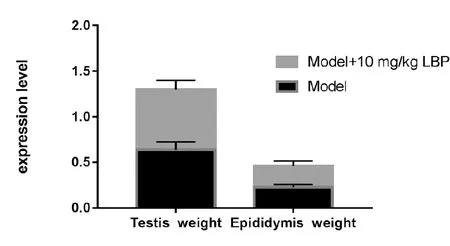
图7 LBP对大鼠睾丸(Testis)和附睾(Epididymis)体重的影响
周贤伟等[24]实验研究发现,模型组(白消安染毒)+300 mg/kg LBP组睾丸及附睾重量明显高于模型组。见图8。
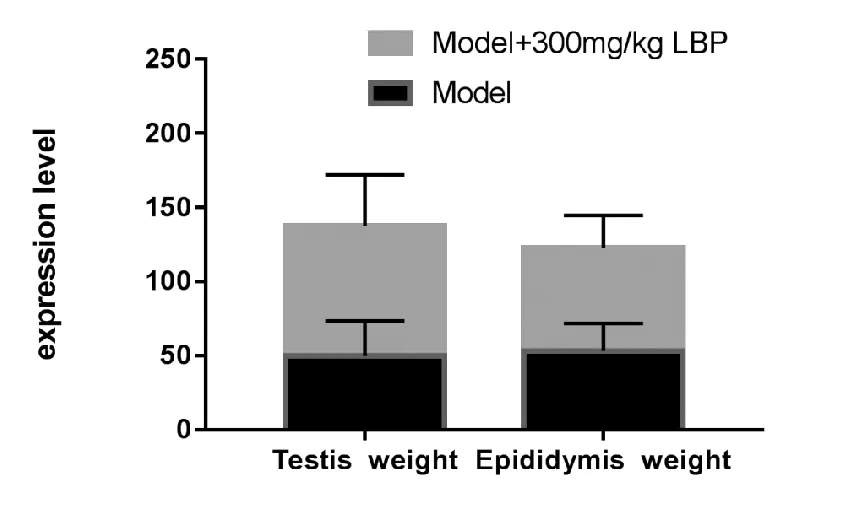
图8 各组中睾丸(Testis)和附睾(Epididymis)体重比较
唐霖等[8]通过实验研究发现,模型组+不同剂量LBP组的精子密度和精子活性均高于模型组,接近正常组。见图9。
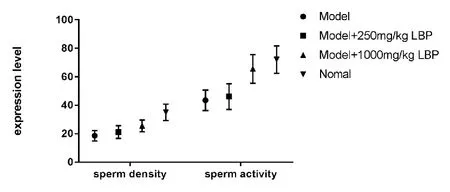
图9 各组精子密度(sperm density)和精子活性(sperm activity)表达水平比较
黄宗轩[19]通过实验研究发现,模型组(环磷酰胺染毒)+LBP不同剂量组的精子密度高于模型组,接近正常组。详见图10。
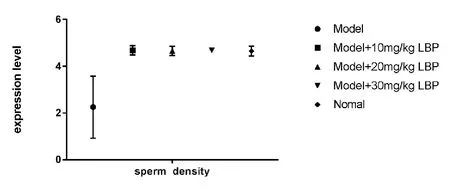
图10 各组精子密度(sperm density)表达水平比较
刘玉姣[17]研究发现,模型组(DES染毒)+ LBP不同剂量组的精子数量及去精子率均高于模型组,接近正常组。见图11。

图11 各组精子表达量(amount of sperm)及精子畸形率(rate of sperm defomation)变化
2.2 对性功能的影响
众所周知,LBP可以保护生殖功能。男性的性行为主要由两部分组成:性动机和性交,这两部分分别由相关神经支配。大脑内MPOA和PVN负责性启动,包括阴茎非接触性勃起(Penile non-contact erection,NCE),交媾参数表现为坐位频率(Mount frequency,MF)、插入延迟(Intromission latency,IL)、插入频率(Intromission frequency,IF)、射精潜伏期(Ejaculation latency,EL)、射精频率(Ejaculatory frequency,EF)、射精后间隔(Post-ejaculatory intervals,PEI)[22]。
HUANG等[22]通过实验发现,模型组(空白组)+100 mg/kg LBP组MF、IF、EF表达高于模型组,而LBP +100 mg/kg LBP组IL、EL、PEI表达低于模型组。见图12。
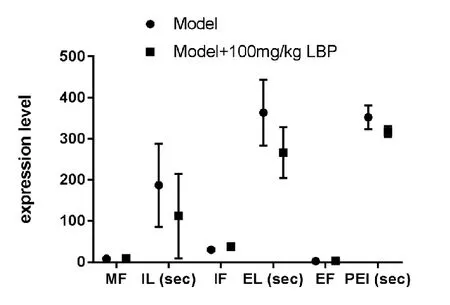
图12 MF、IL、IF、EL、EF、PEI 在各组中结果比较
2.3 对精原干细胞的影响
精子发生是以生精细胞为基础的。众所周知,精原干细胞分为A型和B型,位于睾丸曲细精管的基底膜,不仅可以更新自己,同时也是精子形成的基础。C-kit是干细胞生长因子受体,在睾丸组织中的A型精原细胞中被发现,同时也是精子发生的特异性标志物之一。C-kit阳性细胞数和H-score是评价生精细胞的指标[24]。
周贤伟等[24]实验研究发现,模型组(白消安组)+不同剂量LBP组的c-kit阳性细胞数和H-score明显高于模型组。见图13。
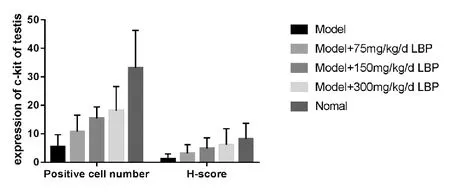
图13 各组中c-kit阳性细胞数和H-score结果比较
众所周知,睾丸支持细胞合成和分泌雄激素结合蛋白(Androgen binding proteins,ABP),形成血睾丸屏障,促进精子的产生和成熟,也可作为睾丸功能的指标。
赵亚兵[7]实验研究发现,模型组(辐射组)+80 mg/kg LBP组ABP表达水平显著高于模型组,且与正常对照组接近。详见图14。
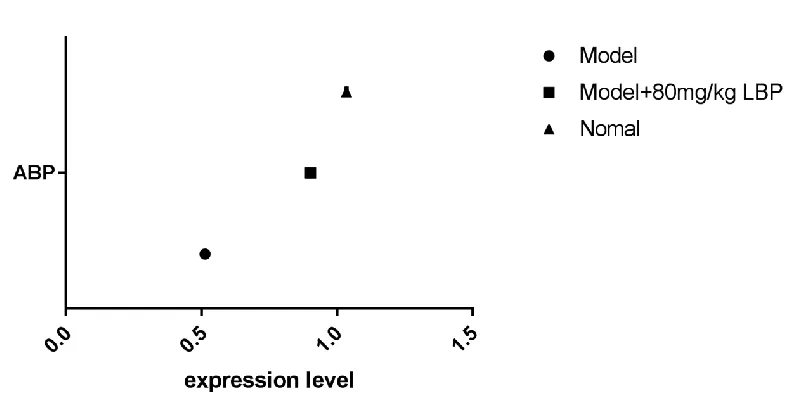
图14 ABP在各组中的比较
LUO等[20]实验研究发现,模型组(辐射组)+10 mg/kg LBP组的睾丸生殖细胞如凋亡细胞(Apoptotic cell)、单倍体细胞(Haploid cell,)、二倍体细胞(Diploid cell)、减数分裂细胞(Detraploid cell)的表达水平明显高于模型组(辐射组),且与正常对照组相近。详见图15。
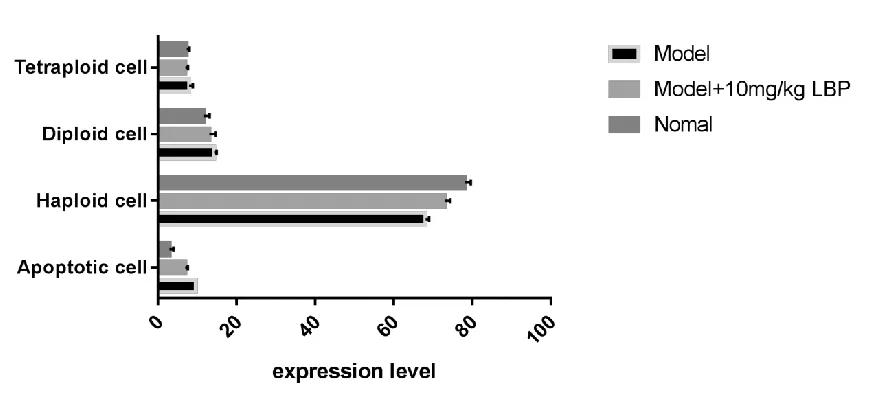
图15 LBP对辐照大鼠睾丸生殖细胞计数的影响
3 总结与展望
综上所述,大量实验研究证实,LBP可通过清除自由基、抑制细胞凋亡、调节激素平衡、增强细胞免疫等机制修复雄性生殖器官、精子参数、性功能、精原干细胞等生殖系,拮抗辐射、药物、疾病、环境和氧化应激引起的睾丸损伤。通过对LBP治疗和修复雄性性腺损伤的作用机理的综述,表明LBP治疗雄性生殖系统功能障碍是有效的,可以更好地指导临床实践。
然而,关于LBP修复性腺损伤的研究还不够全面,大部分研究还处于实验阶段,应进一步加强LBP的临床研究与开发,为临床应用提供更充分的理论依据。目前,关于LBP对生殖系统损伤的修复作用大部分研究着眼于雄性生殖系统,对雌性生殖系统损伤的修复作用还相对较少,在以后的研究中可加大这方面的研究力度。

