基于胸腺嘧啶碱基错配的汞离子传感器研究进展
王久军,吴 亚,马博文,张兴平
(长江大学 生命科学学院,湖北 荆州 434025)
汞在自然界中多以化合物形式存在,通常被应用于各种含汞化学药品的制备以及相关电子产品的生产。在开发汞区域的水、空气和土壤中存在着大量汞单质、汞离子以及汞蒸气[1],它们可通过食物链在人体中富集,并和人体内含硫氨基酸如甲硫氨酸、半胱氨酸等通过Hg-S键结合导致氨基酸功能缺失,且一旦被环境中微生物转化为甲基汞,将引起脑部、肝、肾脏等部位更严重的疾病,极大地威胁着人类的健康[2-3]。以汞为代表的重金属污染随着工业的发展仍在不断加剧,2013年研究人员在对浙江省343种蔬菜重金属含量的检测中发现,铬和汞的平均含量分别为0.015 mg/kg和0.022 mg/kg,其中4.37%样品中铬含量和2.62%样品中汞含量已超过中国法律规定的最大允许浓度(MACs)[4];在我国贵州矿区及相关工业区的土壤中,汞含量超过正常农田的几十倍,这对环境造成了严重危害[5]。为了降低汞污染,保证环境卫生及食品安全,国内外对相关领域发布了卫生标准,中国卫生部规定饮用水中汞单质含量不得超过0.001 mg/L(约4.9 nmol/L),含汞氯化物不得超过250 mg/L(约0.92 mmol/L),美国环境保护协会(EPA)规定饮用水中汞单质含量不得超过2.0 ppb(约10 nmol/L)[6]。为了更严格防治汞污染,相关领域卫生标准可能将进一步加强,因此人们需要开发更加灵敏、高效的汞离子生物传感器以满足日益严格的检测要求。
传统检测汞离子的方法多是基于大型仪器,如光谱法、色谱法。其中,光谱法主要有原子吸收光谱法[7-8]、原子发射光谱法[9-10];色谱法主要有高效液相色谱法[11]、色谱-质谱联用法[12-13]。这些方法已经被成熟运用于各个领域的汞离子检测,其灵敏度和准确度也已得到充分验证,但该类方法对操作人员的专业性要求较高且依赖大型昂贵检测设备,难以达到便捷高效的检测要求。研究发现[14-15]两个胸腺嘧啶(T)的-NH3残基通过与汞离子发生质子取代反应产生Hg-N共价键,并最终形成T-Hg(Ⅱ)-T复合物。在体系中胸腺嘧啶的该残基可作为汞离子传感器良好的识别基团,特异性地识别汞离子。自该现象被发现起,T-Hg(Ⅱ)-T被广泛用于汞离子探针的设计与开发[16-20]。根据不同的信号输出方式,这类探针大致可分为3大类:基于简单电子媒介体的汞离子传感器、基于纳米粒子及量子点材料的汞离子传感器、基于免标记核酸探针的汞离子传感器,部分检测方法已在实际应用中表现出良好性能。本文对上述3种类型的汞离子生物传感器展开介绍,以期为今后汞离子的检测提供参考。
1 基于简单电子媒介体的汞离子传感器
1.1 电子媒介体电化学探针
该类型传感器通常利用在多聚胸腺嘧啶核苷酸链(PolyT DNA)末端标记电子转移载体或在催化液中添加底物,通过汞离子与核苷酸的结合导致电子转移载体与电极表面的空间距离发生变化,以实现电子转移通道的建立与阻断,或者使电极表面的通透性发生改变,导致探针分子在电极表面发生氧化还原反应的效率产生差异,从而产生电信号的变化[21]。2015年,Tortolini等[22]设计了多聚胸腺嘧啶核苷酸链修饰的金电极(如图1),在核苷酸3′末端标记亚甲基蓝(MB)作为氧化还原探针,汞离子的存在导致核苷酸形成发卡结构,亚甲基蓝与金电极表面的距离拉近后,金电极表面的电子增多引起电流的增加,从而实现了溶液中汞离子的检测。Si等[23]同样在金电极表面固定多聚胸腺嘧啶核苷酸链,当体系中不存在汞离子时,自动延伸形成的多聚腺嘌呤核苷酸链(PolyA DNA)可与PolyT DNA互补,在亚甲基蓝氧化还原作用下产生较高的电信号;若存在汞离子,金电极上形成的T-Hg(Ⅱ)-T导致标记亚甲基蓝的DNA无法固定,电信号减小。与金电极相比,氧化铟锡(ITO)电极也具有很好的导电性能且成本比金电极低,Fu等[24]制备亚甲基蓝标记的多聚胸腺嘧啶核苷酸链及其含多聚胸腺嘧啶的部分互补链,当体系中不存在汞离子时,在核酸外切酶Ⅲ(ExoⅢ)降解作用下剩余含较长序列的单链,由于静电排斥导致其难以靠近带负电荷的ITO电极表面;当存在汞离子时,T-Hg(Ⅱ)-T结构的形成导致形成完整双链,可被Exo Ⅲ完全降解,ITO电极表面对较短的核苷酸片段排斥力减小,附着在电极表面后导致电化学信号增强。该方法已成功应用于水中汞离子的检测。基于T-Hg(Ⅱ)-T识别的简单电子媒介体探针依赖电极与电子载体的结合与阻断,实现了便捷高效的汞离子检测,在合适的电子载体下,利用循环放大作用可检测超痕量汞离子。

图1 基于金电极与亚甲基蓝的电化学探针原理图Fig.1 Schematic diagram of electrochemical probe based on gold electrode and methylene blue
1.2 电子媒介体光信号探针
针对不同检测场景,开发出了基于电子媒介体光信号探针对汞离子进行检测的方法,其中常用方法是基于电子转移引起的能量变化,如分子内电荷转移(ICT)和荧光能量共振转移(FRET),分别利用具有特殊汞离子结合位点的共轭与非共轭化合物上电子转移通道的阻断与恢复,实现汞离子介导下的电子受体能量变化,使得受体最大吸收波长产生偏移,并引起荧光变化。Li等[25]设计了基于T-Hg(Ⅱ)-T和氮化石墨(g-C3N4)的汞离子传感器,多聚胸腺嘧啶核苷酸单链(ssDNA)通过π-π堆积附着在氮化石墨的表面,汞离子的存在使得ssDNA形成发卡结构的dsDNA,当汞离子非常接近g-C3N4表面时,g-C3N4电子向汞离子发生转移,导致荧光猝灭。Long等[26]设计了基于分子内电荷转移(ICT)的七甲川花菁染料(如图2),将氟化的胸腺嘧啶基团修饰至七甲川花菁染料,在汞离子存在下形成T-Hg(Ⅱ)-T复合物,染料基团内电荷可转移至汞离子,且氟的引入通过形成分子间氢键进一步促使染料基团聚集,荧光进一步猝灭,该方法可用于细胞线粒体中汞离子的快速检测。但荧光猝灭型探针在检测难易度及抗干扰性能上存在不足,荧光增强型探针相较而言具有一定优势,Sun等[27]制备了单胸腺嘧啶参与形成的共轭聚合物(CPs),基于聚集诱导发光效应(AIEE)设计了汞离子荧光探针。通过胸腺嘧啶作为汞离子识别与结合位点,实现汞离子诱导的CPs聚集,由于在CPs基团中引入荧光染料四苯基乙烯(TPE),故CPs的荧光信号可随聚合效应增强。Huang等[28]合成了一种以Cu2+为中心,以共轭三羧酸基团为配体的金属-有机骨架化合物(MOF),该化合物可通过π-π堆积、静电相互作用及氢键紧密吸附于荧光素(FAM)标记的富T单链DNA上,在光诱导电子转移(PET)作用下荧光猝灭。而汞离子的存在促使T-Hg(Ⅱ)-T发卡结构形成,并使MOF从DNA上释放,荧光恢复,进一步通过荧光“off-on”转换过程实现其他部分生物硫醇的快速检测。部分电子媒介体光信号探针的检测范围和检出限与电化学探针相比无明显差别。因此,针对不同应用场景,可选择合适的检测方法。

图2 基于七甲川花菁染料的光信号探针原理图Fig.2 Schematic diagram of optical signal probe based on heptamethine cyanine dye
2 基于纳米粒子/量子点探针的汞离子传感器
2.1 纳米粒子/量子点电化学探针
金/银等纳米颗粒由于具有良好的导电性、较大的比表面积及生物相容性,已被广泛应用于分析检测领域。通过将纳米颗粒附着在电子供体如石墨烯材料上,同时附着多聚胸腺嘧啶核苷酸链作为汞离子的结合位点,基于纳米粒子-核苷酸链复合物所含电子发生转移导致的电信号变化,从而可实现汞离子的检测。Jin等[29]制备金纳米棒官能化的氧化还原石墨烯材料,负载硫堇和链霉抗生素蛋白作为信号放大基团(RGO@AuNR-TH-SA),同时制备富含胸腺嘧啶的DNA S1附着的金电极板(S1-AuE)。当体系中存在汞离子时,S2可通过T-Hg(Ⅱ)-T复合物成功与MCH-S1/AuE反应,并且RGO@AuNR-TH-SA可以连接至Hg2+/S2/MCH-S1/AuE ,通过链霉抗生素蛋白SA与DNA的特异性结合,实现了电信号的增强,该方法可以实现汞离子的痕量检测。Yu等[30]将金纳米颗粒(AuNPs)修饰的蒲公英状氧化铜微球D-CuO/Au复合物在电极表面固定并干燥后,在Au-S共价键的作用下使硫甙寡核苷酸链P1附着在含有D-CuO/Au复合物的电极表面,再加入寡核苷酸链P2与待测样品(见图3),若样品中含有汞离子,则形成T-Hg(Ⅱ)-T结构,并在“发卡”探针H1-H2的自组装及甲苯胺蓝(TB)信号放大的作用下,通过电信号变化实现对汞离子的痕量检测。

图3 基于金纳米颗粒的电化学探针检测汞离子原理图Fig.3 Schematic diagram of gold nanoparticle-based electrochemical probe detection of mercury ions
2.2 纳米粒子/量子点光信号探针
量子点材料于2004年由Xu等[31]首次报道,量子点材料拥有比纳米材料更小的纳米尺度,更好的光学、电学及生物相容性质,在结合功能化基团后可用于生物成像,实现生物大分子或无机离子的检测。2019年Ma等[32]将带负电荷的银纳米簇附着在多聚胸腺嘧啶核苷酸链的一端,带正电的金纳米颗粒在静电吸附作用下靠近银纳米簇使其荧光被猝灭,在体系中汞离子作用下形成T-Hg(Ⅱ)-T结构,同时在核酸外切酶Ⅲ(ExoⅢ)作用下降解该片段,缺失固定模板的银纳米簇与金纳米颗粒得以释放,银纳米簇部分荧光恢复,且继续在ExoⅢ作用下完成体系的荧光信号循环放大过程,实现对汞离子的痕量检测。Cui等[33]将多聚胸腺嘧啶核苷酸链标记的碳量子点(OND-CDs)通过疏水作用与共价键吸附在石墨烯(GO)表面使碳量子点荧光猝灭(见图4A),当体系中存在汞离子时,通过形成T-Hg(Ⅱ)-T复合物使得核苷酸单链形成杂交双链以避免被GO吸附,因荧光能量共振转移(FRET)通道被阻断而导致碳量子点荧光恢复,从而实现对汞离子的微量检测。Guo等[34]分别制备多聚胸腺嘧啶核苷酸链P1、P2修饰的CdTe量子点作为荧光信号输出,当汞离子存在时,溶液中两种量子点复合物通过T-Hg(Ⅱ)-T结构粘合在一起,形成聚集体的量子点(QDs)产生激子能量转移效应,从而导致光谱带红移及荧光信号降低。Gao等[35]利用双链DNA修饰的金纳米粒子(dsDNA-AuNPs)进行非交联聚集和共振瑞利散射(RRS),设计了一种汞离子敏感性检测方法,其检测限为0.4 nmol/L。Li等[36]以山药为氮、碳源,采用水热法制备氮掺杂碳量子点(CNDs),结合多聚胸腺嘧啶核苷酸链用于检测汞离子。此外,利用纳米粒子或量子点设计汞离子检测探针,在选择易制备、易表征、量子产率高的材料后,其通用的传感策略还可用于其他金属、小分子和蛋白质的检测。
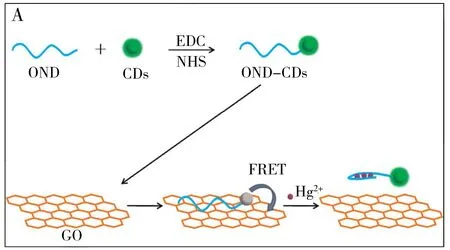

图4 基于碳量子点的光信号探针(A)及基于黄连素的免标记核酸探针(B)检测汞离子原理图Fig.4 Schematic diagrams for detection of mercury ions based on carbon quantum dot optical signal probe(A) and berberine-based label-free nucleic acid probe(B)
3 基于免标记核酸探针的汞离子传感器
免标记核酸探针自开发以来在众多检测领域中得到了广泛研究,基于免标记核酸探针的汞离子生物传感器主要依赖富含胸腺嘧啶的DNA寡核苷酸链在构象上的变化,包括杂交双链的形成、双链在体系中浓度或空间位置的变化等,在无需荧光基团标记的情况下实现随汞离子浓度变化而发生荧光强度变化或其他信号的开启或关闭[37]。该类型的检测方法常用到等温扩增、核酸外切酶Ⅲ(Exo Ⅲ)剪切等技术作为信号辅助放大系统以进一步提高检测能力。
Zhu等[38]基于T-Hg(Ⅱ)-T和乳液PCR技术(ePCR)开发了一种汞离子的检测方法,该方法以等温扩增、ePCR和液滴读取分析3个步骤,通过汞离子介导的等温扩增实现核酸序列的延伸,再通过乳液PCR技术得到带有正序列和负序列的液滴,由于检测前已确定由5个T-Hg(Ⅱ)-T结构为基础作为最佳扩增单位,因此可通过对扩增后正负液滴的比率分析实现汞离子的微量检测。通过汞离子介导的核酸空间结构发生变化并形成DNA模拟酶复合物,可催化某些介体物质产生颜色变化。Du等基于T-Hg(Ⅱ)-T[39]和G-四链体[40]的免标记核酸探针,利用汞离子和DNA聚合酶的作用促进富G序列从原有模板序列上释放,在合适条件下形成G-四链体并与氯高铁血红素结合形成具有过氧化物模拟酶活性的复合物。该复合物可催化ABTS产生肉眼可见的颜色变化进行汞离子的检测。Yun等[41]同样设计了此类汞离子探针,T-Hg(Ⅱ)-T配位化学诱导的熵驱动催化反应将富G序列从初始模板链上释放,在氯高铁血红素参与下形成DNA模拟酶(DNAzyme)并催化四甲基联苯胺(TMB)由无色变为蓝色,通过测定吸光度可得到与汞离子浓度的线性关系。但可视化检测法虽然可直观反映体系对目标检测物的响应,却仍需进一步定量分析,因此基于免标记核酸探针的荧光检测法被不断开发。Song等[42]设计了基于T-Hg(Ⅱ)-T和黄连素的无标记核酸探针(如图4B),当汞离子不存在时,黄连素在游离状态下荧光强度极微弱,少量附着在寡核苷酸链上的黄连素的荧光强度小幅度增强;在汞离子存在时与寡核苷酸链形成发卡结构,为黄连素提供了稳定聚集位点,导致荧光强度大幅增强,基于此,可实现汞离子的检测。Zhou等[43]设计了基于G-四链体的汞离子探针,该探针基于T-Hg(Ⅱ)-T结构的形成,导致伴随生成的3′末端被Exo Ⅲ降解,并释放被覆盖的G4序列,在体系中自发形成G-四链体结构并发出荧光。Wang与Zhang等[ 44-45]则开发了基于T-Hg(Ⅱ)-T结构和G-四链体的“Turn-on”型汞离子敏感探针,该探针分别设计了寡核苷酸单链P1及互补链P2,P1链5′端含有G4序列,3′端含有多聚胸腺嘧啶碱基;汞离子的存在促使与P1互补配对的P2被替换,T-Hg(Ⅱ)-T结构的形成可导致G4序列被释放并自发形成G-四链体,该结构在卟啉类化合物N-甲基-卟啉二丙酸Ⅸ(NMM)结合下产生荧光。此后,Liu与Ding等设计了基于G-四链体的“Turn-off”型汞离子探针[46-47],该方法利用汞离子与多聚胸腺嘧啶寡核苷酸链结合形成的T-Hg(Ⅱ)-T结构覆盖G4序列,从而阻止该序列形成G-四链体结构,与体系中dsDNA单独存在导致的强烈荧光相比,汞离子的加入可猝灭荧光,同时在Exo Ⅲ作用下荧光强度进一步下降。该类型探针借助特殊发光性质的核酸染料或荧光基团,在无需标记情况下与核酸探针溶液体系简单混合则可实现低成本的汞离子检测。免标记核酸探针正成为汞离子生物传感器研究的新方向。
表1为上述3类检测方法所涉及文献在检测范围、检测限、有无信号放大途径3项指标上的对比。
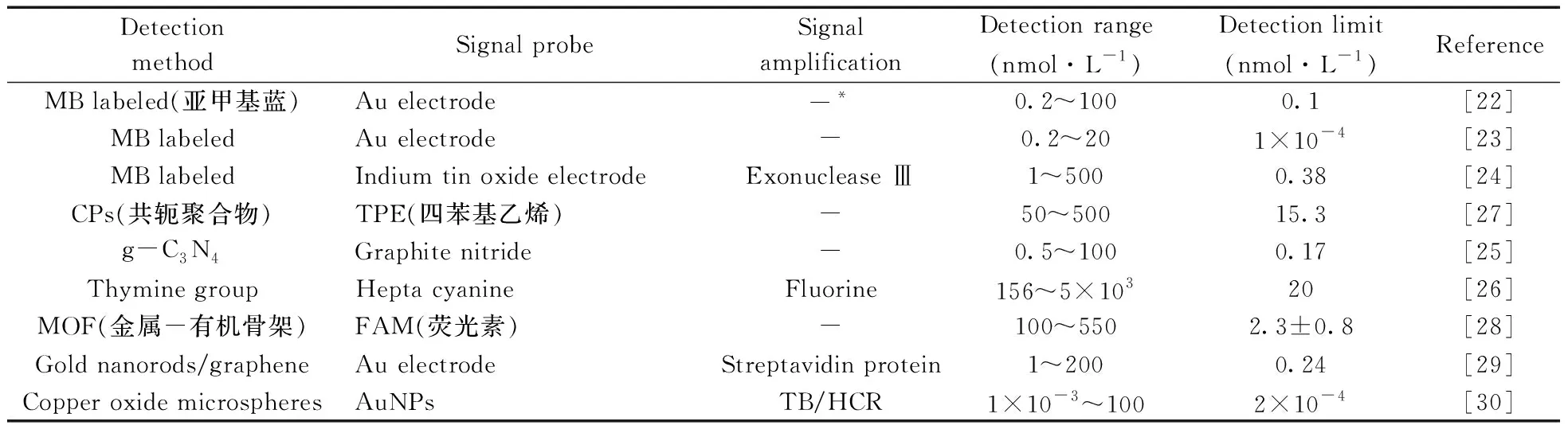
表1 3类检测方法及其指标对比Table 1 Comparison of three detection methods and their indicators
(续表1)

Detection methodSignal probeSignal amplificationDetection range(nmol·L-1)Detection limit(nmol·L-1)ReferenceSilver nanoclustersAuNPsExonuclease Ⅲ5.0×10-3~102.3×10-3[32]Graphene oxideOND-CDs-5~2002.6[33]Thymine groupCdTe quantum dots-0~1003.33[34]ePCRPositive/ negative droplets-4×10-6~4×10-21×10-5[38]Peroxo mimetic enzymeABTS(2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸)-20~50016.5[39]DNAzymeTetramethylbenzidine-5×10-3~20.1[41]Thymine groupBerberine-100~1×1047.7[42]G-quadruplexNMM(N-甲基-卟啉二丙酸Ⅸ)Exonuclease Ⅲ1×10-6~1001×10-5[43]G-quadruplexNMM-50~50012.9[44-45]G-quadruplexNMMExonuclease Ⅲ1×10-3~5001×10-3[46-47]
*no signal amplification
4 结论与展望
在汞等重金属污染日益严重的背景下,近年来各类新型汞离子生物传感器陆续被开发出来,相较于传统汞离子检测手段,新型汞离子生物传感器在检测水平与检测效率上均有了较大的提高,利用这些方法不仅可以实现更为高效准确的汞检测和污染预防,还可为更多其他金属离子或污染物的检测提供参考。随着新型材料被陆续开发,今后以T-Hg(Ⅱ)-T为识别基团时可无需设计复杂的寡核苷酸链,而是以单胸腺嘧啶核苷酸为识别位点,在探针设计与制备过程中可更加灵活;同时汞离子的生物传感器后续发展可基于信号放大技术(如等温扩增技术、核酸外切酶辅助信号放大技术等)展开更多研究。当前汞离子传感器的开发目标不仅是获得更加高效准确的检测方法,更是这类检测方法在实际检测领域发挥良好的经济效应。因此,后续汞离子生物传感器的设计需进一步考虑其实际应用的可行性与便利性,与传统汞离子检测方法形成不同检测场景的互补,从而将当前具有较大应用前景的传感器进一步开发为可投放的成熟产品。

