hUC-MSCs基因表达及其对金黄色葡萄球菌抗菌活性
刘永娟 任纪祯 何才 周子艺 李丹怡 冷向锋

[摘要]目的 检测转染抗菌肽LL-37人脐带间充质干细胞(hUC-MSCs)的基因表达及其对金黄色葡萄球菌的抗菌活性。方法 分离、培养hUC-MSCs;構建LL-37慢病毒载体转染至hUC-MSCs,倒置显微镜观察细胞形态,计算其转染效率;应用Western blot方法检测LL-37表达,酶标比浊法检测细胞培养上清液抗菌活性。结果 成功培养hUC-MSCs;获取包装滴度为1×1012TU/L的LL-37慢病毒载体,转染至hUC-MSCs后72 h可观察到细胞呈现绿色荧光,转染效率为85.40%。Western blot检测显示,转染组hUC-MSCs过表达LL-37,细胞培养上清液对金黄色葡萄球菌有明显抑制作用,抑菌率为98.74%。结论 hUC-MSCs可成功表达具有较强抗菌活性的抗菌肽LL-37。
[关键词] 金黄色葡萄球菌;间充质基质细胞;转染;抗菌药;抗微生物阳离子肽类
[中图分类号] R978[文献标志码] A[文章编号] 2096-5532(2020)04-0379-06
doi:10.11712/jms.2096-5532.2020.56.049[HT]
[网络出版] http://kns.cnki.net/kcms/detail/37.1517.r.20200325.1005.002.html;2020-03-026 13:34
GENE EXPRESSION OF HUC-MSCS AND ITS ANTIBACTERIAL ACTIVITY AGAINST STAPHYLOCOCCUS AUREUS
LIU Yongjuan, REN Jizhen, HE Cai, ZHOU Ziyi, LI Danyi, LENG Xiangfeng
(Department of Burn and Plastic Surgery, The Affiliated Hospital of Qingdao University, Qingdao 266003, China)
[ABSTRACT]Objective To determine the gene expression of human umbilical cord mesenchymal stem cells (hUC-MSCs) transfected with antimicrobial peptide LL-37 and its antibacterial activity against Staphylococcus aureus.
Methods The hUC-MSCs were isolated and cultured, and were transfected with a lentivirus vector constructed from LL-37. Cell morphology was evaluated under an inverted microscope, and the transfection efficiency of the cells was calculated. The expression of LL-37 was determined by Western blot. The antibacterial activity of cell culture supernatant was determined by turbidimetry. Results The hUC-MSCs were successfully cultured. The LL-37 lentivirus vector with a packaging titer of 1×1012 TU/L was obtained and transfected into hUC-MSCs. After transfection for 72 h, green fluorescence was observed. The transfection efficiency was 85.40%. Western blot showed that the hUC-MSCs transfected group had overexpressed LL-37; cell culture supernatant had a significant inhibitory effect on S. aureus, with an inhibition rate of 98.74%.
Conclusion HUC-MSCs can successfully express LL-37, an antimicrobial peptide with strong antibacterial activity.
[KEY WORDS] staphylococcus aureus; mesenchymal stromal cells; transfection; anti-bacterial agents; antimicrobial catio-nic peptides
目前,在烧伤治疗过程中所出现的感染是导致中重度烧伤病人难以愈合甚至死亡的重要原因之一,危害性极大[1]。其中的金黄色葡萄球菌(金葡菌)为烧伤病人主要条件致病菌之一。随着抗生素的广泛应用,引发感染的微生物种类不断变异,其耐药性越来越强,微生物对抗菌药物的耐药性研究一直是专家学者关注的热点[2]。抗微生物阳离子肽类是潜在的抗生素候选药物[3]。人们从两栖类、高等植物、哺乳动物等发现并分离获得具有抗菌活性的多肽,由于其对细菌具有广谱高效杀菌活性,因此命名为抗菌肽[4]。抗菌肽LL-37是目前发现的人体内唯一抗菌肽家族成员,可以广泛抵抗多种病原菌,既可以直接杀灭微生物,还可以防止生物膜形成,并具有局部免疫调节作用[5]。间充质干细胞(MSCs)可以通过再上皮化、促进血管和肉芽组织形成等作用促进伤口愈合[6],而人脐带间充质干细胞(hUC-MSCs)具有获取方便,无伦理道德限制等诸多优势[7]。结合干细胞与抗菌肽的优点,本实验将携带有LL-37的慢病毒载体转染至hUC-MSCs,检测LL-37在hUC-MSCs中的表达及其上清液对金葡菌的抑菌效果,旨在为临床治疗及合理应用不耐药的非抗生素类药物奠定理论基础。
1 材料和方法
1.1 实验材料
脐带来源于我院西海岸院区产科健康足月剖宫产的新生儿,Apgar评分8~10分,孕妇排除传染病,胎儿无先天性疾病。特级胎牛血清(FBS,Biological Industry公司);DMEM/F12(Biological Industry公司);EVOS FL细胞荧光成像系统(美国Invitrogen);金葡菌(CCTCC AB 91093,中国典型培养物保藏中心提供);[STBX]LL-37基因、GV慢病毒载体系列、pHelper 1.0、pHelper 2.0、293T细胞(吉凯公司);超滤离心管AmiconUltra-15(MWCO10K-d);双抗(青霉素-链霉素混合液)(Solarbio)。
1.2 实验方法
1.2.1 hUC-MSCs的分离、传代、培养 参照LIU等[8]方法,在超净台内取出脐带组织,PBS洗涤,去除脐静脉、脐动脉及脐带外膜,剪碎为1 mm3大小,2 500 r/min离心10 min,弃上清。将1 mm3组织块按5 mm间距摆放于100 mm培养皿内,静置,加入培养液湿润培养皿底;置于37.0 ℃、含体积分数0.05 CO2培养箱内培养。细胞达85%~90%融合时,胰酶消化,以2×105/cm2密度接种,待融合率达90%传代。倒置显微镜观察细胞形态。
1.2.2 细胞免疫表型的鉴定 应用流式细胞仪。取第3代细胞,PBS重悬细胞分装至2支1.5 mL EP管中,使每管的细胞密度达到5×109/L、液体量为100 μL,避光。第1管为同型对照管,加入CD90 FITC、CD105 PC5.5、CD73 APC、CD34 PE、CD19 PE、CD11b PE、CD45 PE、HLA-DR PE的同型对照抗体各5 μL;第2管为实验管,加入CD90 FITC、CD105 PC5.5、CD73 APC、CD34 PE、
CD19 PE、CD11b PE、CD45 PE、HLA-DR PE各5 μL。避光孵育30 min,加1 mL PBS离心洗涤,用300 μL PBS重悬,应用流式细胞仪检测细胞表型。实验重复3次。
1.2.3 过表达慢病毒载体构建、包装及检测 由上海吉凯基因有限公司协助完成。①过表达慢病毒克隆的制备:酶切、线性化载体,PCR扩增目的基因片段(根据GenBank数据库人LL-37的cDNA序列设计[STBX]LL-37基因引物,见表1。配制反应体系,于PCR仪中进行反应)。将PCR产物与线性化载体进行交换,获得重组质粒,冰水浴中冷却5 min后转化。将10 μL交换反应产物加入至 100 μL感受态细胞中,置冰上30 min。42 ℃热激 90 s,冰水浴中孵育 2 min。加入LB培养基500 μL,于 37 ℃摇床中振荡培养1 h。取适量菌液均匀涂布,于恒温培养箱倒置培养。配制鉴定反应体系,用无菌枪头挑取单个菌落至20 μL体系中鉴定,于PCR仪中反应。将鉴定出的阳性克隆转化子接种至适量含相应抗生素的LB液体培养基中,37 ℃培养12~16 h,取菌液测序,与目的基因序列比对分析。将测序正确的菌液转接于10 mL含相应抗生素的LB液体培养基中,37 ℃培养过夜,提取合格的质粒进入下游流程。②包装慢病毒并做质量检测:采用自失活型慢病毒包装系统进行包装,pHelper 1.0、pHelper 2.0、载体质粒GV492共同转染293T细胞。转染完成后48~72 h,收获病毒(即未纯化的细胞上清液),浓缩、纯化,得到高滴度的慢病毒保存液,荧光法测定滴度。
1.2.4 分组及转染 选取处于对数生长期的hUC-MSCs,按照细胞密度5×107/L接种于12孔板中,培养至细胞融合度约30%时,随机分为3组,每组设3个复孔。实验组:转染LL-37;空载体组:转染空载体慢病毒;对照组:为未做处理的hUC-MSCs。转染方法:根据预实验结果,将病毒滴度稀释为1×1011TU/L,12孔板每孔加入慢病毒30 μL及感染增强液20 μL,12~24 h换液,转染72 h后,荧光显微镜下观察慢病毒载体携带的绿色荧光(GFP)表达情况,荧光率超过80%表明转染成功,否则重新转染。每3 d换液1次,收集培养上清液按15∶1比例用Ultra-15超滤管浓缩、过滤(0.22 μm)除菌。
1.2.5 LL-37蛋白表达及上清液中LL-37浓度检测 应用Western blot方法检测各组LL-37蛋白表达,結果以LL-37蛋白条带光密度/内参光密度值表示。应用ELISA法测定各组细胞培养上清液中LL-37浓度。
1.2.6 细胞运动、生长能力检测 采用细胞划痕实验方法。
1.2.7 转染后培养上清液抑菌实验 采用酶标比浊法[9]。取9支试管分为金葡菌组(A组)、抗生素组(B组)、LL-37转染组(C组)3组,每组3支。各组处理方法见表2。将试管放入37 ℃、200 r/min摇床中过夜。24 h后,试管涡旋、混匀,立即用移液枪每管取200 μL加入96孔板内,取1个空白孔只加肉汤作为系统调零、消除系统误差,酶标仪检测各孔600 nm波长的吸光度值(OD值)。计算LL-37抑菌率,LL-37抑菌率=(ODA-ODC)/ODA×100%[9]。
1.3 统计学分析
采用Image J图片处理软件处理图片,所得实验数据采用SPSS 23.0和Graph Pad Prism 6软件进行统计分析。计量资料数据以[AKx-D]±s形式表示,多组均数比较采用单因素设计方差分析(one-way ANOVA),两两比较采用LSD法。以P<0.05为差异有统计学意义。
2 结果
2.1 hUC-MSCs细胞形态
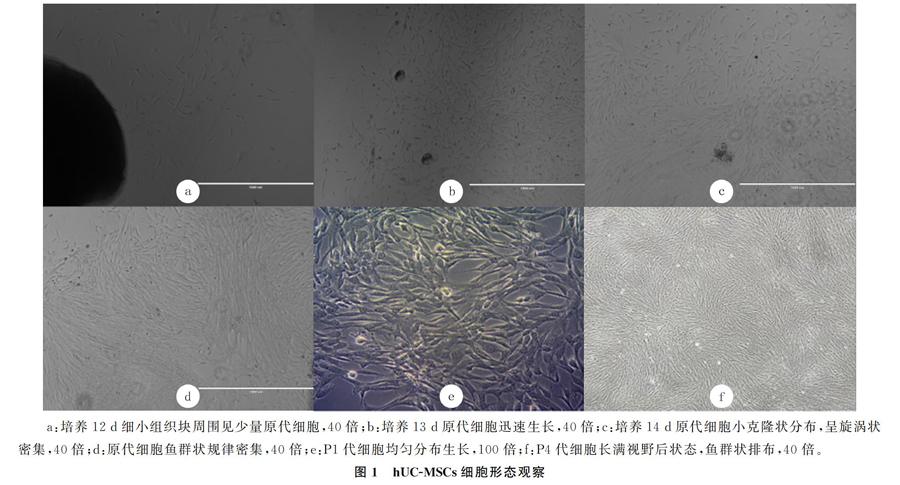
倒置显微镜观察显示,培养12 d细小组织块周围见少量细胞,形态小而均一(图1 a);13 d细胞迅速生长(图1 b);14 d部分小组织周围细胞呈小克隆状密集分布生长,长势较强且呈漩涡状密集分布(图1 c);16 d时组织块周围细胞呈鱼群状规律密集排布,可达90%融合度(图1 d)。消化传代后,P1代细胞均匀分布生长(图1 e),计数板计数显示1个100 mm培养皿的细胞总数约为1.5×106个;培养至P4代细胞长满视野,呈明显鱼群状排布(图1 f)。
2.2 hUC-MSCs的免疫表型
流式细胞仪检测结果显示,细胞表面CD90+100%,CD105+98.04%,CD73+100%,均>95%;CD34+、CD45+、CD11b+、CD19+、HLA-DR+均<5%;符合hUC-MSCs的免疫表型鉴定标准。
2.3 过表达慢病毒载体构建及滴度检测
目的基因载体名称为GV492;克隆位点为Age Ⅰ;荧光标记为gcGFP。目的基因载体元件的顺序为:Ubi-MCS-3FLAG-CBh-gcGFP-IRES-puromycin(图2)。对适量菌液进行测序,将测序结果与目的基因序列进行Blast比对分析。其测序结果经过DNAssist Version 1.0软件分析与GenBank中[STBX]LL-37基因(CAMP(NM_004345))CDS序列相一致,证明成功扩增出[STBX]LL-37基因CDS全序列,重组质粒pGC-FU-LL-37构建成功。荧光法检测显示,实验组包装病毒滴度为1×1012 TU/L。
2.4 LL-37慢病毒载体转染hUC-MSCs效率
LL-37转染hUC-MSCs 72 h转染效率为85.40%,转染成功的细胞呈现绿色荧光(图3)。
2.5 各组 LL-37蛋白表达及细胞培养上清液中LL-37含量比较
Western blot检测显示,实验组LL-37蛋白表達高于空载体组、对照组,差异有统计学意义(F=87.281,P<0.05)。见图4,表3。提示实验组hUC-MSCs中LL-37过表达。实验组细胞培养上清液LL-37含量高于空载体组和对照组,差异有显著性(F=567.838,P<0.05);空载体组和对照组比较差异无显著性(P>0.05)。见表3。
2.6 各组细胞运动、生长能力比较
细胞划痕实验显示,实验组、对照组以及空载体组的hUC-MSCs运动、生长能力均良好(图5)。培养20 h各组均可见细胞良好的融合、生长效果,表明转染[STBX]LL-37基因或转染空载体均未对细胞生长形态造成明显影响。
2.7 各组抑菌实验结果比较
抗生素组以及LL-37转染组的抑菌率分别为(99.524±0.242)%、(98.744±0.142)%(其中A组为计算抑菌率而设,不存在抑菌率),抗生素组、LL-37转染组比较,差异有显著性(F=23.183,P<0.05)。
3 讨论
本文研究应用慢病毒介导抗菌肽[STBX]LL-37基因转染至hUC-MSCs,观察培养上清液对金葡菌抑制作用,结果显示LL-37转染组与抗生素组均有显著抑菌效果(抑菌率均>95%)。可能为烧伤创面金葡菌感染的防治提供新方法。
创面金葡菌感染不仅会影响创面愈合,还会导致创周炎症、菌血症甚至感染性休克,严重影响烧伤、慢性创面病人康复。目前抗生素应用广泛,研发除抗生素外的新型抗菌药应用于临床,既可以丰富临床抗菌药物的多样性,又可以根据病人感染状态采取个性化的合理抗菌药。抗菌肽既不容易导致耐药菌株的产生,又具有广谱抗微生物作用,因而具有极高的应用价值[10-11]。CHEREDDY等[12]的研究表明,人抗菌肽LL-37能够显著减少伤口周围细菌黏附,抑制细菌生物膜的形成从而发挥抗菌的作用。GRONBERG等[13]发现,机体对LL-37具有良好的耐受性,用其治疗下肢静脉溃疡导致的难愈性创面,愈合效率明显提高。添加外源性抗菌肽存在价格昂贵、作用时间短等客观因素[14]。利用转基因技术将外源性抗菌肽基因转染至种子细胞,使其在修复缺损部位时能够持续表达,有效促进细胞增殖、新生血管形成,具有临床应用的潜力[15]。
LL-37不仅有杀菌作用,而且在获得性免疫包括细胞因子的释放、免疫细胞的趋化以及炎症的发生发展中也起着关键作用[16]。抗菌肽LL-37在保护结肠菌群平衡、黏膜稳态、抗炎反应和抗癌发生中
发挥着重要角色[17]。当机体出现创伤、感染时,在丝氨酸蛋白酶-3和其他蛋白水解酶的作用下,生成活性抗菌肽LL-37,参与机体的防御反应[18]。另外,LL-37还可通过激活、募集T淋巴细胞、中性粒细胞、单核细胞以及增强巨噬细胞吞噬等发挥抗菌作用[19]。人源抗菌肽LL-37不仅具有极高的生物安全性,而且不易导致病原菌发生抗性突变,是新型抗生素设计及合成的理想模板[20-21]。
MSCs是基因治疗较为理想的靶细胞[22],能够相对容易地导入外源基因,且细胞在多次分裂后所导入基因能够继续表达。而慢病毒具有感染效率高、毒性低、不易发生宿主免疫反应、能够实现目的基因稳定感染等特点,是较为理想的基因载体[23]。用[STBX]LL-37基因修饰MSCs,利用培养上清液局部作用于烧伤创面细菌所在区域,可以达到靶向治疗的目的,安全、容易操作,还能起到较好的抑菌效果。MSCs具有多向分化和旁分泌能力,在再生医学中具有相当大的应用潜力。SHI等[24]进行的研究显示,hUC-MSCs在深Ⅱ度烧伤大鼠模型组织修复中具有促进作用,其分泌的生物活性分子可有效促进伤口愈合。有研究表明,应用干细胞培养上清液治疗能够发挥干细胞的治疗效果[25]。KRASNODE-MBSKAYA等[26]将合成的LL-37与大肠埃希菌和铜绿假单胞菌共培养,发现其具有抑制细菌生长的作用;应用ELISA方法检测干细胞培养上清液中的LL-37成分,结果显示干细胞可以将LL-37分泌到细胞外。干细胞培养上清液富含干细胞分泌的各种
[LL]细胞因子,可大量生产,易于储存,可采用滤过的方式来灭菌,治疗前无需复苏及扩增细胞,这些优势使其具有广阔的应用前景[27]。与直接应用干细胞相比,外用干细胞培养上清液既能将干细胞分泌的生物学成分有效利用,又经滤过灭菌,并且避免了直接应用干细胞存在的同种异体免疫排斥反应,更安全,且简便易行,
有望成为一种可以应用于临床的治疗感染、皮肤缺损等疾病的综合补充措施之一。本文应用慢病毒介导抗菌肽[STBX]LL-37基因转染至hUC-MSCs,观察培养上清液对金葡菌的抑制作用,结果显示LL-37转染组与抗生素组均有显著的抑菌效果(抑菌率均>95%),为烧伤创面金葡菌感染的防治提供新方法。
综上所述,针对烧伤、感染创面等金葡菌感染,目前多采用抗生素治疗,其中有些病人对抗生素过敏,不宜使用抗生素治疗,因此研发抗生素以外的新型抗菌药,有助于增加抗菌药物的多样性;同一细菌的不同菌株对不同抗菌药物的敏感性也有差异,有肝肾功能损害者需慎用抗菌药以免加重肝肾损害,针对单一用药效果不佳者可选用两种药物协同使用。其中转染有LL-37的干细胞培养上清液对金葡菌具有抑菌效果,有望成为一种可以应用于临床的治疗创面感染的新方法。
[参考文献]
[1]庞久玲,马征,刘爱东,等. 重症烧伤患者医院感染病原学及耐药性分析[J]. 中华医院感染学杂志, 2014,24(6):1353-1355.
[2]王万忠. 骨科感染创面病原菌菌谱及耐药情况分析[J]. 中国病原生物学杂志, 2013,8(9):837-839.
[3]PATERSON D J, TASSIERI M, REBOUD J, et al. Lipid topology and electrostatic interactions underpin lytic activity of linear cationic antimicrobial peptides in membranes[J]. Proceedings of the National Academy of Sciences of the United States of America, 2017,114(40): E8324-E8332.
[4]VELDHUIZEN E J, SCHNEIDER V A, AGUSTIANDARI H, et al. Antimicrobial and immunomodulatory activities of PR-39 derived peptides[J]. PLoS One, 2014,9(4): e95939.
[5]LUO Y, MCLEAN D T, LINDEN G J, et al. The naturally occurring host defense peptide, LL-37, and its truncated mimetics KE-18 and KR-12 have selected biocidal and antibiofilm activities against candida albicans, staphylococcus aureus, and escherichia coli in vitro[J]. Frontiers in Microbiology, 2017,8:544554.
[6]KANJI S, DAS M, AGGARWAL R, et al. Nanofiber-expan-ded human umbilical cord blood-derived CD34+ cell therapy accelerates murine cutaneous wound closure by attenuating pro-inflammatory factors and secreting IL-10[J]. Stem Cell Research, 2014,12(1):275-288.
[7]BATSALI A K, KASTRINAKI M C, PAPADAKI H A, et al. Mesenchymal stem cells derived from whartons jelly of the umbilical cord: biological properties and emerging clinical applications[J]. Current Stem Cell Research & Therapy, 2013,8(2):144-155.
[8]劉玲英,柴家科,段红杰,等. 人脐带间充质干细胞不同分离方法的效果比较[J]. 中华医学杂志, 2013,93(32):2592-2596.
[9]翁佩芳,江华珍,冯凤琴,等. 酶标比浊法评价月桂酸单甘油酯对肉葡萄球菌的抑菌活性[J]. 中国食品学报, 2012,12(5):188-194.
[10]ISHIDA W, HARADA Y, FUKUDA K, et al. Inhibition by the antimicrobial peptide LL37 of Lipopolysaccharide-induced innate immune responses in human corneal fibroblasts[J]. Investigative Ophthalmology & Visual Science, 2016,57(1):30-39.
[11]STEPHAN A, BATINICA M, STEIGER J, et al. LL37: DNA complexes provide antimicrobial activity against intracellular bacteria in human macrophages[J]. Immunology, 2016,148(4):420-432.
[12]CHEREDDY K K, HER C H, COMUNE M, et al. PLGA nanoparticles loaded with host defense peptide LL37 promote wound healing[J]. Journal of Controlled Release, 2014,194:138-147.
[13]GRONBERG A, MAHLAPUU M, STAHLE M, et al. Treatment with LL-37 is safe and effective in enhancing hea-
ling of hard-to-heal venous leg ulcers: a randomized, placebo-controlled clinical trial[J]. Wound Repair and Regeneration: Official Publication of the Wound Healing Society [and] the European Tissue Repair Society, 2014,22(5):613-621.
[14]GHALI S, BHATT K A, DEMPSEY M P, et al. Treating chronic wound infections with genetically modified free flaps[J]. Plastic and Reconstructive Surgery, 2009,123(4):1157-1168.
[15]CHEN Baisong, XIE Hua, ZHANG Shengli, et al. Tissue engineering of bladder using vascular endothelial growth factor gene-modified endothelial progenitor cells[J]. The Internatio-
nal Journal of Artificial Organs, 2011,34(12):1137-1146.
[16]XHINDOLI D, PACOR S, BENINCASA M, et al. The human cathelicidin LL-37-A pore-forming antibacterial peptide and host-cell modulator[J]. Biochimica et Biophysica Acta-Biomembranes, 2016,1858(3, SI):546-566.
[17]ZHANG Meihua, LIANG Weiwei, GONG Wanghua, et al. The critical role of the antimicrobial peptide LL-37/ CRAMP in protection of colon microbiota balance, mucosal homeostasis, anti-inflammatory responses, and resistance to carcinogenesis[J]. Critical Reviews in Immunology, 2019,39(2):83-92.
[18]WANG G S, MISHRA B, LAU K, et al. Antimicrobial peptides in 2014[J]. Pharmaceuticals (Basel, Switzerland), 2015,8(1):123-150.
[19]WAN M, VAN DER DOES A M, TANG X, et al. Antimicrobial peptide LL-37 promotes bacterial phagocytosis by human macrophages[J]. Journal of Leukocyte Biology, 2014,95(6):971-981.
[20]KURODA K, OKUMURA K, ISOGAI H, et al. The human cathelicidin antimicrobial peptide LL-37 and mimics are potential
anticancer drugs[J]. Frontiers in Oncology, 2015,5:144-153.
[21]BONUCCI A, CALDARONI E, BALDUCCI E, et al. A spectroscopic study of the aggregation state of the human antimicrobial peptide LL-37 in bacterial versus host cell model membranes[J]. Biochemistry, 2015,54(45):6760-6768.
[22]THANUNCHAI M, HONGENG S, THITITHANYANONT A. Mesenchymal stromal cells and viral infection[J]. Stem Cells International, 2015, 2015:860950.
[23]SAKUMA T, BARRY M A, IKEDA Y. Lentiviral vectors: basic to translational[J]. The Biochemical Journal, 2012,443(3):603-618.
[24]SHI Hui, XU Xiao, ZHANG Bin, et al. 3,3-Diindolylme-
thane stimulates exosomal Wnt11 autocrine signaling in human umbilical cord mesenchymal stem cells to enhance wound hea-
ling[J]. Theranostics, 2017,7(6):1674-1688.
[25]CHEN Lei, XU Yingbin, ZHAO Jingling, et al. Conditioned medium from hypoxic bone marrow-derived mesenchymal stem cells enhances wound healing in mice[J]. PLoS One, 2014,9(4): e96161.
[26]KRASNODEMBSKAYA A, SONG Y L, FANG X H, et al. Antibacterial effect of human mesenchymal stem cells is mediated in part from secretion of the antimicrobial peptide LL-37[J]. Stem Cells (Dayton, Ohio), 2010,28(12):2229-2238.
[27]KORDELAS L, REBMANN V, LUDWIG A K, et al. MSC-derived exosomes: a novel tool to treat therapy-refractory graft-versus-host disease[J]. Leukemia, 2014,28(4):970-973.
(本文編辑 黄建乡)
[收稿日期]2019-11-04; [修订日期]2020-02-25
[基金项目]山东省自然科学基金面上项目(ZR2014HM113)
[第一作者]刘永娟(1987-),女,硕士研究生。
[通信作者]冷向锋(1976-),男,博士,副主任医师。E-mail:Lxfzqcn@163.com。

