瘦素对人脑血管平滑肌细胞活性及ROS表达的影响
李阳阳 王晓雪 张峰菊 许宏侠 刘欣欣

[摘要] 目的 探讨瘦素对人脑血管平滑肌细胞(HBVSMCs)活性及活性氧(ROS)表达水平的影响。
方法体外培养HBVSMCs,使用不同浓度瘦素干预HBVSMCs,采用CCK-8法检测瘦素对细胞增殖活性的影响,蛋白免疫印迹(Western blot)检测细胞中增殖细胞核抗原(PCNA)和Ki-67的表达水平,流式细胞术检测瘦素对细胞周期的影响,DCFH-DA探针法检测细胞内ROS水平。
结果 CCK-8检测显示,不同浓度瘦素处理组培养48和72 h后HBVSMCs的增殖活性明显升高(F=117.818、160.349,P<0.001);Western blot检测显示,不同浓度瘦素处理组培养48 h后HBVSMCs中PCNA和Ki-67的表达水平明显上调(F=290.000、898.769,P<0.001);流式细胞术检测显示,不同浓度瘦素处理组G0/G1期细胞比例降低(F=264.180,P<0.001),S期和G2/M期细胞比例升高(F=160.033、380.234,P<0.001);DCFH-DA探针法检测显示,不同浓度瘦素处理组HBVSMCs內ROS水平明显升高(F=394.025,P<0.001);以上各指标变化均具有浓度依赖性。
结论 瘦素能够促进HBVSMCs的增殖活性,并诱导细胞中ROS的表达。
[关键词] 瘦素;肌细胞,平滑肌;细胞增殖;活性氧;颅内动脉硬化
[中图分类号] R977.1;R329.24
[文献标志码] A
[文章编号] 2096-5532(2020)03-0270-05
doi:10.11712/jms.2096-5532.2020.56.105
[开放科学(资源服务)标识码(OSID)]
[网络出版] http://kns.cnki.net/kcms/detail/37.1517.R.20200528.0935.004.html;2020-05-28 12:03
EFFECT OF LEPTIN ON THE ACTIVITY OF HUMAN BRAIN VASCULAR SMOOTH MUSCLE CELLS AND THE EXPRESSION OF REACTIVE OXYGEN SPECIES
\ LI Yangyang, WANG Xiaoxue, ZHANG Fengju, XU Hongxia, LIU Xinxin
\ (Department of Geriatric Neurology, the First Affiliated Hospital of Henan University, Kaifeng 475000, China)
[ABSTRACT]\ Objective\ To investigate the effect of leptin on the activity of human brain vascular smooth muscle cells (HBVSMCs) and the expression of reactive oxygen species (ROS).
\ Methods\ HBVSMCs were cultured in vitro and then treated with different concentrations of leptin. CCK-8 assay was used to observe the effect of leptin on the proliferative activity of cells; Western blot was used to measure the expression of proliferating cell nuclear antigen (PCNA) and Ki-67; flow cytometry was used to observe the effect of leptin on cell cycle; the DCFH-DA probe method was used to measure the level of ROS in cells.
\ Results
The results of CCK-8 assay showed that HBVSMCs treated with different concentrations of leptin had a significant increase in proliferative activity after 48 and 72 hours of culture (F=117.818,160.349;P<0.001). The results of Western blot showed that HBVSMCs treated with different concentrations of leptin had significantly upregulated expression of PCNA and Ki-67 after 48 hours of culture (F=290.000,898.769;P<0.001). The results of flow cytometry showed that HBVSMCs treated with different concentrations of leptin had a significant reduction in the proportion of cells in G0/G1 phase (F=264.180,P<0.001) and a significant increase in the proportion of cells in S phase or G2/M phase (F=160.033,380.234;P<0.001). The results of the DCFH-DA probe method showed that HBVSMCs treated with different concentrations of leptin had a significant increase in the level of ROS (F=394.025,P<0.001). All the changes above were concentration-dependent.
\ Conclusion\ Leptin can promote the proliferative activity of HBVSMCs and induce the expression of ROS in cells.
[KEY WORDS]\ leptin; myocytes, smooth muscle; cell proliferation; reactive oxygen species; intracranial arteriosclero
心腦血管疾病具有高发病率和高死亡率的特点,是全世界威胁人类健康的重要原因之一[1]。过去20年来,中国心脑血管疾病死亡率急剧上升[2]。心脑血管疾病的主要病因之一是动脉粥样硬化,大量研究显示,高脂血症、高血压及糖尿病等多种因素与动脉粥样硬化的发病密切相关[3-4]。瘦素是由肥胖基因编码的蛋白类激素,能够调节机体多种生理功能[5]。多项研究表明,瘦素具有多种致动脉粥样硬化的作用[6-7]。目前研究已证实,活性氧(ROS)能够加速动脉粥样硬化的发生发展[8]。然而,瘦素是否能够通过调控ROS水平在动脉粥样硬化过程中发挥作用的研究报道甚少。因此,本实验以人脑血
管平滑肌细胞(HBVSMCs)为研究对象,探究瘦素对HBVSMCs细胞活性及ROS水平的影响,为临床上治疗动脉粥样硬化及心脑血管疾病提供理论依据。现将结果报告如下。
1 材料与方法
1.1 细胞及试剂
HBVSMCs由四川大学华西医院转化医学中心提供;重组人瘦素由美国Preprotech公司提供;DMEM高糖培养基、青霉素-链霉素双抗均购自美国Hyclone公司;胎牛血清(FBS)购自美国Gibco公司;CCK-8检测试剂购自日本同仁化学研究所;增殖细胞核抗原(PCNA)和Ki-67抗体及辣根过氧化酶标记的二抗盒购自美国Santa Cruz公司;BCA蛋白浓度检测试剂盒购自北京天根生化科技有限公司;超敏ECL化学发光试剂盒购自北京普利莱基因技术有限公司;细胞周期检测试剂盒购自南京凯基科技发展有限公司;ROS检测试剂盒购自上海碧云天生物技术研究所。
1.2 细胞培养与处理
HBVSMCs复苏后,培养在含有体积分数0.10 FBS、100 mg/L青霉素-链霉素的DMEM高糖培养基中,放置在含体积分数0.05 CO2、37 ℃恒温培养箱中,每2 d更换1次新的培养液,细胞贴壁生长,待细胞融合达90%时以胰蛋白酶消化传代。取对数生长期的HBVSMCs以胰酶消化,并接种至6孔板中,当细胞单层融合时除去旧培养液,更换成含不同浓度(0、10、100、1 000 μg/L)瘦素的培养液进行培养,将含0 μg/L瘦素的培养液培养的HBVSMCs作为对照组(A组),分别将含10、100、1 000 μg/L瘦素的培养液培养的HBVSMCs作为瘦素低、中、高浓度组(B、C、D组)。各组HBVSMCs作用48 h后进行相关指标检测。
1.3 检测指标和方法
1.3.1 CCK-8法检测细胞增殖活性 取对数生长期的HBVSMCs,用胰酶消化后接种到96孔板中,分组并处理24、48和72 h,每组的每个时间点设置5个复孔。分别向各孔细胞中加20 μL的CCK-8溶液,将细胞培养板放置在37 ℃培养箱继续孵育1 h,应用酶标仪分别测定各组细胞450 nm波长处光密度值(OD值)。实验重复3次,取均值,以OD值表示细胞增殖活性。
1.3.2 Western blot检测细胞中PCNA和Ki-67蛋白表达水平 收集处理48 h后各组HBVSMCs,加入细胞裂解液在冰上提取总蛋白,采用BCA蛋白浓度检测试剂盒测定蛋白浓度。在蛋白中加入适量上样缓冲液,在沸水浴中加热变性,取等量蛋白样品上样,行SDS-PAGE电泳,待溴酚蓝到达浓缩胶底部断开电源,将蛋白转印至PVDF膜上,将膜放置在含50 g/L脱脂奶粉的封闭液中孵育1 h。TBST洗膜后加入相应一抗,PCNA和Ki-67一抗均为1∶1 000稀释,4 ℃过夜孵育;TBST洗膜后加入1∶3 000稀释的二抗,室温孵育2 h。TBST洗膜后加入超敏ECL化学发光试剂,显影后在凝胶成像系统中拍照,采用Image J软件处理图像,以β-actin为内参照,分别分析各组HBVSMCs中PCNA和Ki-67蛋白的相对表达水平。每组设置3个复孔,实验重复3次。
1.3.3 流式细胞术检测细胞周期 瘦素处理48 h后,各组HBVSMCs以胰酶消化,离心收集细胞,加入预冷PBS重悬细胞,洗涤细胞2次,向细胞中加入1 mL预冷的体积分数0.70乙醇溶液,4 ℃固定24 h,PBS洗涤细胞后加入500 μL染色缓冲液重悬细胞,再向细胞悬液中加入PI染液25 μL、RNase A 10 μL,37 ℃避光染色30 min。使用流式细胞仪检测细胞,以Modfit软件分析各组HBVSMCs周期。每组设置3个复孔,实验重复3次。
1.3.4 DCFH-DA探针法检测细胞内ROS水平
各组HBVSMCs处理48 h后收集细胞,严格按照ROS检测试剂盒说明书要求测定细胞内ROS水平,即将DCFH-DA荧光染料以无血清培养液稀释成10 μmol/L工作液浓度,加入到收集的细胞中混匀,放置在细胞培养箱避光孵育1 h,反应结束后以培养液洗涤细胞。使用流式细胞仪测定荧光强度,激发光波长为488 nm,发射光波长为525 nm,以荧光强度表示ROS水平。每组设置3个复孔,实验重复3次。
1.4 统计学分析
采用SPSS 21.0统计学软件对实验数据进行统计分析,计量资料数据均用±s表示,多组间差异比较采用单因素设计的方差分析,两组间差异比较采用SNK-q检验分析。以P<0.05表示差异具有统计学意义。
2 结果
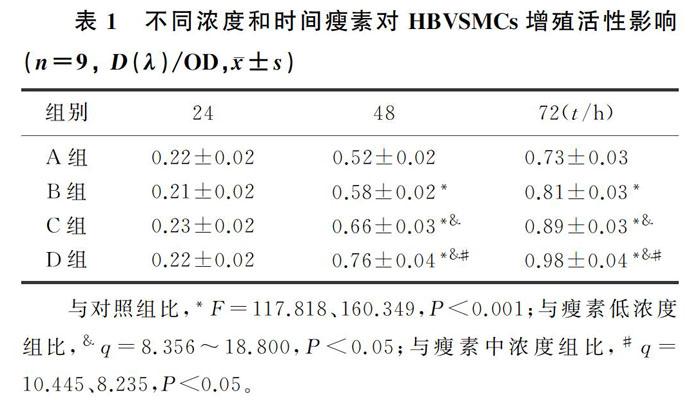
2.1 瘦素对HBVSMCs增殖活性的影響
CCK-8检测结果显示,与对照组比较,瘦素低、中、高浓度组HBVSMCs活性在处理48和72 h时均明显升高(F=117.818、160.349,P<0.001);与瘦素低浓度组相比较,瘦素中、高浓度组HBVSMCs活性在处理48和72 h时均明显升高(q=8.356~18.800,P<0.05);与瘦素中浓度组比较,瘦素高浓度组HBVSMCs活性在处理48和72 h时均明显升高(q=10.445、8.235,P<0.05);在瘦素处理24 h时各组HBVSMCs活性比较,差异无统计学意义(P>0.05)。见表1。
与对照组比,*F=117.818、160.349,P<0.001;与瘦素低浓度组比,&q=8.356~18.800,P<0.05;与瘦素中浓度组比,#q=10.445、8.235,P<0.05。
2.2 瘦素对HBVSMCs中PCNA和Ki-67表达的影响
Western blot检测结果显示,与对照组比较,瘦素低、中、高浓度组HBVSMCs中PCNA和Ki-67的表达水平明显上调(F=290.000、898.769,P<0.001);与瘦素低浓度组相比较,瘦素中、高浓度组HBVSMCs中PCNA和Ki-67的表达水平明显上调(q=13.064~52.842,P<0.05);与瘦素中浓度组比较,瘦素高浓度组HBVSMCs中PCNA和Ki-67的表达水平均明显上调(q=17.146、26.901,P<0.05)。见图1。
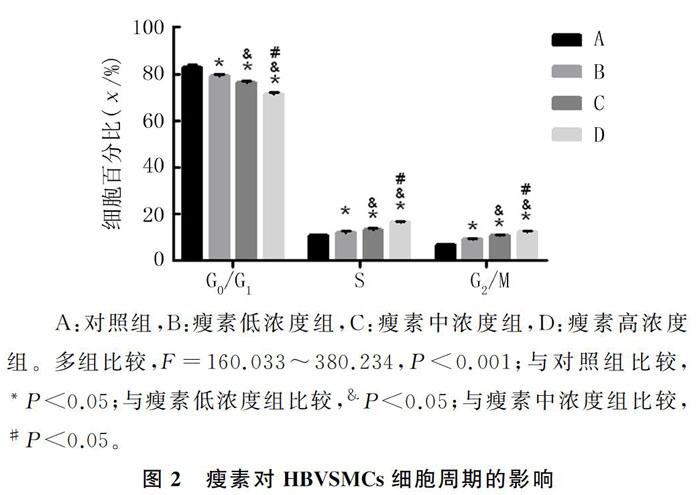
2.3 瘦素对HBVSMCs细胞周期进程的影响
流式细胞术检测结果显示,与对照组相比较,瘦素低、中、高浓度组G0/G1期细胞百分比明显降低(F=264.180,P<0.05),S期和G2/M期细胞百分比明显升高(F=160.033、380.234, P<0.05);与瘦素低浓度组相比较,瘦素中、高浓度组G0/G1期细胞百分比明显降低(q=10.091、25.696, P<0.05),S期和G2/M期细胞百分比均明显升高(q=5.838~26.203,P<0.05);与瘦素中浓度组比较,瘦素高浓度组G0/G1期细胞百分比明显降低(q=15.605,P<0.05),S期和G2/M期细胞百分比明显升高(q=11.530、16.507,P<0.05)。见图2。
2.4 瘦素对HBVSMCs内ROS水平的影响
DCFH-DA探针法检测结果显示,对照组、瘦素低浓度组、瘦素中浓度组、瘦素高浓度组ROS水平分别为13.25±1.16、17.33±1.46、35.49±3.86和67.88±6.18。与对照组相比较,瘦素低、中、高浓度组HBVSMCs内ROS水平明显升高(F=394.025,P<0.001);与瘦素低浓度组比较,瘦素中、高浓度组HBVSMCs内ROS水平明显升高(q=14.487、40.326,P<0.05);与瘦素中浓度组相比较,瘦素高浓度组HBVSMCs内的ROS水平明显升高(q=25.839,P<0.05)。
3 讨论
动脉粥样硬化引起的心脑血管疾病是全世界人类最主要的死亡原因,目前已成为全球性公共卫生问题[9]。近年来,随着人类生活习惯的改变、生活水平的提高以及饮食结构的改变,动脉粥样硬化引起的心脑血管疾病的发病率呈逐年上升的趋势。动脉粥样硬化的发病机制极其复杂,多项研究结果表明,内皮损伤炎症反应是造成动脉粥样硬化的主要原因[10-12]。
血管平滑肌细胞的过度增殖能够导致血管壁发生病理变化,造成血管内膜损伤,促进动脉粥样硬化的发生[13]。瘦素是一类广泛分布在体内的多肽类,由脂肪组织分泌,参与调节多种心脑血管疾病的发生和发展[14]。报道指出,瘦素能够上调人和小鼠主动脉平滑肌细胞中血小板反应蛋白-1(TSP-1)的表达,促进动脉粥样硬化的发生[15]。近期已有研究结果显示,瘦素能够促进大鼠血管平滑肌细胞增殖并抑制细胞凋亡,在冠状动脉粥样硬化性心脏病中发挥作用[16]。本实验采用不同浓度的瘦素干预HBVSMCs,CCK-8检测显示,瘦素能够呈浓度依赖性地促进HBVSMCs的增殖活性,这与以往关于瘦素促进血管平滑肌细胞增殖的结果相符[17-19]。此外,本实验还通过Western blot检测HBVSMCs中PCNA和Ki-67表达水平,研究结果显示,PCNA和Ki-67的表达水平均随瘦素干预浓度的升高而上调。PCNA和Ki-67作为增殖细胞核抗原,是反映细胞处于增殖状态的指标[20]。本文结果提示,瘦素通过上调PCNA和Ki-67的表达促进HBVSMCs的增殖活性。流式细胞术检测结果表明,瘦素能够降低G0/G1期细胞比例,提高S期和G2/M期细胞比例。这说明经瘦素处理后,HBVSMCs进入S期和G2/M期的细胞增多,细胞增殖加快,提示瘦素能够加快HBVSMCs周期进程来促进细胞增殖。这与周伟强等[21]的瘦素能促进乳癌MDA-MB-231细胞周期进程的结果相符。
近年来,越来越多的研究结果表明氧化应激在动脉粥样硬化发生和发展中发挥着关键作用[22-24]。ROS是氧化应激启动的关键因子,当体内积累过多的ROS时将导致机体氧化与抗氧化的失衡,最终引起氧化应激反应。研究结果显示,氧化应激可通过两方面诱发动脉粥样硬化的形成:一方面是通过氧化作用对细胞内蛋白质、核酸等物质产生毒害作用,影响大分子物质的生物功能;另一方面是通过激活相应的信号通路引起血管结构和功能的破坏[25]。目前研究结果显示,瘦素在乳房健康和恶性腺上皮细胞中通过NADPH氧化酶5诱导ROS的产生,激活细胞内氧化应激反应[26]。本实验通过DCFH-DA探针法检测瘦素干预对HBVSMCs内ROS水平的影响,结果显示,瘦素能够呈浓度依赖性地诱导ROS的表达。这与先前的研究结果相符[27-29]。如YU等[30]研究结果显示,瘦素能够诱导大鼠血管平滑肌细胞增殖及细胞内ROS的产生,诱导动脉粥样硬化的发生,该过程能够被熊果酸抑制。还有研究结果显示,瘦素可能通过提高细胞内ROS的产生,参与高血压动脉粥样硬化血管重构过程[31]。这些研究提示,瘦素可能通过上调细胞内ROS水平参与动脉粥样硬化的进展。
综上所述,瘦素能够促进HBVSMCs增殖活性并促进细胞内ROS的产生。本实验为进一步探究瘦素在动脉粥样硬化中的作用提供实验基础。本研究初步探究瘦素对HBVSMCs增殖活性、周期进程及ROS表达的影响,但未对其作用机制进行探究,后续实验将对其补充。并且瘦素对HBVSMCs凋亡、侵袭和迁移等生物学行为是否存在影响尚不清楚,因此后续实验也将对此进行探究。
[参考文献]
[1]CHAMBERLAIN J J, JOHNSON E L, LEAL S, et al. Car-
diovascular disease and risk management:review of the American diabetes association standards of medical care in diabetes 2018[J]. Annals of Internal Medicine, 2018,168(9):640-650.
[2]SANTOS C Y, SNYDER P J, WU W C, et al. Pathophysiologic relationship between Alzheimers disease, cerebrovascular disease, and cardiovascular risk: a review and synthesis [J]. Alzheimers Dement (Amst), 2017,7:69-87.
[3]杨兵,林爱琴,罗晓华,等. 不同严重程度冠心病患者外周血Treg和Th17细胞的测定[J]. 郑州大学学报(医学版), 2018,53(5):658-661.
[4]KISIEL B, KRUSZEWSKI R, JUSZKIEWICZ A, et al. Common atherosclerosis genetic risk factors and subclinical atherosclerosis in rheumatoid arthritis: the relevance of disease duration[J]. Rheumatology International, 2019,39(2):327-336.
[5]ABELLA V, SCOTECE M, CONDE J, et al. Leptin in the interplay of inflammation, metabolism and immune system disorders[J]. Nature Reviews Rheumatology, 2017,13(2):100-109.
[6]VELLA C A, CUSHMAN M, VAN H B, et al. Associations of abdominal muscle area and radiodensity with adiponectin and leptin:the multiethnic study of atherosclerosis[J]. Obesity, 2018,26(7):1234-1241.
[7]胡迪聃,徐彤彤. 瘦素抵抗與高血压左室肥厚及动脉粥样硬化的相关性[J]. 广东医学, 2017,38(10):1519-1522,1527.
[8]YANG H, KORIVI M, CHEN C, et al. Antrodia camphorata attenuates cigarette smoke-induced ROS production,DNA damage, apoptosis, and inflammation in vascular smooth muscle cells, and atherosclerosis in ApoE-deficient mice[J]. Environmental Toxicology, 2017,32(6):2070-2084.
[9]MARTIN S S, DAYA N, LUTSEY P L, et al. Thyroid function,cardiovascular risk factors,and incident atherosclerotic cardiovascular disease: the atherosclerosis risk in communities (ARIC) study[J]. Journal of Clinical Endocrinology & Meta-
bolism, 2017,102(9):3306-3315.
[10]谢岩,任志文,赵冬. miR-125b在颈动脉粥样硬化患者外周血单个核细胞中的表达及其对血管平滑肌细胞增殖和迁移的影响[J]. 郑州大学学报(医学版), 2017,52(3):295-299.
[11]PENG Z, SHU B, ZHANG Y, WANG M. Endothelial response to pathophysiological stress[J]. Arterioscler Thromb Vasc Biol. 2019,39(11):e233-e243.
[12]XIAO Y, XIA J, CHENG J, et al. Inhibition of S-adenosylhomocysteine hydrolase induces endothelial dysfunction via epigenetic regulation of p66shc-mediated oxidative stress pathway[J]. Circulation. 2019,139(19):2260-2277.
[13]WANG D D, UHRIN P, MOCAN A, et al. Vascular smooth muscle cell proliferation as a therapeutic target. Part 1: mole-
cular targets and pathways[J]. Biotechnology Advances, 2018,36(6, SI):1586-1607.
[14]LEI W, SUN D L. Leptin receptor gene polymorphism and the risk of cardiovascular disease:a systemic review and Meta-analysis[J]. International Journal of Environmental Research & Public Health, 2017,14(4):375-386.
[15]SAHU S, GANGULY R, RAMAN P, et al. Leptin augments recruitment of IRF-1 and CREB to thrombospondin-1 gene promoter in vascular smooth muscle cells in vitro[J]. American Journal of Physiology. Cell Physiology, 2016,311(2): C212-C224.
[16]王丽,方天富,郭宝亮,等. 瘦素对大鼠主动脉血管平滑肌细胞增殖和凋亡的影响[J]. 中华老年心脑血管病杂志, 2018,20(7):760-761.
[17]WATANABE K, SUZUKAWA M, ARAKAWA S, et al. Leptin enhances cytokine/chemokine production by normal lung fibroblasts by binding to leptin receptor[J]. Allergol Int, 2019,68S:S3-S8.
[18]JIANG Z, ZHOU J, LI T, et al. Hepatic deficiency of Poldip2 in type 2 diabetes dampens lipid and glucose homeostasis[J]. Metabolism. 2019,99:90-101.
[19]ALBADRANI M, SETH R K, SARKAR S, et al. Exogenous PP2A inhibitor exacerbates the progression of nonalcoholic fatty liver disease via NOX2-dependent activation of miR21[J]. Am J Physiol Gastrointest Liver Physiol, 2019,317(4):G408-G428.
[20]MOLINAFRECHERO N. Comparison of the value of PCNA and Ki-67 as markers of cell proliferation in ameloblastic tumors[J]. Medicina Oral Patologia Oral Y Cirugia Bucal, 2013,18(2): e174-e179.
[21]周偉强. 瘦素调控乳腺癌MDA-MB-231细胞周期进程的研究[J]. 沈阳医学院学报, 2016,18(6):421-425.
[22]NAKANO R, TAKEBE N, ONO M, et al. Involvement of oxidative stress in atherosclerosis development in subjects with sarcopenic obesity[J]. Obesity Science & Practice, 2017,3(2):212-218.
[23]MARCHIO P, GUERRA-OJEDA S, VILA J M, et al. Targeting early atherosclerosis: a focus on oxidative stress and inflammation[J]. Oxid Med Cell Longev, 2019, 2019:8563845.
[24]KHOSRAVI M, POURSALEH A, GHASEMPOURG, et al. The effects of oxidative stress on the development of atherosclerosis[J]. Biol Chem, 2019,400(6):711-732.
[25]郝阳,郭晓辰,张军平. 氧化应激和自噬在动脉粥样硬化中的作用研究新进展[J]. 中国动脉硬化杂志, 2017,25(4):404-410.
[26]MAHBOULI S, DER VARTANIAN A, ORTEGA S, et al. Leptin induces ROS via NOX5 in healthy and neoplastic mammary epithelial cells[J]. Oncology Reports, 2017,38(5):3254-3264.
[27]MENEZES V G, MONTE A, GOUVEIA B B, et al. Effects of leptin on the follicular development and mitochondrial acti-
vity of ovine isolated early antral follicles cultured in vitro[J]. Theriogenology, 2019,138:77-83.
[28]MORAIS T C, ABREU L C, QUENTAL O B, et al. Obesity as an inflammatory agent can cause cellular changes in human milk due to the actions of the adipokines leptin and adiponectin[J]. Cells, 2019,8(6):519.
[29]MAGHERINI F, FIASCHI T, MARZOCCHINI R, et al. Oxidative stress in exercise training: the involvement of inflammation and peripheral signals[J]. Free Radic Res, 2019,53(11-12):1155-1165.
[30]YU Y M, TSAI C C, TZENG Y W, et al. Ursolic acid suppresses leptin-induced cell proliferation in rat vascular smooth muscle cells[J]. Canadian Journal of Physiology & Pharmaco-
logy, 2017,95(7):811-818.
[31]侯麗媛,关雪莲,田嘉莹,等. 瘦素与缺血性脑卒中关系的研究进展[J]. 微量元素与健康研究, 2017,34(2):77-78.
(本文编辑 于国艺)
[收稿日期]2019-10-24; [修订日期]2020-04-17
[第一作者]河南省高等学校重点科研计划项目(18B310013)
[通信作者]李阳阳(1987-),男,硕士。E-mail:lyyglmc@163.com。

