树莓果肉多糖在1型糖尿病大鼠中的免疫调节和抗氧化活性研究
田文慧,杨永晶,2*,吴云,陈薇
1(青海大学 生态环境工程学院,青海 西宁,810016) 2(青海大学省部共建三江源生态与高原农牧业国家重点实验室,青海 西宁,810016)
糖尿病严重威胁人类健康,属于慢性代谢性疾病,胰腺胰岛素分泌不足或对胰岛素不敏感引起的慢性高血糖症是其典型症状。糖尿病一般分为1型和2型2种[1]。1型糖尿病可能发生在任何年龄段,在全球范围内都有分布,由胰岛分泌胰岛素的β细胞的损伤引起[2],并有可能出现严重并发症。多种免疫细胞和促炎细胞因子共同参与了这种复杂的自身免疫应答过程,包括T淋巴细胞、B淋巴细胞、巨噬细胞、树突细胞、TNF-α、IFN-γ、IL等[3]。目前对1型糖尿病的有效治疗仍然有待提高[4]。皮下注射胰岛素只能一定程度地控制1型糖尿病的临床症状,对胰岛β细胞的损伤几乎没有修复作用[5]。而环孢霉素、咪唑硫嘌呤、强的松等广谱免疫抑制剂尽管对于1型糖尿病的治疗有一定效果,但随着治疗时间的增长会产生由免疫抑制引起的一系列副作用[6]。近年来,多糖已成为最主要的天然功能性提取物,是一类具有多种药理活性的生物大分子,包括降血糖[7]、免疫调节[8]、抗氧化[9]、抗菌[10]、抗肿瘤[11]等。例如,从梭柄松苞菇中获得的多糖在STZ诱导的小鼠糖尿病模型中具有显著的降血糖和降血脂活性[12];从桑枝中获得的多糖能使STZ诱导的糖尿病小鼠的血糖下降[13]。所以,植物多糖可能会为有效治疗糖尿病提供新的机会。
树莓(RubusidaeusL.)是蔷薇科多年生灌木,已被多国广泛引种栽培,其品种目前至少有几百个。树莓中含有许多生物活性物质,尤其是多糖含量高。前期研究表明,在青海高原地区引种的树莓果肉中多糖提取率高达 12%(质量分数)。因此,树莓果肉是提取多糖的理想原料。本研究通过建立STZ诱导的糖尿病大鼠模型研究RPP的抗糖尿病活性。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
树莓冷冻果,青海树莓农林产业化有限公司(青海湟源);SD大鼠,甘肃中医学院[动物合格证号:SYXK(甘)2011-0001];格列本脲(glibenclamide)、链脲霉素(streptozotocin,STZ),Sigma-Aldrich有限责任公司(美国);MDA、SOD、GSH-Px试剂盒、大鼠IgA、IgE、IgG、IgM,IL-2、IFN-γ、TNF-α以及CD4和CD8分子ELISA测试盒,南京建成生物工程中心。
1.1.2 仪器与设备
电子天平(ALC-110.4),德国Acculab公司;涡旋混合仪(TD-RS-1),北京同德创业科技有限公司;紫外分光光度计(UV-2802),UNICO;恒温水浴锅(DZKW-D-4),河南郑州南北仪器设备有限公司;纯水仪(UPT),成都超纯科技有限公司;酶标仪(RT-6000),北京裕天医疗技术;冷冻离心机(4-5R),湖南恒诺仪器设备有限公司;血糖测试仪及血糖试纸(三诺),天士力大药房;组织匀浆仪(FSH-2A),金坛市友联仪器研究所;常温离心机(TDL-50C),上海精密科学仪器有限公司。
1.2 实验方法
1.2.1 RPP对正常大鼠体重和血糖的影响
采用杨永晶等的方法提取树莓果肉多糖(raspberry pulp polysaccharide, RPP)[14]。雄性SD大鼠30只,体重170~190 g。先将大鼠在室温20~24 ℃,相对湿度40%~50%的条件下适应性饲养1周。之后随机分成3组,分别为对照组(纯水)、RPP低剂量组(RPP溶液300 mg/kg)和RPP高剂量组(RPP溶液600 mg/kg),每组10只。给药方式均为灌胃,持续给药20 d。观察与测量指标方法如下:(1)每天观察并详细记录各组大鼠的外观体征、行为活动、进食、饮水、病发及死亡情况。(2)每隔5 d测量大鼠体重。(3)尾静脉采血,采用血糖测试仪测定血糖值,每5 d测量1次。
1.2.2 STZ诱导的糖尿病大鼠模型的建立
雄性SD大鼠的饲养方法及条件同上。适应性喂养1周后,大鼠腹腔注射60 mg/kg STZ(STZ溶于新鲜的柠檬酸钠缓冲液(pH 4.5,浓度0.1 mol/L)中,在黑暗条件下使用,以减少降解)。正常对照组大鼠腹腔注射等量柠檬酸钠缓冲液。注射STZ或柠檬酸钠缓冲液72 h后经尾静脉采血,用血糖仪测定血糖。选择血糖浓度超过16.8 mmol/L的大鼠作为糖尿病模型。
1.2.3 RPP对STZ诱导的糖尿病大鼠的影响
将糖尿病大鼠随机分为6组:正常对照组(NC,纯水),模型对照组(MC,等渗盐水),阳性对照组(PC,格列本脲20 mg/kg),RPP低剂量组(LDG,RPP75 mg/kg),RPP中剂量组(MDG,RPP150 mg/kg)和RPP高剂量组(HDG,RPP300 mg/kg),所有大鼠每天灌胃1次,连续处理20 d,每5 d测量1次大鼠血糖并称其体重。治疗20 d后,麻醉大鼠(腹腔注射水合氯醛溶液),经颈动脉插管取血,取血样于4 ℃静置30 min后,并于2 500 r/min离心10 min获取血清样本。取血后将大鼠采用脊椎脱臼法处死,收集胰腺组织样本,其中一部分被保存在体积分数10%的甲醛中用于组织病理学研究,其余部分和血清在-80 ℃保存至分析。
1.2.4 血清CD4、CD8、TNF-α、IFN-γ、IL-2、IgM、IgA、IgE和IgG的测定
根据制造商的说明,使用ELISA试剂盒测定血清中CD4、CD8、TNF-α、IFN-γ、IL-2、IgM、IgA、IgE、IgG的含量。
1.2.5 胰腺组织和血清中的丙二醛、超氧化物歧化酶和谷脘苷肽过氧化物酶的测定
采用组织匀浆仪制备胰腺匀浆,置于低温(pH 7.4, 浓度0.01 mol/L Tris/HCl, 0.000 1 mol/L EDTA-2Na, 0.01 mol/L蔗糖,质量分数0.8% NaCl)中,以5 000×g, 4 ℃离心10 min,收集上清。胰腺组织和血清中丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)的测定由试剂盒按照说明书进行检测。MDA、SOD和GSH-Px的检测波长分别为532 nm、450 nm和412 nm。
1.2.6 组织病理学观察
将体积分数10%甲醛固定后的组织石蜡包埋,切片进行苏木精-伊红(H&E)染色。最后在200倍和400倍放大率下观察并拍摄切片。
1.2.7 数据处理
使用统计学软件SPSS 13.0进行统计学分析,实验统计数据以平均值±标准差(X±SD)表示,多组间均数之间的比较采用单因素方差分析,2组均数之间的比较采用独立样本t检验。P>0.05说明差异不显著;P<0.05说明差异显著;P<0.01说明差异极显著[15]。
2 结果与分析
2.1 RPP对正常大鼠基本体征的影响
各组大鼠毛色光亮,精神状态良好,进食、饮水、排泄等行为活动正常,未见生病及死亡情况。说明RPP对大鼠的基本体征无明显影响。
2.2 RPP对正常大鼠体重的影响
如表1所示,连续灌胃20 d,各组大鼠的体重均稳步增长。实验结束时(20 d),RPP高、低剂量组的大鼠体重与正常组相比均无显著性差异。说明RPP在300~600 mg/kg浓度下对正常大鼠体重无明显影响,毒性小。
2.3 RPP对正常大鼠血糖的影响
如表2所示,连续灌胃20 d,各组大鼠的血糖值在实验期间均非常稳定,给药前后的血糖值均无显著性变化。RPP高、低剂量组大鼠的平均血糖值与空白对照组相比均无显著性差异。说明RPP在300~600 mg/kg浓度下对正常大鼠的血糖无显著影响。
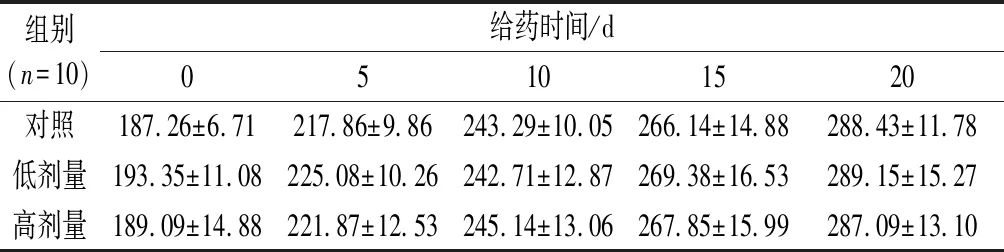
表1 RPP对正常大鼠体重的影响 单位:g
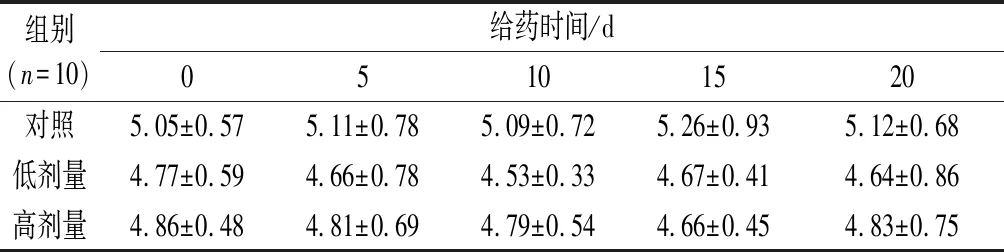
表2 RPP对正常大鼠血糖的影响 单位:mmol/L
2.4 RPP对STZ所致糖尿病大鼠基本体征的影响
经STZ灌胃后各组糖尿病大鼠的体重明显下降(P<0.05 vs. 正常组),垫料比较潮湿。正常大鼠毛色光泽,垫料干燥,20 d内体重呈上升趋势(见图1正常)。模型组大鼠毛发干燥,并伴有轻度脱毛现象,垫料潮湿,体重持续下降(见图1模型),最后一天测量的大鼠体重明显下降(P<0.05 vs. 正常组)。经RPP治疗后,糖尿病大鼠体重下降以剂量依赖的方式得到有效逆转(见图1)。其中,RPP低剂量组最后一天测得的大鼠体重相对模型组来说有明显的增长(P<0.05 vs. 模型组),RPP中、高剂量组最后一天测量的大鼠体重增长极显著(P<0.01 vs. 模型组)。说明RPP能有效缓解糖尿病所致的体重下降情况,且在一定范围内缓解程度随着多糖浓度的增加而加强。值得注意的是阳性对照药格列本脲对糖尿病大鼠体重的急剧下降几乎没有缓解,反而随着给药时间的延长,大鼠体重一直在下降。RPP中剂量组最后一天测量的大鼠体重相对于阳性对照组来说有明显的增长(P<0.05 vs. 阳性对照组),RPP高剂量组最后一天测量的大鼠体重与阳性对照组相比增长极显著(P<0.01 vs. 阳性对照组)。RPP处理组大鼠的体重与正常大鼠相比虽然仍具有显著性差异,但由图1可以看出,RPP高剂量组能较为稳定地维持患病大鼠的体重,这说明RPP维持糖尿病大鼠体重的作用优于格列本脲。

图1 RPP对糖尿病大鼠体重的影响
Fig.1 Effects of RPP on body weight of diabetic rats
注:##P<0.01 vs. 正常组;*P<0.05,**P<0.01 vs. 模型组;△P<0.05,△△P<0.01 vs. 阳性对照组
2.5 RPP对STZ所致糖尿病大鼠血糖的影响
如图2所示,造模后治疗开始前(-5 d),正常大鼠的血糖浓度平稳维持在5 mmol/L,各组糖尿病大鼠的血糖浓度均在25 mmol/L左右,且各组大鼠的平均血糖浓度不存在显著性差异。RPP或格列本脲治疗后,糖尿病大鼠血糖升高受到抑制。RPP各组和阳性对照组大鼠的平均血糖浓度与模型组相比均有极显著性的下降(P<0.01 vs. 模型组)。其中,RPP的降血糖效果随着多糖浓度和给药天数的增加而增强。虽然给药最后一天经RPP处理的各组大鼠的血糖与正常组相比依然存在显著性差异,但RPP高剂量组大鼠的血糖值比阳性对照组的还要低,RPP中剂量组大鼠的血糖值与阳性对照组的相当,这说明高、中剂量RPP的降血糖作用与格列本脲相当,如果延长治疗时间RPP的降血糖作用甚至有可能会优于格列本脲。
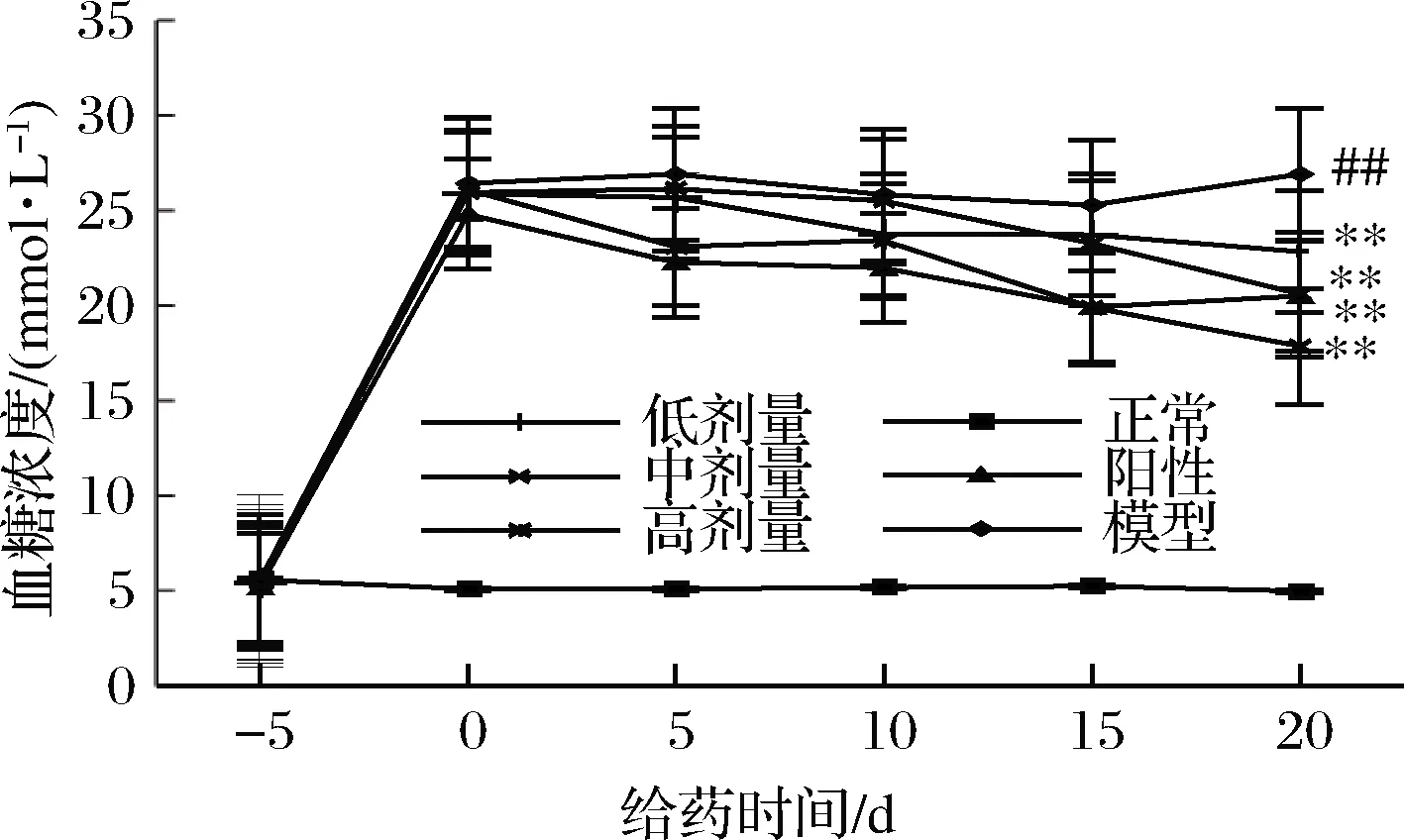
图2 RPP对糖尿病大鼠血糖的影响
Fig.2 Effects of RPP on blood glucose of diabetic rats
注:##P<0.01 vs. 正常组;**P<0.01 vs. 模型组
2.6 RPP对STZ所致的糖尿病大鼠血清中CD4、CD8分子的影响
如图3所示,模型组大鼠血清中CD4和CD8分子的浓度较正常组极显著升高(P<0.01 vs. 正常组)。经过RPP治疗,糖尿病大鼠血清中CD4分子的浓度明显下降(P<0.05 vs. 模型组),CD8分子的浓度较模型组则极显著下降(P<0.01 vs. 模型组)。与正常组相比,RPP低剂量组大鼠血清中的CD4分子浓度和RPP高剂量组大鼠血清中的CD8分子无显著差异。而格列本脲对大鼠血清中CD4和CD8分子浓度的急剧升高无明显缓解作用。

图3 RPP对糖尿病大鼠血清中CD4和CD8分子的影响
Fig.3 Effects of RPP on CD4 and CD8 in serum of diabetic rats
注:▲P>0.05,##P<0.01 vs. 正常组;*P<0.05,**P<0.01 vs. 模型组(下同)
2.7 RPP对STZ所致的糖尿病大鼠血清中细胞因子的影响
由图4可以看出,模型组大鼠血清中IL-2、TNF-α和IFN-γ的含量较正常大鼠急剧增加(P<0.01 vs.正常组)。而RPP可降低IL-2、TNF-α和IFN-γ的含量,高、低剂量的RPP都可使糖尿病大鼠血清中的IL-2、TNF-α和IFN-γ有显著或极显著的下降(P<0.05,P<0.01 vs. 模型组)。与正常组相比,高、低剂量RPP组的TNF-α含量没有显著差异(P>0.05 vs. 正常组)。而格列本脲对糖尿病大鼠血清中TNF-α、IFN-γ和IL-2的升高无明显抑制作用。
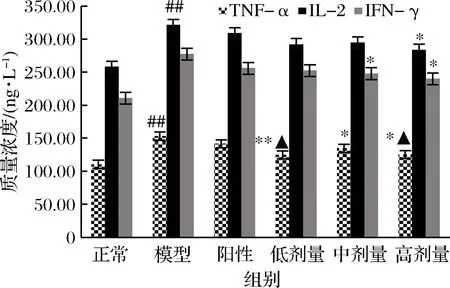
图4 RPP对糖尿病大鼠血清中IL-2、TNF-α和IFN-γ 含量的影响
Fig.4 Effects of RPP on the concentrations of TNF-α, IFN-γ and IL-2 in serum of diabetic rats
2.8 RPP对STZ所致的糖尿病大鼠血清中免疫球蛋白的影响
各组大鼠血清中4种免疫球蛋白的含量如图5所示。可以看出模型组大鼠血清中4种免疫球蛋白含量急剧升高,与正常大鼠相比具有极显著差异(P<0.01 vs. 正常组)。RPP能明显降低糖尿病大鼠血清中4种免疫球蛋白的含量。RPP低、中、高剂量组糖尿病大鼠血清中IgA、IgE、IgG和IgM的浓度与模型组相比具有显著或极显著的下降(P<0.05,P<0.01 vs. 模型组),与正常组相比无明显差异(P>0.05 vs. 正常组)。阳性对照组大鼠血清中IgA、IgE、IgG和IgM的含量与模型组相比均无明显改变。
2.9 RPP对STZ所致的糖尿病大鼠血清中SOD、GSH-Px和MDA的影响
GSH-Px是一种能特异地催化H2O2和GSH反应生成H2O及氧化型谷胱甘肽的酶[16],可以保持细胞膜结构和功能的完整性。如图6所示,STZ可使大鼠血清中的SOD和GSH-Px活性明显下降(P<0.05 vs. 正常组),而MDA的含量极显著性地上升(P<0.01 vs. 正常组)。在格列本脲或RPP的作用下,糖尿病大鼠血清中SOD和GSH-Px的活性都有了显著提高, MDA的含量极显著下降(P<0.05,P<0.01 vs. 模型组)。RPP的作用随着多糖浓度的增加而加强。而且RPP中、高剂量组糖尿病大鼠血清中MDA含量和SOD活性与正常组相比无显著性差异(P>0.05 vs. 正常组)。此外,RPP中、高剂量组糖尿病大鼠血清中的SOD活性都显著高于阳性对照组(P<0.05 vs. 阳性对照组),RPP高剂量组糖尿病大鼠血清中的GSH-Px的活性显著高于阳性对照组(P<0.05 vs. 阳性对照组)。
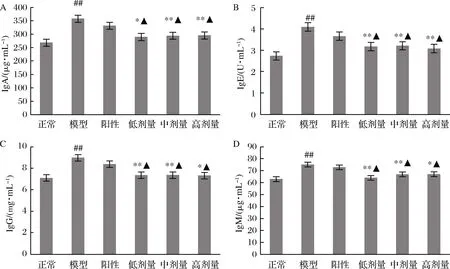
A-IgA;B-IgE;C-IgG;D-IgM
图5 RPP对糖尿病大鼠血清中IgA、IgE、IgG和IgM含量的影响
Fig.5 Effects of RPP on the concentration of IgA, IgE, IgG and IgM in serum of diabetic rats

A-GSH-Px;B-MDA;C-SOD
图6 RPP对糖尿病大鼠血清中GSH-Px和MDA、SOD的影响
Fig.6 Effects of RPP on GSH-Px, MDA SOD, in serum of diabetic rats
注:▲P>0.05,##P<0.01 vs. 正常组;*P<0.05,**P<0.01 vs. 模型组;△P<0.05 vs. 阳性对照组
2.10 RPP对STZ所致的糖尿病大鼠胰腺中SOD、GSH-Px和MDA的影响
如图7所示,STZ可使大鼠胰腺中SOD和GSH-Px的活性明显下降,MDA的含量升高(P<0.01 vs.正常组)。格列本脲和RPP干预可显著提高胰腺组织中SOD和GSH-Px的活性,降低MDA含量(P<0.05,P<0.01 vs. 模型组),且RPP的作用随着浓度的增加而加强。高剂量RPP组糖尿病大鼠胰腺中MDA含量、 SOD和GSH-Px活性与正常组相当(P>0.05 vs. 正常组)。此外,中、高剂量的RPP可使糖尿病大鼠胰腺中SOD的活性与阳性对照组相比分别具有显著性差异和极显著性差异(P<0.05,P<0.01 vs. 阳性对照组),高剂量RPP可使糖尿病大鼠胰腺中GSH-Px的活性极显著性提高(P<0.05,P<0.01 vs. 阳性对照组)。
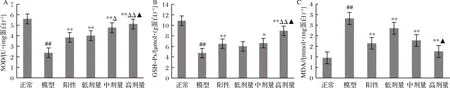
A-SOD;B-GSH-Px;C-MDA
图7 RPP对糖尿病大鼠胰腺中SOD、GSH-Px和MDA的影响
Fig.7 Effects of RPP on SOD, GSH-Px and MDA in pancreas of diabetic rats
注:▲P>0.05,##P<0.01 vs. 正常组;*P<0.05,**P<0.01vs. 模型组;△P<0.05,△△P<0.01 vs.阳性对照组
2.11 RPP对STZ所致的糖尿病大鼠胰腺组织的影响
如图8所示,正常大鼠胰腺切片结构形态规则,大量完整的胰岛β细胞排列均匀。相反,糖尿病模型组胰岛结构严重受损,包括细胞溶解变形、坏死和凋亡,并伴有胰岛β细胞数量急剧下降。格列本脲治疗后,STZ诱导的胰岛损伤较模型对照组有一定程度的恢复。相反,在给予RPP后,随着胰岛β细胞数量的增加,胰岛的病态结构得到了有效的恢复,而且改善优于阳性对照组。其中,RPP组大鼠胰岛的恢复程度与其浓度成正比。
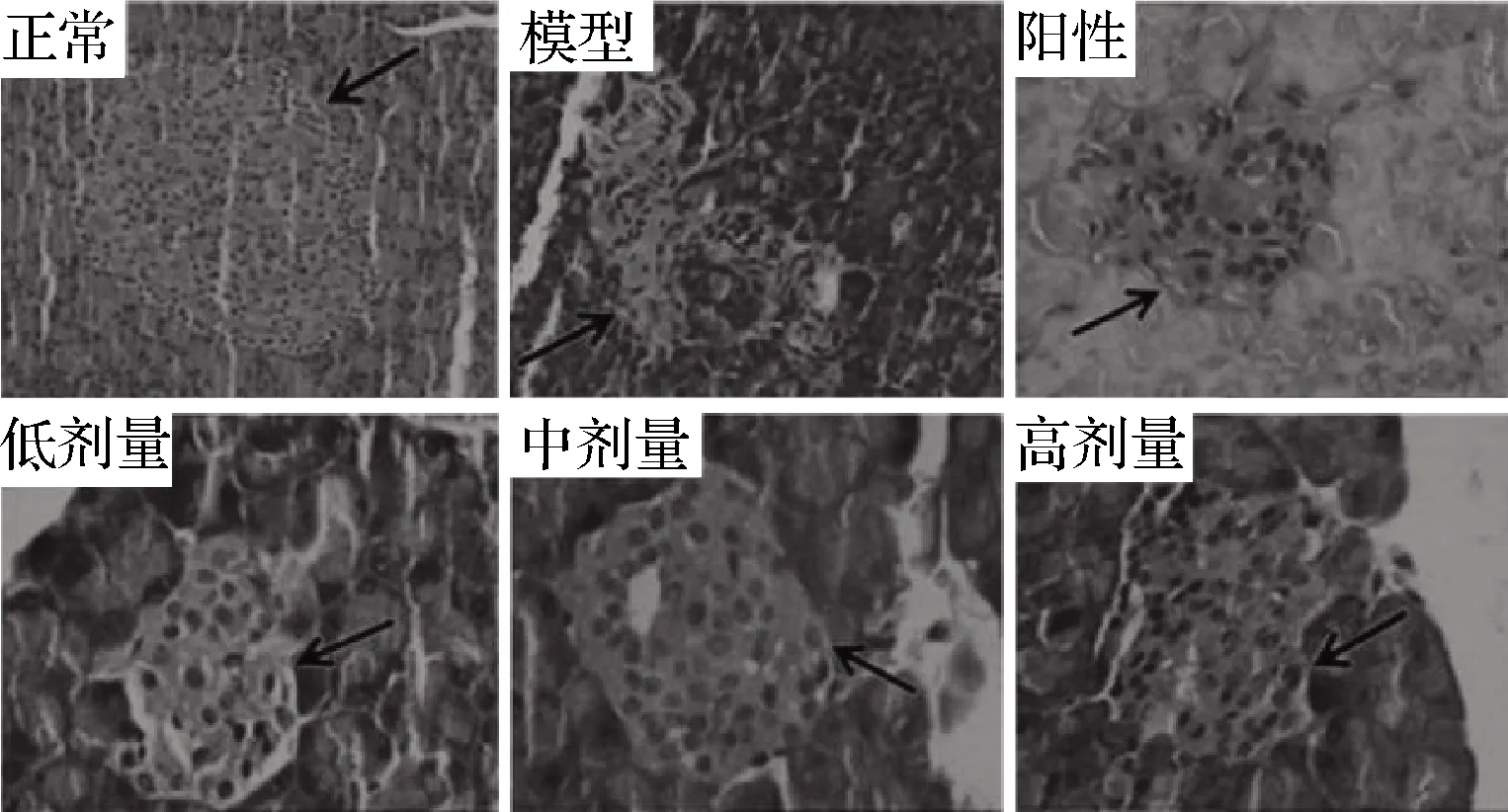
图8 RPP对糖尿病大鼠胰腺组织的影响
Fig.8 Effects of RPP on pancreas in diabetic rats
注:H&E染色;箭头所指为含有β细胞的胰岛;正常和模型组的放大 倍数为200;阳性对照组和RPP低、中、高剂量组的放大倍数为400
3 讨论
本研究采用STZ诱导的糖尿病大鼠模型,观察RPP对1型糖尿病大鼠的影响。STZ是一种具有特异性毒素的天然化学物质,靶向哺乳动物胰腺中产生胰岛素的β细胞,并长期用于实验动物1型糖尿病的诱导[17]。1型糖尿病主要临床表现为多饮、多尿、多食、体重减轻,伴有高血糖和高尿糖。在本研究中,我们的发现表明,RPP是一种有效的抗糖尿病成分,具体体现在维持体重,降低显著升高的血糖,恢复严重受损的胰岛。
1型糖尿病是由产生胰岛素的胰腺β细胞被机体的异常自身免疫应答破坏引起的。这是一个非常复杂的过程,在这个过程中,先天和适应性免疫反应都参与其中。目前尚不清楚这种疾病是如何引发的[18]。然而,新的证据表明胰岛细胞的破坏与免疫细胞和炎症因子有关[19]。这些由巨噬细胞和毒性T细胞分泌的促炎细胞因子和自由基是β细胞死亡的介质[20]。因此,阻断炎症因子有利于预防胰岛损伤和控制糖尿病的发展。糖尿病大鼠血清中CD4和CD8分子的浓度显著降低表明RPP可以通过降低CD4和CD8分子浓度减少促炎细胞因子的释放。糖尿病大鼠血清促炎细胞因子TNF-α、IFN-γ和IL-2水平明显高于正常大鼠,提示STZ诱导的糖尿病大鼠炎症反应是逐渐触发的。RPP干预明显降低了糖尿病大鼠TNF-α、IFN-γ和IL-2的上调,提示RPP可减轻STZ诱导的糖尿病大鼠的炎症反应。值得注意的是,RPP虽然降低了糖尿病大鼠TNF-α、IFN-γ和IL-2的产生,但其浓度并不低于正常对照组。这可能是因为免疫系统有自我调节机制来维持自身的平衡,因此,RPP对促炎细胞因子的调节作用是适度的,不会破坏免疫系统的平衡,引起免疫抑制。RPP对糖尿病大鼠血清中的IgA、IgG、IgE和IgM也存在一定的影响。
人们普遍认为自由基诱导发生在炎症过程中。在糖尿病中,自由基是β细胞死亡的介质之一。活性氧基团(reactive oxygen species, ROS)过量引起有害作用,触发细胞损伤的特点是线粒体呼吸紊乱,氧化损伤,甚至老化[21]。过氧化产生的脂质终产物MDA可逐渐积累并损伤细胞膜的结构,导致细胞功能障碍和细胞毒性[22]。然而,作为解毒的主要抗氧化酶,SOD和GSH-Px均能有效地减轻过氧化物损伤,并保持自由基产生与抗氧化防御能力之间的平衡[8,23]。在本研究中,STZ注射液显著降低了糖尿病大鼠血清和胰腺组织中SOD和GSH-Px的活性,增加了MDA的生成。然而,RPP消除了这些异常的抗氧化系统并降低了MDA含量。
4 结论
RPP可以维持糖尿病大鼠的体重,明显降低其血糖浓度,并且可以一定程度上修复糖尿病大鼠受损的胰岛β细胞。RPP还能明显降低糖尿病大鼠血清中免疫相关因子CD4、CD8分子、IFN-α、IL-2、TNF-γ以及IgG、IgA、IgE和IgM的含量。除此之外,RPP能显著提高糖尿病大鼠胰腺和血清中SOD、GSH-Px的活性,并明显降低MDA的含量。综上所述,RPP可以通过减轻免疫反应和氧化应激改善胰岛β细胞的损伤来维持胰腺的代谢功能,显示出了良好的治疗1型糖尿病的活性,具有广阔的开发前景。

