来源于Paenibacillus campinasensis SK13.001的β-环糊精葡萄糖基转移酶在大肠杆菌中的表达和反应条件优化
姚小琳,张涛,江波
(食品科学与技术国家重点实验室(江南大学), 江苏 无锡, 214122)
环糊精葡萄糖基转移酶(cyclodextrin glycosyltransferase,CGTase)是一种典型的淀粉水解酶,该酶的主要工业应用价值在于其高效的转糖苷反应,CGTase的3种转糖苷反应包括环化、耦合、歧化,其活性均显著高于水解反应[1],该酶的独特之处在于其可以通过环化反应将淀粉或淀粉类似物转化为非还原性环状麦芽寡糖[2]。常见的环状麦芽寡糖为含有6、7、8个葡萄糖单元的分子,分别为α-环糊精(α-cyclodextrin,α-CD)、β-CD和γ-CD[3-5]。环糊精分子为外部亲水内部疏水的中空圆筒形立体结构,这使得环糊精能与很多特定大小的疏水性分子或基团形成稳定的包合物,从而改变客体分子的理化性质,因此环糊精在食品、医药、化妆品等很多领域有广泛的应用[6-7]。随着环糊精的广泛应用,生产环糊精的CGT酶的制备已成为当今研究的热点[8]。目前,已发现的能分泌CGT酶的微生物种类很多,大多数为芽孢杆菌属。但通常野生菌所产CGT酶转化淀粉生产环糊精的转化率较低,这与酶的菌种来源以及反应条件相关;包括底物的种类、浓度、加酶量、反应温度及pH等条件[9]。很多研究通过优化培养基的成分和培养条件来提高菌种产酶能力,但由于野生菌本身的调控机制存在很多限制;为了提高菌种的产酶量,可以采用基因工程的手段将CGTase进行异源表达[10]。
目前,只有β-CD实现了工业化生产,但其原料的转化率局限在50%~60%,其他2种环糊精的转化率则更低[11]。本研究将来自于PaenibacilluscampinasensisSK13. 001的β-CGTase基因连接到大肠杆菌表达载体pET-22b(+),获得重组质粒pET-22b(+)/β-CGT,将其转化到EscherichiacoliBL21(DE3)中,并进行摇瓶发酵,测定菌体沉淀中β-CGTase的环化活力,并对该酶转化淀粉生产环糊精的工艺条件进行优化,获得了高效生产环糊精的工艺条件。
1 材料与方法
1.1 菌种与质粒
PaenibacilluscampinasensisSK13.001,保藏于本实验室;克隆宿主大肠杆菌(Escherichiacoli)DH5α、表达宿主菌EscherichiacoliBL21(DE3),生工生物工程(上海)股份有限公司;表达质粒pET-22b(+),本实验室保藏。
1.2 试剂及仪器
可溶性淀粉、玉米淀粉、马铃薯淀粉、木薯淀粉、酵母提取物,胰蛋白胨,国药集团;基因组DNA提取试剂盒、DNA胶回收试剂盒、质粒抽提试剂盒,生工生物工程(上海)股份有限公司;PCR引物,由金唯智(苏州)生物科技有限公司合成;工具酶,TaKaRa(大连)生物有限公司;标准α,β,γ-环糊精,Sigma(上海)公司;其他试剂均为国产分析纯。
A360紫外可见分光光度计,北京普析通用仪器有限责任公司;HS-800D电热恒温水浴锅,上海浦东物理光学仪器厂;GL-10MD高速台式大容量离心机,湖南湘仪集团;高速冷冻离心机,美国Eppendorf有限公司;e2695高效液相色谱仪、RID-10A示差折光检测器,美国沃特世公司;Agilent ZORBAX NH2色谱柱(5 μm, 4.2 mm×250 mm),美国安捷伦公司;蛋白电泳仪、核酸电泳仪、PCR仪,德国伯乐公司产品。
1.3 培养基
LB液体培养基(g/L):酵母提取物5,胰蛋白胨10,NaCl 10;LB固体培养基为LB液体培养基添加10~15 g/L琼脂粉。
TB培养基(g/L):甘油4,胰蛋白胨12,酵母提取物24,K2HPO4·3H2O 16.4,KH2PO42.3。
1.4 实验方法
1.4.1 重组质粒pET-22b(+)的构建与筛选
提取PaenibacilluscampinasensisSK13.001的全基因组DNA,并以此为模板设计引物PCR得到β-CGTase(包括信号肽)目的片段。PCR扩增条件:95 ℃ 3 min,95 ℃ 15 s,55 ℃ 15 s,72 ℃ 120 s,循环34次,72 ℃ 5 min;PCR引物如下:F1(5′-3′): CGCCCATGGATGAAAAGATTTATGAAACTAACAGCCG(正向引物),R1(5′-3′):CCCTCGAGAGGCTGCCAGTTCACATT(反向引物)。2条引物均在酶切位点前加入保护碱基以方便质粒构建。F1,R1分别含有NcoI和XhoI的限制性酶切位点;以F1,R1为引物PCR扩增得到β-CGTase目的片段,将其纯化、回收后采用酶切位点双酶切、酶连的方法连接到含有6个组氨酸标签的大肠杆菌表达载体pET-22b(+)中,构建重组质粒pET-22b(+)/β-CGT,转化到克隆宿主大肠杆菌DH5α感受态细胞中,涂布于LB固体培养基上,筛选阳性克隆子并接种LB液体培养基,37 ℃,200 r/min过夜培养。提取质粒pET-22b(+)/β-CGT进行PCR双酶切验证和测序鉴定。
1.4.2 β-CGTase的诱导表达及鉴定
将验证成功的重组质粒pET-22b(+)/β-CGT转化到E.coliBL21(DE3)感受态细胞中,pET-22b(+)空质粒处理同上作为对照,涂布LB固体培养基筛选阳性克隆子。将鉴定正确的单菌落接种于LB液体培养基中,添加适量的氨苄青霉素,200 r/min,37 ℃培养12 h,以2%接种量接种于50 mL TB培养基中,加入适量的氨苄青霉素,37 ℃,200 r/min,培养2 h后,加入终浓度为0.9 mmol/L的异丙基-β-D-硫代半乳糖苷(IPTG),25 ℃诱导培养34 h,离心收集菌体,加入裂解液超声破碎后收集上清,上清液经过聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electroresis,SDS-PAGE)进行蛋白表达鉴定。SDS-PAGE参照LAEMMLI[12]的方法。
1.4.3 β-CGTase的分离纯化
将菌体沉淀破碎,离心得到的上清液即为粗酶液。粗酶液参照七海生物Ni-NTA亲和层析柱说明书进一步分离纯化,得到纯化的β-CGTase,将纯化后的蛋白经过SDS-PAGE进行蛋白表达鉴定。
1.4.4 环糊精葡萄糖基转移酶环化活力的测定及转化率的计算
β-CGTase活性主要指环化活力。测定方法为用100 mmol/L磷酸盐缓冲液(pH 7.0)配制质量浓度10 g/L淀粉,加热糊化,降温至55 ℃,加入适量的粗酶液,反应10 min,煮沸灭酶,12 000 r/min离心5 min,上清液过0.22 μm滤膜,高效液相色谱法(high performance liquid chromatography,HPLC)测定环糊精含量。单位酶活力(U)定义为1 min生成1 μmol环糊精所需要的酶量。
HPLC色谱条件:Agilent ZORBAX NH2色谱柱;示差折光检测器(RID-10A);流动相为体积分数为65%的乙腈水溶液;柱温30 ℃;流速1 mL/min;进样量10 μL。
环糊精转化率如公式(1)所示:
(1)
1.4.5 重组β-CGTase反应条件优化
1.4.5.1 底物种类对环糊精产量的影响
用100 mmol/L磷酸盐缓冲液(pH 7.0)配制不同种类的质量浓度为30 g/L的底物,包括玉米淀粉、马铃薯淀粉、可溶性淀粉、木薯淀粉,将底物溶液煮沸糊化并不断搅拌,降温后加入3 U/g干淀粉的酶液,55 ℃反应8 h后,沸水浴灭酶,反应液12 000 r/min,离心5 min,上清液过0.22 μm滤膜,HPLC检测产物含量并计算转化率。
1.4.5.2 底物质量浓度对环糊精产量的影响
用100 mmol/L磷酸盐缓冲液(pH 7. 0)配制质量浓度为30、50、70、100 g/L的玉米淀粉,将溶液煮沸糊化并不断搅拌,降温后加入3 U/g干淀粉的酶液,55 ℃反应8 h后,沸水浴灭酶,样品处理同 1.4.5.1。
1.4.5.3 加酶量对环糊精产量的影响
用100 mmol/L磷酸盐缓冲液(pH 7.0)配制质量浓度为30 g/L的玉米淀粉,将淀粉溶液煮沸糊化并不断搅拌,降温后分别加入1、3、5、7、10 U/g淀粉的酶液,55 ℃反应8 h后,沸水浴灭酶,样品处理同1.4.5.1。
1.4.5.4 反应时间对环糊精产量的影响
用100 mmol/L磷酸盐缓冲液(pH 7.0)配制3%的玉米淀粉,将淀粉溶液煮沸糊化并不断搅拌,降温后加入5 U/g干淀粉的酶液,55 ℃下反应,间隔时间取样,沸水浴灭酶,样品处理同1.4.5.1。
2 结果与分析
2.1 重组大肠杆菌BL21/pET-CGT的构建与表达
以来源于PaenibacilluscampinasensisSK13. 001的基因组DNA为模板,PCR扩增得到成熟的CGTase片段,如图1-A所示,长度大小为2 kb左右,将CGTase基因片段采用酶切位点双酶切、酶连的方法连接到表达载体pET-22b(+)中,转化克隆宿主大肠杆菌DH5α感受态细胞中,挑选阳性克隆子,提质粒进行双酶切鉴定,结果如图1-B所示,重组质粒经NcoI和XhoI两个酶切位点进行双酶切验证,显示2条明显的条带,条带大小与预期相符,证明β-CGTase基因成功连接到表达载体pET-22b(+)上。
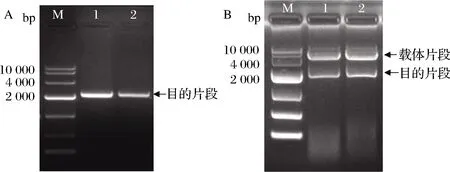
A-基因组DNA的PCR产物;B-重组质粒的双酶切验证
图1 目的片段的PCR结果及重组质粒的酶切验证
Fig.1 PCR results of target fragments and verification of recombinant plasmid digestion
将连接成功的重组质粒转化大肠杆菌表达宿主BL21(DE3)后,进行摇瓶发酵培养,检测发酵液上清液以及菌体沉淀中的酶活,发现上清液中环化活性较低,菌体沉淀破碎后上清液有较高酶活,从图2可以看出随着发酵时间的延长,β-CGTase的环化活力逐渐升高,当诱导培养时间为34 h时,环化活力达到15 U/mL,所以诱导培养时间为34 h。
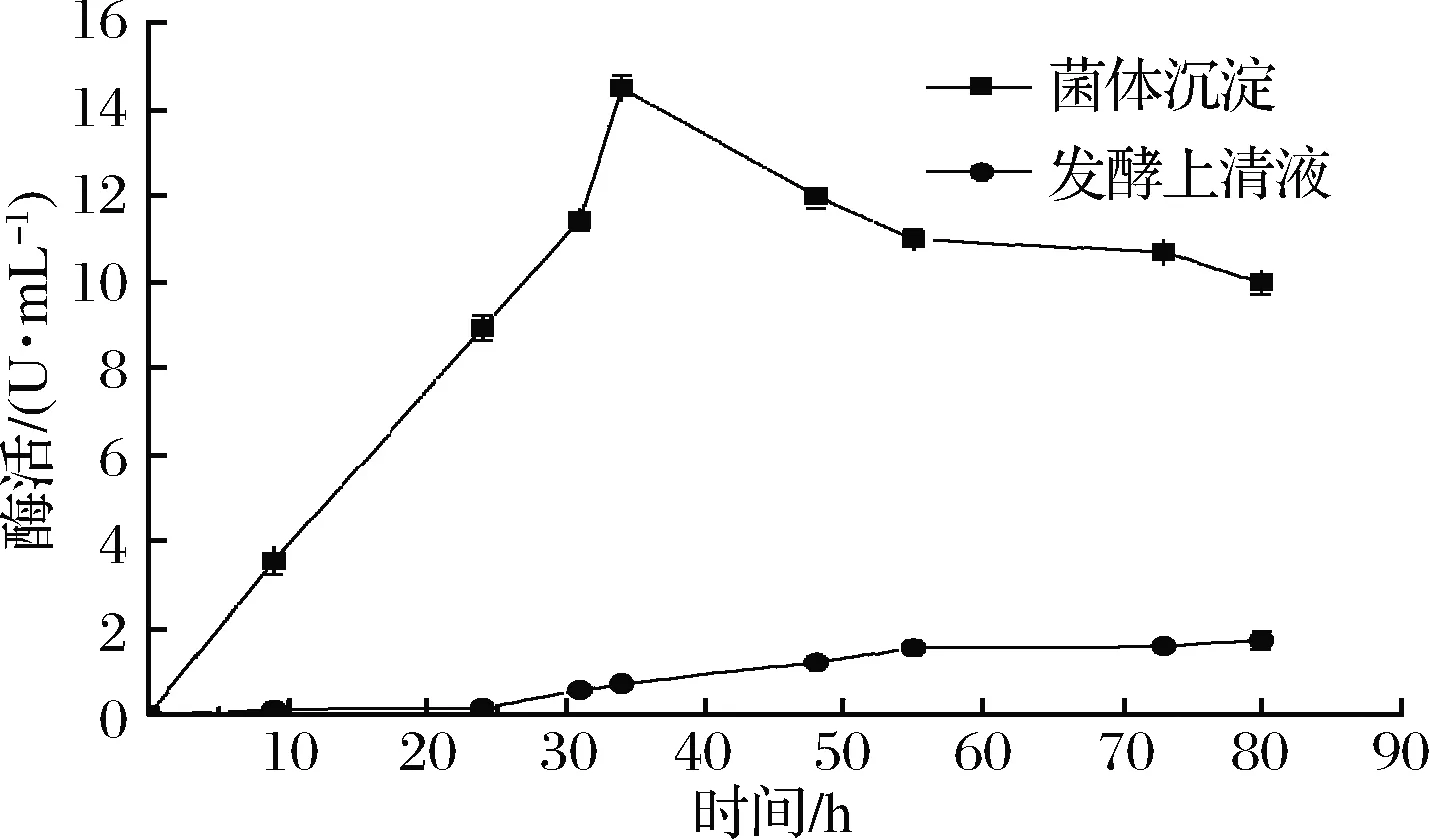
图2 重组菌酶活随时间变化
Fig.2 Recombinant enzyme activity changes over time
图3为重组大肠杆菌BL21/pET-CGT蛋白表达的SDS-PAGE图,观察到目的蛋白条带,预测目的蛋白分子质量为70 kDa。大多数报道的CGT酶是单体蛋白,分子质量在33~110 kDa[13];本实验得到的CGT酶的分子质量与同物种的其他菌株分子质量相似[14]。
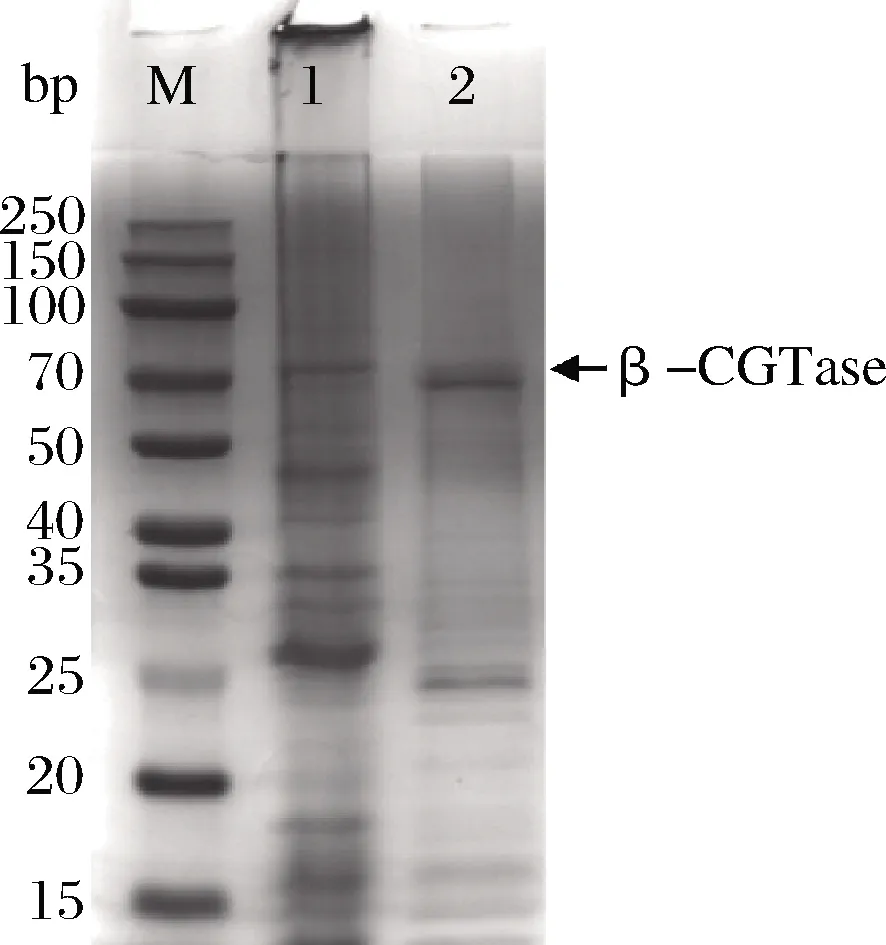
M-蛋白Marker;1-发酵胞内上清液蛋白条带;2-纯化后的蛋白
图3 重组菌产酶SDS-PAGE
Fig.3 Recombinant bacteria producing SDS-PAGE
2.2 重组β-CGTase反应条件优化
2.2.1 底物种类对环糊精产量的影响
由图4可知,不同淀粉类型对环糊精的转化率有所不同。当反应作用底物为玉米淀粉时,环糊精的产量及转化率最高为36%,马铃薯淀粉、可溶性淀粉、木薯淀粉分别为33%、30%、28%。产物中3种环糊精的比例为α∶β∶γ=7∶75∶18。酶法生产环糊精通常以淀粉作为底物,淀粉由直链和支链淀粉组成,不同种类的淀粉中直链和支链淀粉的比例有所不同,所以环糊精的转化率不尽相同,在实际生产中根据不同的情况选择合适的底物[15]。

图4 不同种类淀粉对环糊精产量的影响
Fig.4 Effect of different types of starch on cyclodextrin yield
2.2.2 底物质量浓度对环糊精产量的影响
由图5可知,底物浓度对环糊精的转化率有很大的影响,随着底物质量浓度的升高,环糊精的转化率逐渐下降。当玉米淀粉质量浓度为30 g/L,环糊精的转化率最高为36%;随着底物质量分数升高,环糊精的转化率迅速下降。造成这一现象的原因可能有:随着底物质量分数的升高,加热糊化后淀粉的黏度变大,使得底物与酶蛋白无法充分的接触,导致反应速率下降;其次是酶与底物的结合逐渐达到饱和,较高的底物浓度对酶与底物的反应不会有促进作用,此外,较高的底物浓度可能会使酶反应所得产物中小分子糖含量升高,而这些小分子糖会抑制CGTase的环化作用,而增强其耦合作用,从而降低环糊精的转化率[9]。

图5 底物浓度对环糊精产量的影响
Fig.5 Effect of substrate concentration on cyclodextrin yield
2.2.3 加酶量对环糊精产量的影响
由表1可知,环糊精的转化率随加酶量的升高呈现先升高后下降的趋势,当CGTase的添加量为5 U/g淀粉时,环糊精的转化率最高为45.63%,其中β-CD的转化率为35%,γ-CD转化率为8.4%。随着加酶量的增加3种环糊精的比例有所改变,α-CD的含量逐渐增加,β-CD、γ-CD的含量呈现先增加后降低的趋势。随着加酶量的增加,环糊精的转化率并没有增加,可能的原因是CGT酶是一种多功能酶,可以催化4种反应,其中歧化反应和耦合反应可以降解淀粉产生小分子糖,随着加酶量的增加,这2种反应强度增强,小分子糖增多,而小分子糖的存在会使得该酶的耦合反应加剧,使环糊精解环,从而降低环糊精的产量[16]。

表1 加酶量对环糊精产量的影响Table 1 Effects of enzyme addition on cyclodextrin yield
注:括号内百分数代表每种产物所占百分比
2.2.4 反应时间对环糊精产量的影响
由图6可知,环糊精的转化率随着反应时间的延长呈现先增加后下降的趋势,随着反应时间的延长,γ-CD的比例逐渐下降,α-CD的比例逐渐提高;当反应8 h时产量基本稳定,环糊精的转化率最高为45.63%,其中β-CD的转化率为35%,γ-CD的转化率为8.4%。同种属的菌株中,已发现的分泌CGT酶的菌株不多,其中包括Paenibacillusillinoisensis[17]、Paenibacillussp. xw-6-66[18]、Paenibacilluscampinasensissp.nov[19]以及Paenibacillusmacerans[20]等,环糊精的转化率在30%~40%。有研究表明,随着反应时间的延长,反应会向着产生小分子环糊精的方向移动,即α-CD的比例逐渐增加,γ-CD的比例逐渐下降[21]。该酶生产环糊精的最佳反应时间为8 h,环糊精的转化率可达到45.63%,较少的反应时间以及较高的环糊精转化率有利于降低生产成本,提高反应效率。
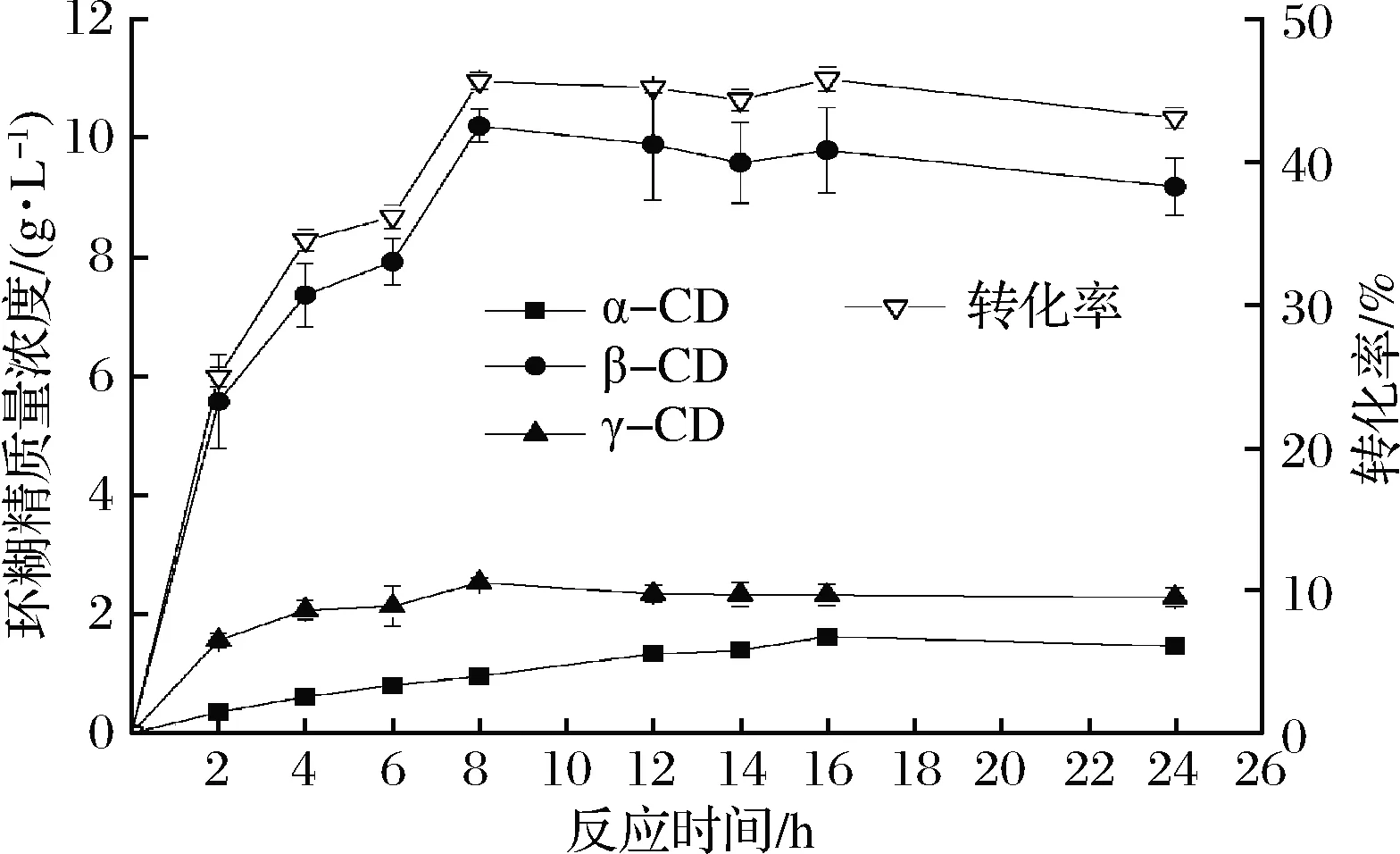
图6 反应时间对环糊精产量的影响
Fig.6 Effect of reaction time on cyclodextrin yield
3 结论
环糊精是一种重要的环状低聚糖,随着其在食品、医药、化妆品等领域的广泛应用,对其需求也日益增加。本文对来源于PaenibacilluscampinasensisSK13. 001的β-CGTase基因克隆到表达载体pET-22b(+)上,并转化大肠杆菌表达宿主BL21(DE3),经过34 h的摇瓶培养,其环化活力达到15 U/mL,这为进一步实现β-CGTase的工业化生产具有重要意义。
通过对重组β-CGTase的酶反应工艺条件的优化,研究其对3种环糊精的产量、比例以及转化率的影响。结果表明,以100 mmol/L磷酸盐缓冲液(pH 7. 0)配制的质量浓度为30 g/L玉米淀粉,55 ℃,加酶量为5 U/g干淀粉,反应8 h;优化反应条件后环糊精的转化率达到45.63%,其中α-CD的转化率为2.23%,β-CD的转化率为35%,γ-CD的转化率为8.4%;这为环糊精的工业应用提供参考。

