β-葡聚糖在结构化功能性配料制造中的应用进展
陈婷,叶发银,赵国华,2*
1(西南大学 食品科学学院,重庆,400715)2(重庆市特色食品工程技术研究中心,重庆,400715)
开发和生产营养、健康、安全且味美的食品一直是食品科技和产业努力的目标。当前,功能性食品正从片剂、丸剂、冲剂、胶囊、口服液等仿药剂形态向普通食品形态过渡。如何赋予生物活性物质在普通食品中的可添加性以及如何有效提升其生物利用度,已成为功能性食品配料生产中面临的重大挑战。其核心是要求被添加的生物活性物质与食品基质之间有良好的相容性,否则容易导致食品品质劣化并影响活性物质的稳定性和生理效能。但是,很多食品活性物质如β-胡萝卜素、姜黄素、功能性油脂等不仅水溶性差且对环境敏感(暴露在氧气、热、高价金属离子中易发生降解)使其添加遭遇瓶颈[1],又如功能性蛋白质、益生菌等往往在未到达有效生理部位前就已经失去活性,使其无法发挥相应功能[2]。近年来,对食品活性物质的结构化处理为解决上述问题提供了切实可行的方案,即利用活性物质与食品成分之间(载体材料)的相互作用,将前者装配于后者形成纳/微米颗粒、纳/微米级水凝胶或油凝胶、微胶囊、纳米纤维等结构体[3]。这些结构化功能性配料一方面具有与食品基质良好的相容性,不会影响食品的外观和质地等品质,另一方面还能有效保护活性物质并实现靶向递送,提升其生物利用度。
多糖、蛋白质等食品生物聚合物是结构化功能性配料加工制造过程中广泛采用的载体材料。β-葡聚糖(β-glucan,β-G)被认为是最具潜力的结构化功能性配料制造的载体材料之一。首先它是一类安全的食品配料,并已证实具有多种生理活性[2];其次,β-G分子结构上不存在人体消化酶的作用位点,作为载体在胃及小肠环境中具有良好的结构稳定性[2];第三,β-G已证实具有稳定化、胶凝作用以及结合(或复合)食品成分(茶多酚、姜黄素)等特性,甚至可作为壁材使用[2];第四,β-G具有可供结构修饰的基团位点,经疏水化改性的β-G展示出色的荷载“增溶”疏水性活性成分的能力[4];最后,由于其糖苷键位置及连接方式的独特性,β-G的三螺旋构象在溶液中具有“变性-复性”的特征,这为功能性配料的结构化设计提供了基础[5]。为推动β-G在结构化功能性配料制造中深入研究于应用,本文在充分调研文献的基础上对此领域的研究现状进行全面总结,对存在的问题进行了深入剖析,并对其发展前景进行了展望。
1 β-G的来源和结构
β-G是葡萄糖结构单元以β-糖苷键连接而成的一类非淀粉类多糖,广泛存在于高等植物、大型真菌、藻类、酵母和细菌等生物体中。不同来源β-G均有β-1,3糖苷键以及数量各异的β-1,4和β-1,6糖苷键,如表1及图1所示。纤维素的葡萄糖结构单元全部以β-1,4键连接,不属于β-G。
β-1,3-葡聚糖是结构最简单的β-G,没有分支链,目前发现的主要包括可得然胶(curdlan)、裸藻多糖(paramylon)和茯苓聚糖(pachyman)。可得然胶(图1-a)是一种细菌胞外多糖,不溶于冷水,可溶于碱性溶液。可得然胶具有胶凝特性,将其水悬液加热到60℃以上即可形成凝胶。土壤杆菌(Agrobacteriumsp.)目前是可得然胶的主要生产菌株,此外粪产碱杆菌(Alcaligenesfaecalis),三叶草根瘤菌(Rhizobiumtrifolii) 等细菌也具有产可得然胶的能力。裸藻多糖发现于裸藻属生物纤细裸藻中,为高度结晶的线性β-1,3-葡聚糖,常以不溶性的颗粒(2~3 μm)存在。
β-1,3-1,4-葡聚糖主要存在于大麦、燕麦、小麦、高粱等谷类作物的胚乳细胞壁中,是线性无分支的均多糖(图1-b)。它的结构特征在于,连续的β-1,4糖苷键(以纤维二糖、三糖和四糖常见,也有较长的纤维寡糖链段存在)形成纤维寡糖链段,并由单个的β-1,3糖苷键连接。
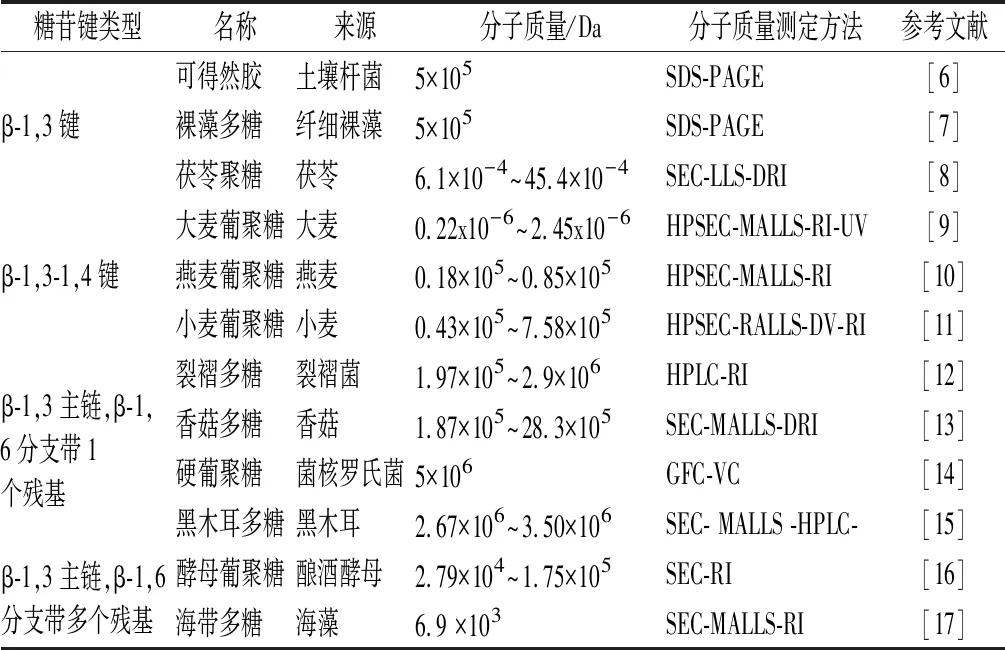
表1 不同来源β-G的糖苷键类型及结构Table 1 Types and structures of glycosidic bonds of β-glucan from different sources
注:SDS-PAGE为十二烷基硫酸钠聚丙烯酰胺凝胶电泳,SEC为分子排阻凝胶色谱,HPSEC为高效排径色谱法,HPLC为高效液相色谱法,GFC为凝胶过滤色谱法,MALLS为多角度激光散射法,RALLS为直角激光散射探测器,RI为折光率检测器,DRI为折射率差,DV为差示黏度计,VC黏度检测器
带分支的β-1,3-葡聚糖主要存在于大型真菌和酵母菌中,其特点是主链为β-1,3糖苷键,侧链为β-1,6糖苷键,分支点位置及侧链长度因来源而异。硬葡聚糖(scleroglucan)和裂褶多糖(schizophyllan)(图1-c)是以3个β-1,3键连接的d-吡喃型葡萄糖为重复结构单元,每个结构单元上由单个β-1,6键连接一个葡萄糖侧链构成的β-G。黑木耳多糖(图1-d)同样以3个β-1,3键连接的葡萄糖为重复结构单元,但每个结构单元上具有2个β-1,6键连接单个葡萄糖侧链[15]。香菇多糖(lentinan)重复结构单元为5个β-1,3键连接的葡萄糖残基(图1-e),每个结构单元上有2个β-1,6键连接一个葡萄糖侧链,形成梳状分支结构,具有较好的水溶性。在酵母细胞壁中,β-G(图1-f)以β-1,3键连接的葡萄糖残基为主链,分支点约占总糖苷键数的3%~15%,侧链与主链以β-1,6键连接,侧链由33个葡萄糖残基组成。

a-可得然胶;b-谷物β-葡聚糖;c-裂褶多糖;d-黑木耳多糖;e-香菇多糖;f-酵母β-葡聚糖
图1 不同来源的β-葡聚糖结构图
Fig.1 Structures of β-glucan from different sources
多糖在溶液能通过分子链内或链间相互作用(如氢键)而形成诸如无规则线团、单螺旋、双螺旋、三螺旋等高级结构,甚至出现短杆状、蠕虫状等自聚集体等结构形态。X-射线发现β-G的天然构象为右手三螺旋结构。以可得然胶右手三螺旋为例,螺旋直径为2.3 nm,螺距为1.8 nm,螺旋结构主要靠伸向螺旋中心的C-2位上—OH之间的氢键网络稳定(图2-a)。有研究发现香菇多糖三螺旋链在0.15 mol/L的NaCl溶液中可平行排列形成棒状聚集体。当环境条件发生变化时(如强碱、强极性溶剂、高温),β-G的构象可能随之改变而发生“变性”。如可得然胶在0.19~0.24 mol/L的NaOH溶液中呈双螺旋结构,低于此浓度呈三螺旋结构,而高于此浓度呈单链随机线圈。“变性”后的β-G在环境条件恢复后也可发生“复性”。裂褶多糖在水中呈三螺旋结构,加入二甲亚砜后转变为单链;若在水中透析去除二甲亚砜,则又可逐渐恢复为三螺旋结构[5](图2-b)。SLETMOEN等[18]发现用NaCl溶液稀释硬葡聚糖的二甲亚砜溶液,可导致硬葡聚糖从单链随机线圈过渡到“不完美”三螺旋结构,再进行退火处理可形成“完美”的三螺旋结构(图2-c)。
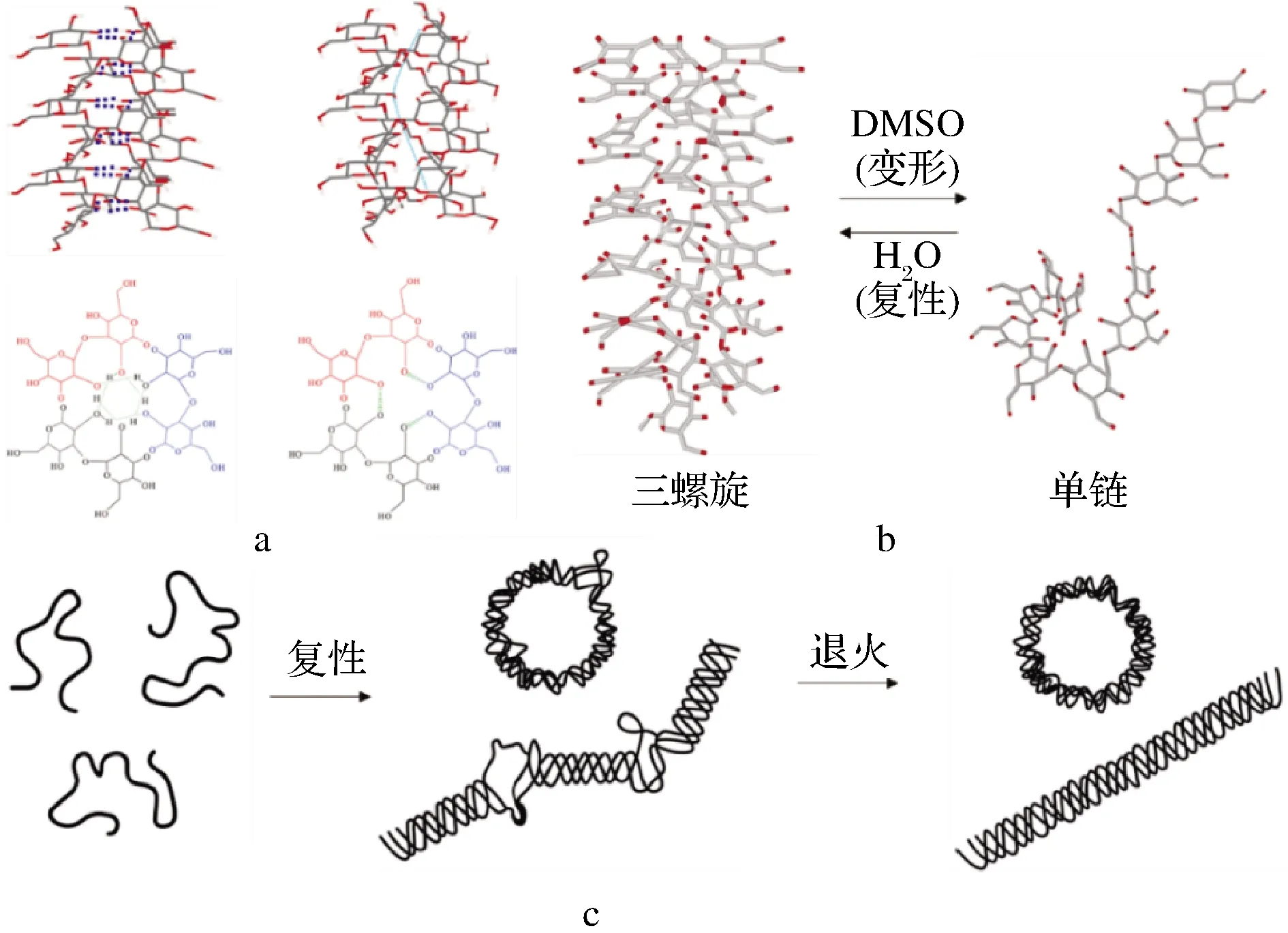
a-可得然胶中可能存在的氢键模型[19];b-裂褶多糖的变性- 复性过程图[5];c-硬葡聚糖复性和后续退火后形成的物种示 意图[18]
图2 不同条件下β-葡聚糖的构像示意图
Fig.2 Schematic illustration of β-glucan conformation under different conditions
2 β-G在结构化功能配料制备中的应用方式及特点
2.1 全葡聚糖颗粒的应用
全葡聚糖颗粒(whole glucan particle, WGP)是指将酵母菌(Sacharomycescerevisiae)的细胞内容物取出后,得到中空不溶性颗粒,其大小外形与原酵母菌细胞基本相同,平均粒径为2~4 μm(图3)[20]。WGP保留了细胞壁骨架,成分上主要是β-1,3-d-葡聚糖。由于制备方法及来源差异有的还含有葡甘露聚糖、几丁质和脂质等成分,因而有文献将它们统称为酵母细胞壁颗粒(yeast cell wall particles,YCWP)。制备WGP时,通常使用热碱液消化酵母细胞内容物,接着用盐酸调节到酸性(pH 4.5),75 ℃保温1 h继续消化,最后用水、有机溶剂交替洗涤,离心、干燥得到灰白色粉末。有些WGP表面存在多个500~600 nm大小的孔与内部空腔连通,这为物质经由孔道双向扩散提供了便利[20]。有证据表明,WGP的内部空腔对姜黄素、精油等疏水性食品成分的荷载效果良好(表2),荷载明显提升了这些成分的热稳定性和抗氧化稳定性。YOUNG等[3]采用真空浸渍技术将姜黄素封装在YCWP内,经热处理(70 ℃、30 min)后姜黄素保留率仍超过91%,而传统乳液包裹的姜黄素在相同处理条件下保留率仅为66%。此外,WGP对生物大分子(DNA、siRNA及蛋白质等[3])具有较好的包埋效果,可用于此类活性成分的靶向递送。对于不能封装在空腔的一些活性成分(如口服疫苗等),可以与WGP表面的结合位点通过层层组装构建功能性结构体[21]。

a-扫描电镜照片[20];b-透射电镜照片[22]
图3 全葡聚糖颗粒的电子显微镜图像
Fig.3 Electron microscope images of whole glucan particles
2.2 β-G凝胶的应用
一些多糖在水相中分散后可从“溶胶”转变为“凝胶”,是因为环境条件改变导致多糖分子链段间产生了稳定的交联结构。β-G具有形成凝胶的能力。大麦及燕麦β-G、可得然胶等具有冷致胶凝的特性。相对浓的β-G溶液(40~120 g/L)在室温及较低温度下即形成凝胶;当浓度低时(10~40 g/L),可通过冻凝胶作用(cryogelation)形成冻凝胶结构体。LAZARIDOU等[23]报道大麦β-G水溶液经反复冻融处理,溶液在冷冻时溶质被浓缩,聚合物链段彼此靠近并通过非共价作用形成弱凝胶结构,这种交联网络结构在解冻时仍在缓慢成长。经过多次冷冻-解冻循环后,随着溶剂不断移除和链段间作用力增强,可形成海绵样的具有一定机械强度的冷冻凝胶(cryogel)。研究表明,β-G的凝胶化与其精细结构特征密切相关。对于具有β-1,3及β-1,4糖苷键的β-G,β-1,4结构单元长链段以及重复的纤维三糖结构有利于凝胶网络形成,如大麦β-G因其DP3:DP4比值更高,形成凝胶的速度大于比值较低的燕麦β-G。凝胶形成临界浓度(crtical aggregation concentration,CAC)、凝胶速度和凝胶强度主要与β-G的分子质量相关。燕麦β-G分子质量分别为3.5×104Da及1.1×105Da时,CAC分别为3.5%和4.4%。大麦β-G的分子质量(70→250×103Da)越大,胶凝时间越长,凝胶强度越大[24]。
将食品成分分散于β-G“溶胶”中,通过β-G凝胶作用可实现对前者的物理包埋。XIONG等[25]将大麦β-G溶液与黑加仑花青素(black currant anthcyanin,BCA)溶液混匀,在80 ℃保温条件下用注射器将混合液滴入植物油中,随即冰浴,液滴硬化形成大约2.5 mm直径的凝胶珠。凝胶珠在4 ℃保温4 h后进行脱水处理,以BCA回收率为评价指标,不同脱水方式的排序为冷冻干燥>真空烘箱干燥>热风干燥>红外干燥,这表明干燥过程中红外辐照降低了BCA的稳定性。研究还发现BCA回收率还受冷却介质植物油的影响,原因在于BAC作为抗氧化剂在清除油中自由基时受到损失。LAZARIDOU等[23]将蛋白质和大麦β-G混合后制作冷冻凝胶,结果表明,冷冻凝胶的弹性模量和熔化焓随大麦β-G(55→320 kDa)和蛋白质(18→270 kDa)的分子质量的增加而减小,而压缩模量、真实应力和熔化温度随之增加。蛋白质表观扩散系数和累计释放量(97%→23%)则随二者分子质量增加而降低。VEVERKA等[26]报道了平菇β-G(Mw=450 kDa)水凝胶的乳化活性。将平菇β-G粉末悬浮在95 ℃水中,搅拌使其“溶解”,接着分2批加入油脂,高速剪切分散,植物油即被乳化,冷却得到乳液凝胶(emulsion gel)。细小油滴被凝胶网络结构稳定下来,质量分数为0.50% β-G水凝胶可稳定共轭亚麻油酸(与前者质量比1∶2)油滴达6个月之久。研究还发现在乳化前加入平菇β-G粉末(粒度4.5 μm)能增强水凝胶的乳化能力,前者可能通过Pickering效应发挥作用。
2.3 β-G微胶囊的应用

2.4 β-G复合物颗粒的应用
在水相中,一些食品成分可与β-G分子上的结合位点通过非共价键作用形成复合物,复合物对环境敏感,当条件合适时这些复合物可呈现胶体特征(图4)。LI等[30]研究了单宁酸(tannic acid,TA)与燕麦β-G在溶液中形成复合物的规律,随着单宁酸比例增加,复合物粒度呈先降后增趋势,TA/β-G=0.4时粒度最小(380 nm),TA/β-G≥0.6时变得浑浊甚至产生沉淀;TA/β-G=0.5的复合物浊度从20 ℃升至30 ℃过程中迅速降低,继续升温变化不明显;增加离子强度(0→0.25 mol/L)或降低pH(9→2)均引起浊度增加。WU等[31]将茶多酚(tea polyphenol,TP)与燕麦β-G混匀后于透析袋(截留分子质量1.4 kDa)中透析,对袋内液体冷冻干燥得到淡黄色粉末,粉末中TP含量为19.8 μg/mg;原子力显微镜观测发现β-G呈现离散的聚集体,当TP与β-G复合后呈现规则且连续的聚集体。GAO等[32]进一步发现β-G对不同茶多酚单体化合物的复合效率具有差异,其中对EGCG的结合量(达到321.5 μg/mg)和复合效率最高,复合作用遵循Toth等温模型。

图4 β-G与单宁酸在不同pH下形成复合物 的透射电镜图[30]
Fig.4 Transmission electron microscopy of complexes of β-glucan and tannin at different pH[30]
研究表明,β-G复合作用具有增强敏感成分稳定性的作用[33],槲皮素、姜黄素、辅酶Q10及叶酸等在测试条件下损失率可达40%,各自与β-G形成复合物后,分别在过氧化氢熏蒸(25 ℃,5 d)、光照(22 ℃,365 nm单色光源及290~330 nm光源)、热(40 ℃,55%RH,3个月)条件下测试,辅酶Q10及叶酸的保留率达到100%,槲皮素、姜黄素的保留率超过95%。此外,对于姜黄素及槲皮素等难溶性成分,β-G复合作用可提高它们在水中的溶解性,姜黄素及槲皮素溶解度分别达到77.1 mg/g和64.5 mg/g[33]。值得指出,β-G复合作用还可以增加活性成分在体内发挥活性。WU等[31]对比分析了TP-β-G复合物及物理共混物经小鼠连续灌胃15 d后TP发挥体内抗氧化活性的效果,结果表明,灌胃TP-β-G复合物使小鼠肝脏中超氧化物歧化酶及谷胱甘肽过氧化物酶水平显著高于物理物混合组和灌胃TP组,总抗氧化能力3组间无显著性差异。
2.5 β-G纳米结构体的应用
利用β-G发生“变性-复性”的特性,将变性的β-G与客体分子进行相互作用,可在前者复性的过程中实现自组装,构建功能性结构体。现已证明,金属纳米颗粒、单壁碳纳米管、核苷酸、共轭聚合物、染料等均可包裹在β-G三螺旋内部[19]。JIA等[34]研究了香菇多糖(lentinan,LNT)对硒纳米颗粒(Selenium nanparticles,SeNPs)的包裹作用。将三螺旋的香菇多糖(t-LNT)溶液在140 ℃加热30 min得到单链香菇多糖(s-LNT)溶液,然后加入Na2O3Se、抗坏血酸混合均匀,透析,冷冻干燥,得到SeNPs/s-LNT复合物,平均尺寸为28 nm。随着s-LNT用量增加(5∶1→25∶1),复合物的平均尺寸减少(52→33 nm)。SeNPs/s-LNT复合物在溶液中均匀分散30 d,仍可呈半透明状。其制备机制为Na2O3Se经抗坏血酸还原成元素Se,原子聚集成SeNPs,并通过Se与s-LNT上的—OH结合,s-LNT重组为三螺旋,将SeNPs包裹在三螺旋内部。XU等[35]发现将浓度低于0.02 g/mL黑木耳多糖溶液用注射器滴加到乙醇溶液中后可自组装成直径小于100 nm、长度为数十微米的空心纳米纤维。其制备机制为黑木耳多糖在稀溶液中以单链形式存在,由于其疏水骨架,亲水侧链,在氢键和疏水相互作用的驱动下,黑木耳多糖链平行排列成管状纳米球,增加浓度后,纳米球融合成具有定向结构的厚层,进一步形成纳米纤维。基于此,可将SeNPs、AuNPs包裹在β-G纳米纤维中,有学者采用亚硒酸钠还原法制备了平均直径为92 nm AF1/ SeNPs复合纳米纤维,通过Se—O键可稳定16个月。
目前,通过β-G变性-复性构建的纳米结构体在食品工业中的应用尚不多见。基于纳米银的抑菌作用,CHEN等[36]考察了真菌胞外多糖(ESP1)与AgNPs复合物的抑菌能力,将其与大肠杆菌、金黄色葡萄球菌在37 ℃下孵育12 h,结果发现,当ESP1的含量大于5 mg/mL,AgNPs的含量为1.6 mg/mL时完全抑制大肠杆菌生长,AgNPs的含量为0.8 mg/mL时完全抑制金黄色葡萄球菌生长。JIA等[34]将SeNPs/s-LNT与HeLa细胞一起培养后,发现随着SeNPs的大小和尺寸分布的减小(52→33 nm),抗肿瘤活性增加(IC50:85→19 μmol/L),诱导HeLa细胞凋亡的平均荧光强度也增强(40.0 → 78.8),远高于t-LNT处理组(25.6)。
2.6 β-G自聚集胶束的应用
两亲性多糖具有在水溶液中自聚集的特性。多糖的疏水性链段或残基通过疏水相互作用使其聚集为胶束、囊泡或纳米球等结构。早期研究在对从燕麦麸皮提取的β-G进行溶液特性表征时发现,约10%的组分具有胶束样自聚集能力,临界自聚集浓度为0.2 g/L。这可能是依靠β-1,4长链段(即使数量不多的)之间的相互作用,抑或是链段上连有亲脂成分。由于β-G往往亲水性较强,为赋予良好自聚集特性通常将其疏水化改性。LIU等[37]发现辛烯基琥珀酰化燕麦β-G(取代度0.007 6~0.038 7)在水相中可自聚集为175~600 nm尺寸的胶束。当燕麦β-G重均分子质量为16.8×104g/mol时, CAC(0.206 →0.039 mg/mL)和胶束尺寸(600→267 nm)随着取代度(0.008 0→0.038 7)增加而降低,而重均分子质量从16.8×104降至11.9×104g/mol时,CAC明显降低(0.206~0.081 mg/mL)。有研究发现脂肪酰基修饰的燕麦β-G在水相中可自聚集为胶束(264.7~530.9 nm),其CAC值(0.050~0.165 mg/mL)随着DS(0.030→0.010)、酰基链长(10→6)的降低或β-G分子质量(7.4×104→16.8×104Da)的增加而增加。
疏水化改性β-G因其较低的CAC值,其自聚集胶束具有良好的稀释稳定性,且不被人体消化酶降解,因而具有“增溶”和递送亲脂性活性成分的潜力。β-G自聚集胶束能将水相中以极低浓度存在的活性成分“吸收”到胶束内部,从而不断促进难溶成分的溶解,显著增加姜黄素(从11 ng/mL升至9.68 μg/mL[37],胶束尺寸404→308 nm)、杨梅素(9.93 μg/mL升至83.79 μg/mL,胶束尺寸486→217 nm)及β-胡萝卜素(12.84 μg/mL, 胶束尺寸140→598 nm[38])在水溶液中的表观溶解度。研究认为,姜黄素或杨梅素包埋后胶束尺寸减少是由于氢键和疏水相互作用使分子间堆积形成更紧凑的胶束;而β-胡萝卜素包埋后胶束尺寸增加是因为胶束中未定位的酰基基团与β-胡萝卜素之间相互作用并一起进入胶束内部[38]。胶束化包埋使β-胡萝卜素在水相环境中具有良好的分散和着色能力。体外实验结果表明,包埋提升了上述成分对光、热等因子的稳定性。姜黄素在25 ℃光照下储藏20 d仅剩7.7%,包封在自聚集胶束中的保留率为54.7%[39]。动物实验结果表明,荷载胶束对姜黄素[39]、杨梅素[40]具有结肠递送效应,提高了生物利用率[39]。
2.7 β-G静电纺丝的应用
静电纺丝是一种由静电驱动高分子流体(或熔体) 喷射流来制备纳/微米纤维的过程,一个电极与高分子流体流经的毛细管相连,另一个电极与接受装置连接,高分子流体带上高压静电后,液体表面聚集电荷,电荷的相互排斥引发与表面张力相反的力。随着电场强度的增大,毛细管尖端流体的半球形表面伸长,形成泰勒锥,进一步增大电场,电荷斥力克服表面张力,带电射流从泰勒锥尖端喷出,经过一个不稳定和延伸的过程,射流变得非常长且薄。同时由于溶剂蒸发(或熔体凝固),最终形成带电的聚合物纤维被收集在接受装置上。多糖溶液静电纺丝时需要适宜浓度既能使分子链因彼此作用发生缠结,但不至于浓度过高会增加黏度妨碍流体喷出。溶液还应具有足够低的表面张力,以防止在溶剂蒸发时射流塌陷成液滴。研究表明,β-G溶液具有可纺性。KAWAHARA等[41]将β-1,3-葡聚糖溶解于甲酸制得电纺溶液,静电纺丝得到直径为0.05~1 μm的电纺纤维(图5-a)。为了提高β-G溶液的可纺性,通常向其中添加医药级合成聚合物。GRIP等[42]采用含有羟丙基甲基纤维素、聚氧乙烯和β-G的混合流体制备出直径为180 nm的β-G-纳米纤维。SAFAEE-ARDAKANI 等[43]将低浓度(15 g/L)的裂褶多糖(schizophyllan,SPG)溶液与聚乙烯醇(polyvinyl alcohol,PVA)共混后进行电纺,电纺纤维的直径(424→224 nm)随SPG比例(SPG/PVA:0/100→75/25)的增加而降低。将纤维用戊二醛交联并干燥后制得SPG/PVA纳米纤维毡,其拉伸强度(6.5 MPa)与皮肤的拉伸强度接近。KIM等[50]将含有聚乳酸-羟基乙酸共聚物和出芽短梗霉β-G的混合溶液进行静电纺丝时,在收集器上会有不同尺寸的颗粒沉积,当不添加PLGA时,β-G以微粒沉积在接受装置上(图5-b);随着β-G质量分数(25%→50%)增加,纤维直径(1.42→0.89 μm)减小(图5-c~图5-d)。KIM等[50]将β-G纳米纤维毡敷在小鼠的皮肤切口上,4 d后,纤维毡组的未愈合伤口面积为76.8%~82.3%,而对照治疗组的未愈合伤口面积为97.9%。从上述研究可推测β-G电纺纤维作为生物材料极具潜力。

图5 不同操作条件下β-G的静电纺丝效果[41,50]
Fig.5 Electrospinning effect of β-glucan under different operating conditions[41, 50]

表2 不同类型β-G结构化配料的制备方法、结构及作为载体的特性Table 2 Preparation method and application of different β-glucan structural ingredients
续表2

β-G原料制备方法制备过程结构及作为载体的特性参考文献β-G纳米结构体香菇多糖变性-复性先制备s-LNT,然后20 mL s-LNT(2 mg/mL)+500 L亚硒酸盐(0.1 mol/L)混匀,加抗坏血酸 (0.2 mol/L),透析28 nm;硒纳米颗粒在水中良好的分散性,抗肿瘤活性提高[34]香菇多糖变性-复性2.5~5 mLAgNO3 (1 mg/mL)+25 mL LNT (1 mg/mL),避光剧烈搅拌后加入NaBH4,离心、透析6 nm;银纳米颗粒在水中有良好的分散性,稳定保持9个月[49]真菌胞外多糖变性-复性AgNO3溶液(2 mL,10 mmol/L)+胞外多糖溶液(2 mL,1.0 mg/mL),避光搅拌(100 ℃,60 min)50 nm;银纳米颗粒稳定保持2个月;对革兰氏阴性及阳性菌均有抑制作用[36]β-G自聚集胶束OSβ-G自组装40 mg OSβ-G冻干粉+20 mL蒸馏水,搅拌(100 ℃,2 min),加入10 mg姜黄素,均质后搅拌离心,回收上清液308 nm;姜黄素荷载量4.21 μg/mg;热处理稳定性提高;结肠定向给药[4]OSβ-G自组装10 mg β-胡萝卜素+ 20 mL OSβ-G(2 mg/mL),均质,搅拌离心后冷冻干燥598 nm;β-胡萝卜素可在胃肠道中控制释放[ 39]OGE悬浮法7.5 mg OGE+5 mL水,100 ℃,2 min,室温搅拌24 h;加入7.5 mg 杨梅素,均质、搅拌、除去沉淀物216 nm;提高杨梅素的水溶性及抗氧化活性[40]β-G静电纺丝β-1,3-1,6葡聚糖电纺法β-G(0.74%)+ 羟丙基甲基纤维素(1.79%)+ 聚氧乙烯(0.3%);电压80 kV,溶液流速300 mm/s(110±74) nm;促进伤口愈合[42]裂褶多糖电纺法聚乙烯醇(10%)+ 裂褶多糖(1.5%);电压27 kV,溶液流速0.3 mL/h353~915 nm;促进创面愈合[43]出芽短梗霉β-G电纺法六氟-2-丙醇为溶剂,PLGA (200 g/L)+β-G(β-G/PLGA:1∶4和1∶2);电压15 kV,溶液流速2 mL/h 1.96~0.52 μm;促进创面愈合[50]
注:β-G为β-葡聚糖,OSβ-G为辛烯基琥珀酰燕麦β-G,OGE为十八烷酸燕麦β-G,s-LNT为单链香菇多糖,PLGA为聚乳酸-羟基乙酸共聚物
3 结语
综上,有关β-G作为结构化功能性配料方面的研究近年来进展显著。β-G由于其结构的多样性、构象的灵活性及其独特的加工性能,在食品活性成分的保护、递送、活性保持和生物利用度提升等方面的应用已崭露头角,在封装、释放等方面备受关注。就现状来看,β-G结构化配料加工制造领域仍面临β-G分子结构复杂、结构化配料“构-效”不明、智能设计程度不高、研究结构体形成的新方法、新手段缺乏,以及现有技术应用及规模化有待开展等方面的瓶颈问题。因此,后续研究应充分考虑上述问题创新研究手段,深入评价β-G结构化配料的特性和食品应用。

