IL-23和IL-17在糖尿病性视网膜病变患者房水中的表达
张海江,梁 亮,田 瑞
0引言
糖尿病性视网膜病变(diabetic retinopathy,DR)是糖尿病(diabetes mellitus,DM)常见且严重的并发症,也是DM患者致盲的重要原因。其主要病理改变为视网膜出血、渗出、微血管瘤及新生血管形成,发病与氧化应激、蛋白激酶C激活、晚期糖基化产物等因素密切相关,但其具体发病机制目前尚未明确。近年研究表明,由炎症介质介导的慢性炎症反应在DR的发生与发展过程中起着十分关键的作用[1-2]。长期以来,人们按照CD4+细胞分化和功能特征将其分为辅助性T细胞(T help cell,Th)和调节性T细胞(regulatory T cell,Treg),而最近发现一种新型的不同于Th1和Th2的CD4+效应细胞,具有独立的分化和调节机制,因其能产生特异性炎症因子白细胞介素(interleukin,IL)-17而命名为Th细胞17型(Th17)。IL-17作为超强的前炎症因子,其可通过与特异性受体(IL-17R)相结合,激活PI3K/Akt/ERK及p38MAPK等炎症信号传导通路,启动炎症级联反应,在炎症、感染及宿主反应等过程中承担重要角色[3]。而IL-23可通过激活Th17细胞内JAK/STAT信号通路促进IL-17分泌和活化,参与IL-17介导的多种病理生理过程,是IL-17上游正向调控因子[4]。本研究通过检测不同程度DR患者房水中IL-17、IL-23的表达变化情况,分析两者的相关性,探讨IL-23/IL-17通路是否作为炎症因素参与DR的病理损伤过程,以期为DR的临床诊疗提供新的思路,现将结果报道如下。
1对象和方法
1.1对象收集2016-06/2019-06宜昌市中心人民医院眼科收治的因年龄相关性白内障需行白内障手术的患者70例70眼,其中单纯年龄相关性白内障患者20例20眼(Ⅰ组);合并DM者50例50眼均符合2013年版《中国2型糖尿病防治指南》中制定的糖尿病诊断和分型标准[5],根据美国早期治疗糖尿病性视网膜病变研究小组(ETDRS)制定的DR病变程度分级标准[6]分为3组,无糖尿病性视网膜病变组(Ⅱ组)18例18眼,非增殖性糖尿病性视网膜病变组(non-proliferative diabetic retinopathy,NPDR,Ⅲ组)17例17眼,增殖性糖尿病性视网膜病变组(proliferative diabetic retinopathy,PDR,Ⅳ组)15例15眼。纳入标准:(1)晶状体混浊Ⅱ~Ⅲ级,有白内障手术指征;(2)空腹血糖控制在8.3mmol/L以下;(3)血压正常(140/90mmHg以内)或接近正常范围。排除标准:(1)合并其他严重全身性疾病(如肾功能不全、明显高血脂、血压控制不佳等)者;(2)屈光介质明显混浊,影响眼底观察,无法进行ETDRS评分者;(3)既往有眼底病变史,伴有其他明显眼底病变者;(4)1型糖尿病患者。四组患者年龄、性别构成比、患眼眼别等一般资料及三组DM患者DM病程比较,差异均无统计学意义(P>0.05,表1)。本研究遵循《赫尔辛基宣言》,符合医学伦理学原则,并获得医学伦理委员会批准。所有患者均对本研究知情同意,均签署知情同意书。
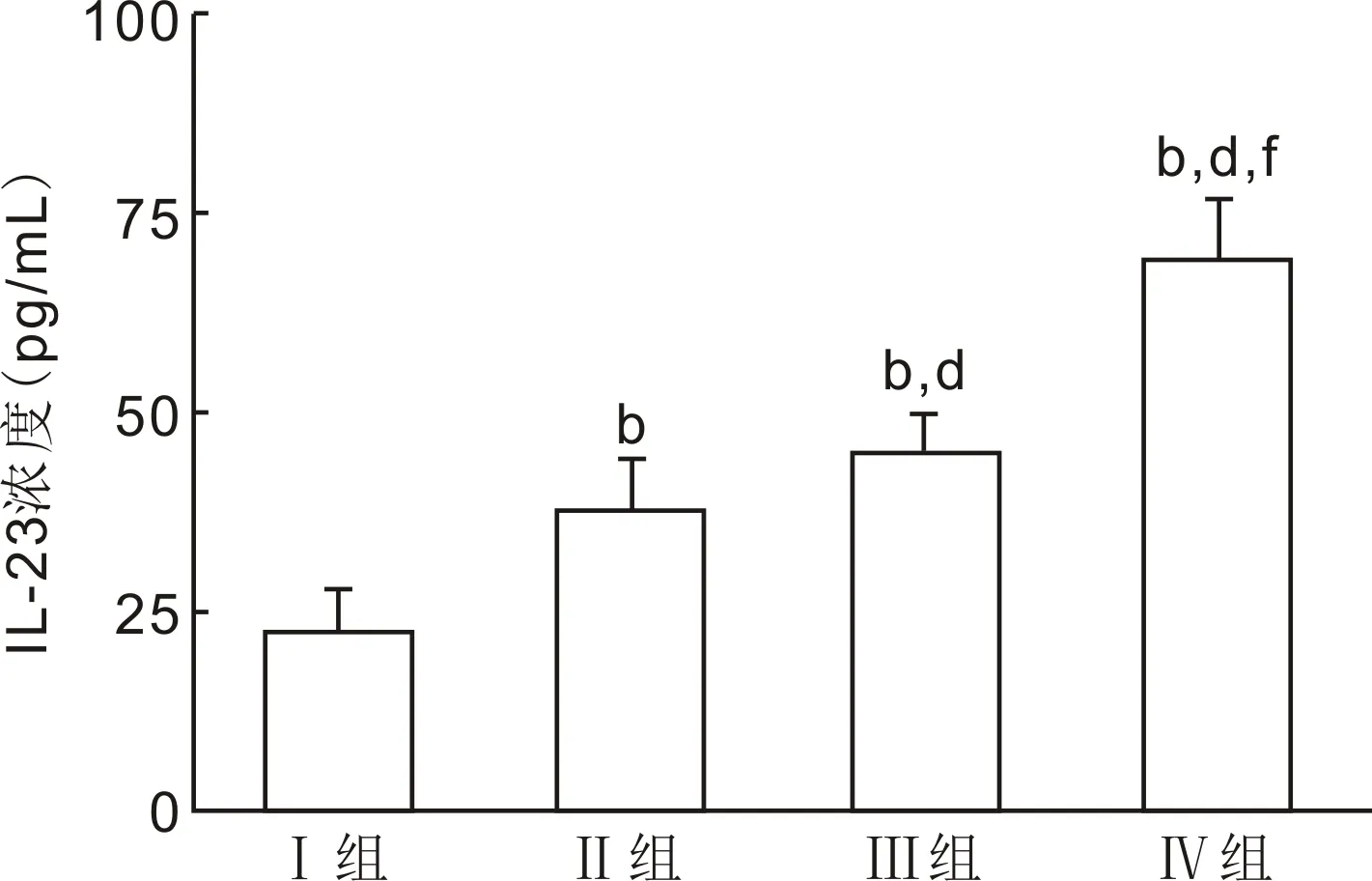
图1ELISA法检测IL-23的表达bP<0.01vsⅠ组;dP<0.01vsⅡ组;fP<0.01vsⅢ组。
1.2方法
1.2.1房水标本采集所有患者手术眼在行白内障超声乳化术前常规消毒铺巾、麻醉开睑后,显微镜下用1mL一次性注射器在角膜缘内1mm行前房穿刺。针头不触及晶状体、虹膜及角膜内皮,抽取瞳孔中央区未稀释房水0.2mL,注入无菌离心管中,置于冰上,标记并放入-80℃低温冰箱保存待检[7]。所有标本采集均为同一名手术医师完成,标本采集后常规行白内障手术。
1.2.2 ELISA法检测房水中IL-17和IL-23的表达检测前从冰箱取出样品,放于冰上溶解,然后轻弹混匀,以5000r/min离心收集上清作为检测样品。按照IL-23和IL-17 ELISA试剂盒(武汉博士德公司)操作说明书,测定各组患者房水中IL-23和IL-17的表达水平。实验中分别设空白、标准和样品检测组,每个检测孔设3个复孔,每孔加样50μL。37℃温育90min后弃去液体,然后每孔直接加入生物素标记抗体工作液50μL,37℃温育60min。弃去液体后加入1×洗涤缓冲液300μL,1min后弃去,洗涤步骤重复3次。随后加入辣根过氧化物酶标记亲和素工作液50μL,37℃温育60min,弃去液体并按前述步骤洗孔3次。最后,每孔加底物溶液50μL,37℃避光反应30min后加终止液终止反应。使用全波长酶标仪(Thermo公司)检测450nm处吸光度值(A值),以试剂盒提供的标准品绘制标准曲线,使用标准曲线法分别计算IL-23和IL-17的浓度。
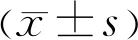
2结果
2.1各组患者房水中IL-23的表达水平ELISA检测结果显示,Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组患者房水中IL-23的表达水平分别为22.18±5.48、37.63±4.52、45.06±4.64、68.89±6.11pg/mL,差异有统计学意义(F=263.668,P<0.001,图1)。Ⅱ组、Ⅲ组、Ⅳ组患者房水中IL-23的表达水平较Ⅰ组明显升高,且Ⅱ组、Ⅲ组、Ⅳ组之间两两比较差异均有统计学意义(P<0.001)。
2.2各组患者房水中IL-17的表达水平ELISA检测结果显示,Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组患者房水中IL-17的表达水平分别为4.69±2.03、6.83±1.02、9.52±1.30、10.89±1.26pg/mL,差异有统计学意义(F=64.795,P<0.001,图2)。Ⅱ组、Ⅲ组、Ⅳ组患者房水中IL-23的表达水平较Ⅰ组明显升高,且Ⅱ组、Ⅲ组、Ⅳ组之间两两比较差异均有统计学意义(P<0.05)。
表1 四组患者基本资料
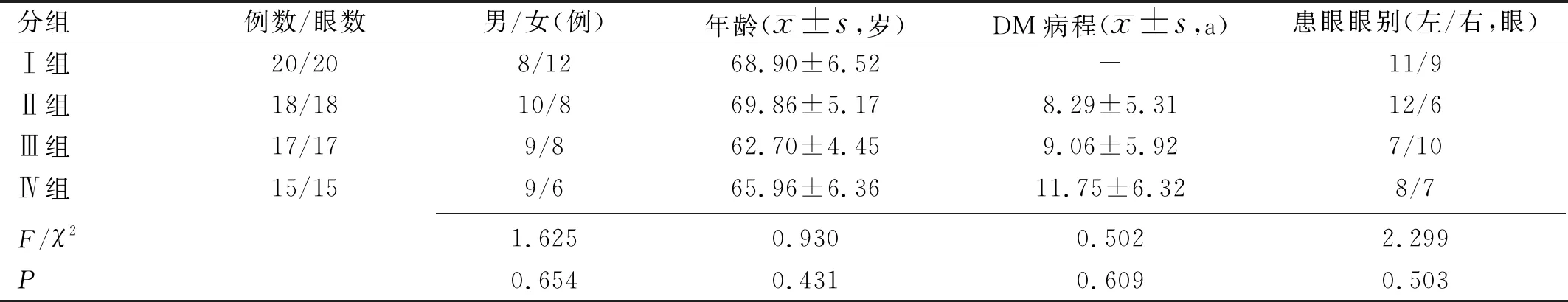
分组例数/眼数男/女(例)年龄( x±s,岁)DM病程( x±s,a)患眼眼别(左/右,眼)Ⅰ组20/208/1268.90±6.52-11/9Ⅱ组18/1810/869.86±5.178.29±5.3112/6Ⅲ组17/179/862.70±4.459.06±5.927/10Ⅳ组15/159/665.96±6.3611.75±6.328/7 F/χ21.6250.9300.5022.299P0.6540.4310.6090.503
注:Ⅰ组:单纯年龄相关性白内障患者;Ⅱ组:年龄相关性白内障合并单纯DM患者;Ⅲ组:年龄相关性白内障合并NPDR患者;Ⅳ组:年龄相关性白内障合并PDR患者。

图2ELISA法检测IL-17的表达bP<0.01vsⅠ组;dP<0.01vsⅡ组;eP<0.05vsⅢ组。
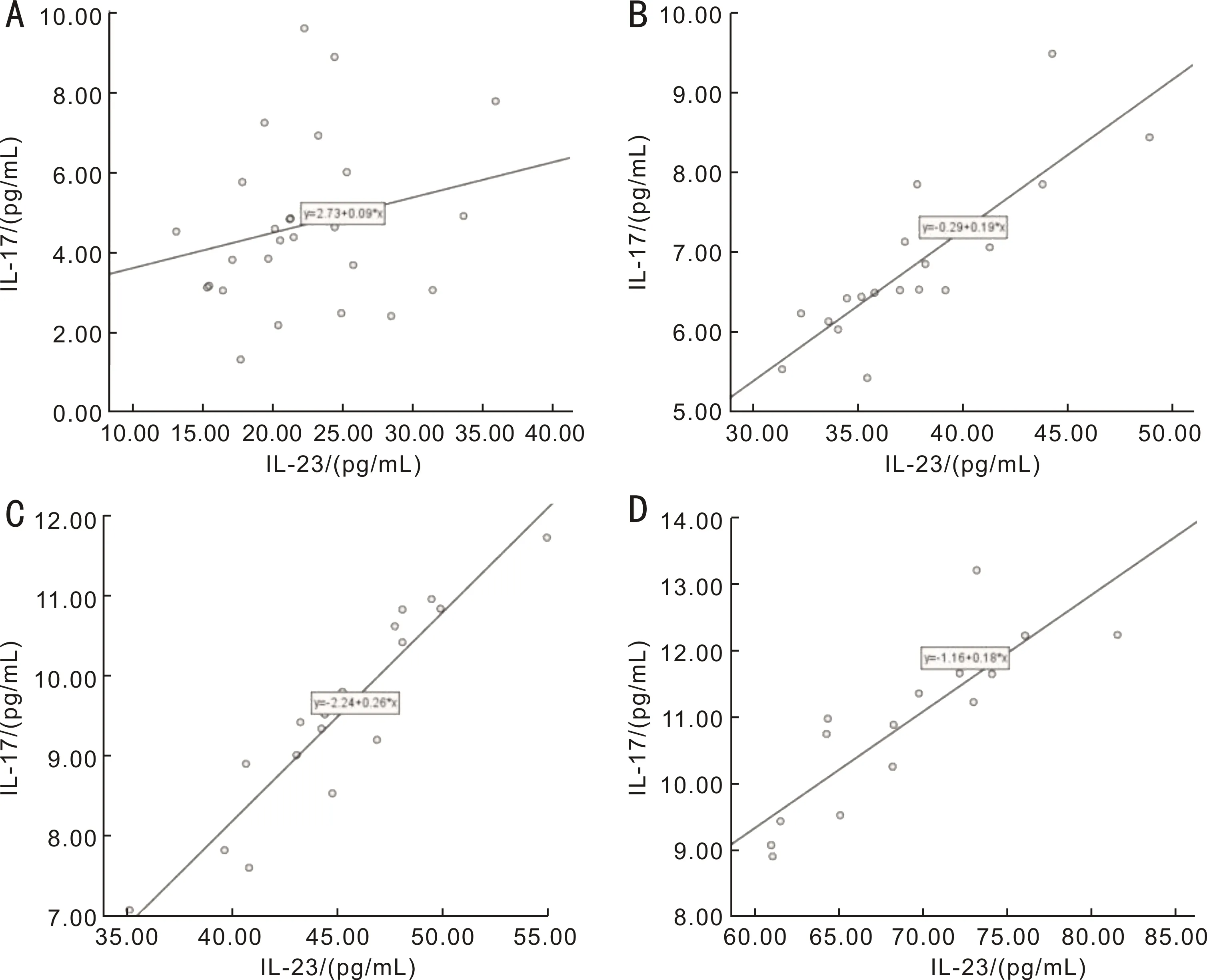
图3房水中IL-17与IL-23水平的相关性分析散点图A:Ⅰ组;B:Ⅱ组;C:Ⅲ组;D:Ⅳ组。
2.3房水中IL-17与IL-23水平的相关性分析Pearson相关性分析结果显示,Ⅰ组患者房水中IL-17与IL-23水平无明显相关性(r=0.24,P>0.05),而Ⅱ组、Ⅲ组、Ⅳ组患者房水中IL-17与IL-23水平均呈正相关(r=0.84、0.94、0.85,均P<0.01),提示DM患者房水中IL-23浓度的上升,可能会促进IL-17的分泌(图3)。
3讨论
随着近年来人民生活水平和饮食习惯的改变,我国DM患者逐年增多。DR作为DM最为常见的慢性微血管并发症,其引起的糖尿病性黄斑水肿(diabetic macular edema,DME)和PDR是引起工作人群视力损伤或致盲的主要原因。近年我国在北京、上海、山东、山西、广州等地开展了以社区人群为基础的DR流行病学研究,结果显示在DM患者中,DR的患病率已高达24.7%~37.5%[8],因此寻找早期诊断和治疗DR的临床研究成为当前的热点。现已证实,DR以视网膜微血管内皮损伤为始动因素,但具体如何启动机制不明。目前普遍认为,慢性持续炎症反应参与视网膜血管内皮损伤,白细胞在DR发生发展过程中起着关键作用,进而提出DR是一种“炎症性疾病“的概念[9-10]。体内长期高血糖首先引起视网膜血管血流动力学改变,从而引起白细胞趋化、聚集、粘附、分泌炎性因子,造成视网膜血管内皮损伤、血管通透性增加、血-视网膜屏障(blood-retinal barrier,BRB)破坏。随后,白细胞对视网膜局部组织进一步浸润,释放大量的炎症介质产生炎症放大效应,引起视网膜出血、渗漏、微动脉瘤形成、血管闭塞等病理病变(临床NPDR期)。最后,持续的视网膜缺血、缺氧,局部炎症的不断加剧,诱导血管内皮生长因子(vascular endothelial growth factor,VEGF)产生,产生视网膜新生血管、玻璃体积血、牵拉性视网膜脱离等病理改变(临床PDR期)。临床上,通过收集标本发现在DM患者血清、患眼房水及玻璃体中,炎症因子、粘附分子及趋化因子的表达水平往往是显著上调的,与DR的发生与进展密切相关[7,11-13]。同时,从治疗效果反馈上也证实,对于顽固性DME,单纯玻璃体腔注射抗VEGF药物难以奏效,往往需要联合应用糖皮质激素。主要机制在于,糖皮质激素可下调多种炎症因子的表达、干预炎症反应信号通路、减轻视网膜炎症反应,促进BRB功能的恢复,延缓DR的进展[14]。因此,进一步研究炎症因子、炎症反应与DR的相关性,对于阐明DR的发病机制及探寻临床治疗DR的方法均具有重要意义。
IL-17作为强大的促炎因子,具有强大的招募中性粒细胞和促进多种细胞释放炎症因子的作用。其可以促进多种炎症因子如IL-6、IL-8、肿瘤坏死因子-α、前列腺素E2等及趋化因子、粒细胞集落刺激因子等的表达,更重要的是可以刺激中性粒细胞和其他炎症细胞的聚集、贴壁,最后突破血管内壁、局部浸润组织而产生病理损伤[3,15]。IL-23作为IL-12家族的新成员,主要由树突状细胞、吞噬细胞、小胶质细胞等抗原提呈细胞产生[4,16]。与IL-12生物活性不同的是,IL-23与Th细胞膜上的IL-23受体结合后,不仅可以促进Th细胞向Th17分化、维持Th17增殖和存活,同时可诱导和促进IL-17的分泌,激活IL-23/IL-17通路,产生炎症级联反应。在以往的视网膜相关炎性疾病研究中如葡萄膜炎、缺血性视网膜病变、年龄相关性黄斑变性等,均发现IL-23/IL-17通路参与介导视网膜病理损伤过程[4,17-18]。同样在DR的研究中,Takeuchi等[11]通过分别采集需要行玻璃体切除手术患者的血清和玻璃体液,检测发现PDR患者玻璃体液中炎性因子(IL-4、IL-6、IL-17A、IL-21、IL-22等)的检出率及浓度明显高于该患者自身血清;同时与黄斑前膜、黄斑裂孔等其他眼底疾病患者相比,PDR患者玻璃体液中这些炎症因子的表达水平也是明显升高的,差异具有显著性,提示Th2和Th17细胞分泌的相关炎症因子及炎症反应参与PDR的发生、发展。王静等[12]检测DM患者血清中IL-17的表达,结果显示DR组患者血清IL-17的表达水平显著高于NDR组(P<0.05),经Logistic回归分析显示血清IL-17是DR的独立危险因素,提示检测血清IL-17水平对DR的预测具有一定临床意义。其机制可能是IL-17通过介导视网膜局部炎症反应,加剧胰岛素抵抗或胰岛细胞凋亡,进而直接或间接参与视网膜微血管病变。Xu等[19]通过链脲酶素(streptozotocin,STZ)诱导建立DR大鼠模型,采用逆转录PCR和ELISA法分别检测IL-17A mRNA和蛋白在视网膜上的表达水平,流式细胞仪检测IL-17A+CD4+细胞在外周血单核细胞(peripheral blood mononuclear cells,PBMCs)中的比例,结果显示DR组大鼠IL-17A+CD4+细胞在PBMCs的比例明显高于正常对照组,IL-17A蛋白在血清及视网膜上的表达也明显增强。同时,经IL-23Rp19抗体玻璃体腔注射干预1wk后发现DR组大鼠视网膜色素上皮细胞排列较前紧密,BRB功能恢复,IL-17A蛋白的表达水平也随之下降,推测通过抑制IL-23的表达可下调IL-17的分泌,进而减轻DR的视网膜炎症反应。上述临床和实验研究均提示,IL-23、IL-17在DR患者血清、房水及玻璃体液中呈高表达状态,而通过干预IL-23可以降低IL-17的表达,进而减轻、延缓DR的发生发展。本研究结果与上述报道相一致,但对于IL-17、IL-23等炎症因子在房水中的动态变化规律及其与DR严重程度的相关性,目前还未见相关研究和文献报道。
由于伦理的原因,往往无法从DR患者玻璃体、视网膜组织中取出大量反映视网膜中IL-23、IL-17表达情况的标本。房水是一种包含多种细胞因子的生物活性复合体,眼内产生的各种细胞因子可通过多种途径进入其中,在一定程度上反映其在眼内组织的表达情况,而且采集房水相对方便、可重复。因此本研究选取2型糖尿病合并年龄相关性白内障患者为研究对象,并根据DR的临床分级进行分组,分别收集房水,通过ELISA法检测房水中IL-23、IL-17的表达水平以间接反映两者在玻璃体、视网膜的表达情况。本研究结果显示,各组患者房水中IL-23、IL-17均有表达,但随着DR病情的严重,两者的表达水平显著升高。同时,相关性分析发现,单纯年龄相关性白内障患者房水中IL-17与IL-23的表达无明显相关性(r=0.24,P>0.05),而DM患者房水中IL-17与IL-23的表达均呈正相关。这说明DM患者房水中IL-23的高表达可能相应促进了IL-17的分泌,两者长期在眼内的高表达产生协同作用,加剧DR病情的发展,这一检测结果为临床DR的早期诊断和后期治疗提供了新的思路。分析其机制可能是IL-23/IL-17通路通过促进炎性因子的分泌加重视网膜炎症反应,引起视网膜血管内皮细胞和周细胞凋亡,下调视网膜紧密连接蛋白的表达,破坏BRB引起视网膜血管渗漏、出血等[20],最终导致DME和PDR。
此外,我们发现,IL-23、IL-17在DR患者房水中呈高表达,且两者表达的水平随着DR的严重程度呈增高的趋势,提示IL-23/IL-17通路可能作为视网膜炎症反应的主要途径之一参与DR的病理损伤。同时,DM患者房水中IL-17与IL-23水平呈正相关,临床上可以通过检测房水IL-23等炎性因子的水平(玻璃体腔注药时)为下一步是否需要对DR患者加强抗炎治疗和推测预后提供客观依据[21]。但由于本研究样本量较小,未将各组患者白内障的严重程度、眼底黄斑水肿等情况纳入讨论和分析,且仅检测了房水,研究结果可能存在偏倚性,还需要大样本、多中心的研究证实。更重要的是DR本身是一个复杂的病理过程,是多种因素、多种途径综合作用的结果,IL-23和IL-17在眼内由哪种细胞分泌、信号通路如何、介导炎症反应的具体机制等问题也需进一步研究。
- 国际眼科杂志的其它文章
- Serum vitamin D in Indian children with vernal keratoconjunctivitis
- 汉族与哈萨克族PACG患者房水及小梁网中TGF-β2的表达与滤过泡形成的研究
- 基于Nrf2/Keap1/ARE通路研究槲皮素对小鼠年龄相关性黄斑变性的保护作用
- Deep anterior lamellar keratoplasty versus penetrating keratoplasty in the treatment of stromal corneal dystrophies
- 五种方法测量近视患者中央角膜厚度的研究
- 常见泪腺上皮性肿瘤中EGFL7的表达及其与血管生成和细胞增殖活性的相关性研究

