薏苡组培快繁技术及遗传变异研究
王兰兰, 徐 剑, 赵德刚,2, 赵懿琛
(1.贵州大学山地植物资源保护与种质创新省部共建教育部重点实验室/贵州省农业生物工程重点实验室/生命科学学院/茶学院, 贵阳 550025;2.国家农业部植物新品种DUS测试贵阳分中心/贵州省农业科学院, 贵阳 550006)
薏苡(CoixLacryma-jobiL.)为一年或多年生禾本科药食同源小杂粮作物,富含氨基酸、蛋白质和脂肪等营养物质,其种子、根、茎和叶均可入药,还可用作食品、护肤品以及工艺品加工原料[1-4],有“世界禾本科植物之首”和“营养保健滋补之首”的美誉[5,6]。贵州省是薏苡主产地之一,薏苡产量和种植面积均为全国第一。兴仁小白壳为贵州省代表性品种,原产于贵州兴仁县,其品质好,糯性强,但易感染黑穗病导致产量低[7],抗性差。目前薏苡主要是通过种子进行繁殖,低温保存进行保种,但是种子储藏时间短、种源有限及发芽率低,造成薏苡产量及品质下降,严重制约产业发展,不利于优质资源的种质保存[8,9]。组织培养技术具有繁殖系数高、周期短、不受季节和自然条件限制、便于大规模生产等优点被广泛运用于植物的离体快速繁殖[10]。因此,利用组培快繁技术培养组培苗,建立高效的组培快繁体系,对脱毒组培苗生产、遗传转化、优质薏苡种质资源的保存和开发利用等方面都具有参考价值。
目前薏苡的组培快繁体系主要利用薏苡幼嫩花序、花药、叶片、气生根和胚轴获得愈伤组织和分化出再生植株[11-14],存在愈伤组织诱导率低,愈伤组织分化并形成完整植株过程较复杂且周期长等问题。而利用芽顶端分生组织作为外植体进行快繁研究,不经过愈伤组织,比经过愈伤组织后再转移到分化培养基生根发芽要快。利用芽顶端分生组织作为外植体直接诱导分化生芽的研究已在高粱、玉米等作物上成功获得植株[15,16],且诱导率高、培养周期短,但在薏苡中还未见报道。本研究以兴仁小白壳芽顶端分生组织为外植体,建立高效快速的快繁体系,同时对继代组培苗进行遗传稳定性检测,为薏苡种质资源保存及后续的遗传转化体系建立奠定基础。
1 材料与方法
1.1 研究材料
供试薏苡材料为兴仁小白壳,由贵州省农科院亚热带作物研究所惠赠,贵州大学农业生物工程研究院繁殖并保存。
1.2 实验方法
1.2.1兴仁小白壳外植体消毒
选取种壳完整、饱满且无虫眼的兴仁小白壳薏苡种子为材料,将其放入2%洗涤剂溶液中搓洗,自来水冲洗干净后放入沸水中3~5 s,取出立即放入50%多菌灵溶液中浸泡6~8 h,最后用自来水冲洗掉多菌灵溶液后放入育苗盘中,置于28 ℃条件下催芽培养,待茎尖长至2~3 cm时,切取约3 mm长的芽顶端外植体作为组培材料(图1 A)。于超净工作台中用75%酒精和0.2%升汞进行消毒处理,酒精处理时间设置3个水平(10 s、20 s、30 s),升汞处理时间设置3个水平(3 min、5 min、7 min),共9组,最后用无菌吸水纸吸干表面多余水分,用于后续实验。
1.2.2兴仁小白壳丛生芽和生根诱导培养基筛选及生长条件
将消毒的茎尖从分生组织上、下端各0.3~0.4 cm部位(包含芽顶端分生组织、部分胚芽鞘和部分中胚轴)切下,分别接种于根据正交设计的3个浓度水平的生长素NAA(0 mg·L-1、0.5 mg·L-1、1.0 mg·L-1)和3个浓度水平的细胞分裂素6-BA(3 mg·L-1、6 mg·L-1、9 mg·L-1)组合的MS培养基中,共9组。丛生芽生根培养基为含有不同浓度梯度的NAA及IBA(0.1 mg·L-1、0.3 mg·L-1、0.5 mg·L-1、1.0 mg·L-1),共10个处理。所配制培养基中,MS粉浓度为4.443 g·L-1,蔗糖为3%,琼脂为0.7%,pH值为5.8~6.0;材料培养条件为:温度24~26 ℃,光照强度为2 000 lx,光照周期每天为16 h。培养30 d后统计丛生芽诱导率,30 d后统计不定根的条数。
1.2.3炼苗移栽
待生根数为3~4根,根长为 3~4 cm时,将根多粗壮且长势较好的幼苗移至自然条件下,开盖加水炼苗,炼苗期间保持水分淹没培养基的表面,炼苗2 d后用镊子轻轻取出并将根部的培养基洗净,移栽于不同比例的基质中,30 d后统计移栽成活率。
1.2.4继代组培苗遗传变异检测
兴仁小白壳继代6代,每代选取3株长势相近的组培苗用CTAB法进行DNA提取并进行质量检测,参照文献[17]发表的SSR引物序列筛选出4对多态性较好的引物进行SSR-PCR扩增,1.2%琼脂糖凝胶电泳进行SSR遗传变异检测。PCR反应体系:DNA(100 ng·μL-1)1.0μL,引物0.2μL,dNTP(2.5 mmol·L-1)1μL,10×Taq buffer 1μL,Mg2+(25 mmol·L-1)0.8μL,Taq酶(5 U·μL-1)0.05μL,ddH2O 5.75μL。PCR反应条件:94 ℃预变性4 min,94 ℃变性30 s,50~60 ℃退火30 s,72 ℃延伸30 s;循环35次;72 ℃延伸7 min;在12 ℃条件下恒定。
表3 不同激素配比对丛生芽生根诱导效果的影响

组号培养基IBA/(mg·L-1)NAA/(mg·L-1)生根数/个生根率/%生根情况1MS——2.2±0.08c40无根毛,细长2——1.8±0.20c52有根毛,细长30.1—2.1±0.06c45无根毛,根长40.3—2.6±0.30bc57无根毛,根长,根较粗50.5—1.9±0.20c68根毛少,根长,根稍粗61/2MS1.0—2.0±0.30c77根毛多密,根长粗7—0.12.1±0.50c85根毛多密,根长8—0.33.1±0.50b100根毛多密,根较长,根粗9—0.53.9±0.40a100根毛多密,根较长、根粗10—1.03.8±0.10a100根毛多密,根较长、根粗
1.2.5数据处理
数据资料采用Microsoft Excel软件进行统计,采用SPSS 23.0软件进行数据分析。
2 结果与分析
2.1 不同消毒处理条件对茎尖污染率和存活率的影响
严格的消毒灭菌是薏苡组织培养的关键,不同消毒处理方式对茎尖的污染率和存活率存在影响(表1)。茎尖在利用75%酒精结合0.2%升汞处理后,其污染率随着消毒试剂作用时间增长而呈逐渐降低的趋势,当外植体在75%酒精消毒30 s,0.2%升汞处理7 min后存活率为92%,且污染率为8%,因此本研究得出兴仁小白壳薏苡茎尖最佳消毒方式为75%酒精处理30 s、0.2%升汞处理7 min。
表1 不同消毒时间组合对茎尖消毒效果的影响

组号75%酒精/s0.2%升汞/min污染率/%存活率/%110315.384.7210512.387.7310712.088.0420314.086.0520512.388.7620711.387.7730314.385.783059.091.0
2.2 不同激素组合及顶端优势去除次数对丛生芽诱导影响
在兴仁小白壳丛生芽诱导研究中,发现需要对茎尖进行多次切取去除顶端优势才能诱导产生大量丛生芽(图1 B~I,表2)。对芽的顶端分生组织上、下各0.3~0.5 cm处进行第1、2次切除后,丛生芽诱导效果在不同激素处理下差异不显著;随着对顶端分生组织切除次数的增加,繁殖系数不断上升,当切除4次时繁殖系数差异显著。不同激素组合对芽的诱导情况差别较大,不同浓度的6-BA和NAA结合配比均能诱导丛生芽分化,低浓度的NAA(0.5 mg·L-1)和高浓度的6-BA(9 mg·L-1)配比有利于芽的分化和增殖,且在进行第4次切除后繁殖系数达到2.9,表明MS+0.5 mg·L-1NAA+9 mg·L-16-BA为促进兴仁小白壳丛生芽诱导的最佳培养基。
表2 不同激素配比及去除次数对丛生芽诱导的影响
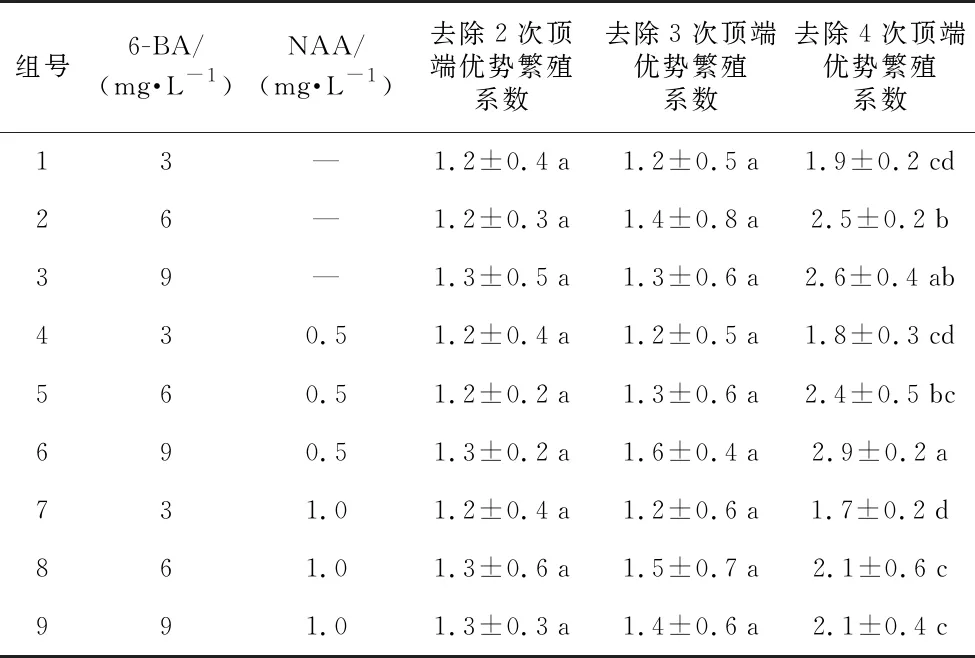
组号6-BA/(mg·L-1)NAA/(mg·L-1)去除2次顶端优势繁殖系数去除3次顶端优势繁殖系数去除4次顶端优势繁殖系数13—1.2±0.4a1.2±0.5a1.9±0.2cd26—1.2±0.3a1.4±0.8a2.5±0.2b39—1.3±0.5a1.3±0.6a2.6±0.4ab430.51.2±0.4a1.2±0.5a1.8±0.3cd560.51.2±0.2a1.3±0.6a2.4±0.5bc690.51.3±0.2a1.6±0.4a2.9±0.2a731.01.2±0.4a1.2±0.6a1.7±0.2d861.01.3±0.6a1.5±0.7a2.1±0.6c991.01.3±0.3a1.4±0.6a2.1±0.4c
注:不同小写字母表示在0.05水平差异显著。下同。
2.3 不同激素配比对丛生芽生根诱导的影响
不同激素组合对丛生芽根的诱导效果存在差异(表3)。结果表明,1/2 MS的生根率比MS培养基高12%,说明1/2 MS培养基更适合兴仁小白壳薏苡根的诱导。随着NAA和IBA浓度的增加,生根率不断提高,二者相比NAA的诱导效果高于IBA,且根的生长情况较好,在0.3 mg·L-1NAA时生根率达100%,说明兴仁小白壳丛生芽对NAA较为敏感,随着NAA浓度的增加,兴仁小白壳丛生芽的生根数在0.5 mg·L-1时达到最高,根的长势好(图1 J),而在1.0 mg·L-1NAA时,其生根数差异不显著,表明1/2 MS+0.5 mg·L-1NAA为促进兴仁小白壳生根的最佳生根培养基。
2.4 幼苗移栽
不同的炼苗基质对组培苗移栽成活率有显著影响(表4),炼苗2 d的幼苗移栽到不同基质,20 d对移栽幼苗的成活率进行统计,发现幼苗在只含珍珠岩的基质中成活率最低,生长最差,而随着珍珠岩在基质中的比例减少,幼苗的成活率逐渐增加且长势较好,其中营养基质∶珍珠岩比例为4∶1时,幼苗的成活率达到95%,生长较好(图1 K),为最佳移栽条件,待移栽的幼苗生长稳定后转移种植至实验室农场试验地,生长情况和正常种植一致(图1 L)。

注:A为含顶端分生组织的外植体;B为第1次切取的茎尖分生组织;C为培养7 d的茎尖;D为第2次切取的茎尖分生组织;E为第2次切取茎尖分生组织后生长至第10天的幼苗;F为第3次切取的茎尖分生组织;G为茎尖分生组织诱导第20天的丛生芽;H为第4次切取茎尖分生组织;I为茎尖分生组织诱导第20天的丛生芽;J为诱导生根至第14天的材料;K为移栽成活组培苗;L为移栽成至实验室农场种植地材料。
表4 不同移栽基质配比

组号营养基质∶珍珠岩成活率/%生长情况10∶145.0茎杆细,矮,叶窄21∶177.5茎杆稍粗,稍高,叶窄32∶175.0茎杆稍粗,高,叶宽43∶185.0茎杆粗壮,高,叶宽54∶195.0茎杆粗壮,高,叶宽
2.5 遗传稳定性SSR引物筛选及遗传变异检测
利用优化的SSR-PCR体系对23份不同地方的薏苡材料进行扩增,发现15对引物中的GBssrJT 32、GBssrJT 136、GBssrJT 149、GBssrJT 198 4对SSR引物扩出的条带多态性较高,条带扩增稳定且清晰(表5,图2)。研究结果表明,引物GBssrJT 32、GBssrJT 136、GBssrJT 149和GBssrJT 198分别有5、6、7、5条特异条带,因此可选用该4对SSR引物对继代6次的组培苗进行遗传变异检测。兴仁小白壳组培苗继代6代,每代选取3株长势相近的组培苗叶片进行DNA提取,并进行SSR-PCR多态性检测,经凝胶电泳检测结果显示(图3),继代苗的DNA扩出的条带清晰,条带大小均在预期的205~289 bp之间,且条带均在相同的位置,说明继代6代的幼苗在丛生芽组培快繁过程中并没有发生变异,与亲本的多态性一致,进一步说明本研究对薏苡组培苗的研究可应用于种苗的大规模生产。
表5 4对SSR多态性引物

引物名称引物序列等位基因/个等位基因大小范围/bpGBssrJT32F:GATGGATCGAGACAAGCGR:TGGAGGTGTGTGCCTACC5263~270GBssrJT136F:GTGTGTGCCAGTGATCCAR:ATTCCCGGAACGACCTT6205~289GBssrJT149F:AAGCAGAAGAACTCCGCCR:GGAATCGATGCAACCAAG7230~279GBssrJT198F:ATCTGTCGTCGTTGCTGCR:CACGCACCTCCGACTC5232~248

注:M为DL 2000;1~23依次为兴仁小白壳,黔薏苡1号,黔薏苡2号,野生薏苡1-1,野生薏苡1-2,野生薏苡2,野生薏苡3,野生薏苡4,黔选02,黔选03,安薏苡,安薏苡1号,仙薏苡L 5,仙薏苡L 8,师薏苡1号,临沂薏苡,盘县五谷,白薏米,辽宁薏苡,文薏苡,金沙1号,盘县薏苡L 10,浦薏苡6号;A为GBssrJT 32;B为GBssrJT 136;C为GBssrJT 149;D为GBssrJT 198。

注:M为DL 2000;a~f依次为第1代至第6代的继代苗材料;1,2,3为每一代幼苗的3次重复。
3 讨 论
本研究由茎尖诱导丛生芽,经过芽发育和生根培养后获得再生植株,与利用幼嫩花序、花药、叶片、气生根和胚轴等诱导胚性愈伤组织并再生植株相比[11-14],该体系周期短,频率高,且不受季节限制,对薏苡种质资源的保存具有一定的促进作用。
无菌体系的建立是植物组织培养的关键,因此外植体消毒是影响试验成败的关键环节。目前对薏苡外植体的消毒方式通常采用表面消毒,一般采用75%酒精结合10%次氯酸钠或0.1%升汞进行消毒[10],本研究以75%酒精结合0.2%升汞对兴仁小白壳茎尖进行消毒,发现污染率随着消毒试剂作用时间增长而呈逐渐降低的趋势,当外植体在酒精消毒30 s,升汞处理7 min时存活率达到92%且污染率下降到8%,这可能与升汞浓度有着直接关系,且消毒时间相对于已报道的薏苡外植体消毒时间大为缩短。这可能是由于在升汞的浓度增加所导致,也可能是薏苡品种不同的缘故,该消毒方式为薏苡组织培养提供了一定的理论基础。
激素的选择在丛生芽和生根诱导起着关键作用,不同培养阶段所需的激素种类及配比不同,在丛生芽诱导过程中,6-BA起着重要的作用,而NAA对生根则是必要的,两者具有相互增益效应[17],其原因可能是薏苡茎尖已经是高度分化的器官,细胞分裂素在细胞分裂时起活化作用。本研究发现,诱导培养基为MS+9 mg·L-16-BA+0.5 mg·L-1NAA时丛生芽诱导率最高。在丛生芽的诱导中除了对激素浓度进行调整外,本研究首次中对茎尖进行多次顶端优势去除处理从而诱导产生更多的丛生芽,发现在顶端优势去除第4次在0.5 mg·L-1NAA、9 mg·L-16-BA时不定芽的繁殖系数高,可能是由于禾本科植物存在极强的顶端优势所导致。与此同时,随着NAA浓度上升,丛生芽率呈上升后又下降的趋势,这可能是由于较高浓度的NAA对生长点启动和成芽不利所引起。在诱导丛生芽生根过程中,发现1/2 MS结合NAA的培养基更适合诱导丛生芽生根,NAA的浓度为0.3 mg·L-1时,其生根率达100%,并且随着NAA浓度的增加生根数呈上升又下降趋势,说明过高浓度的NAA对组培苗生根有抑制作用。
体细胞无性系变异是植物组织培养过程中的普遍现象[19],可作为植物遗传改良的一种新来源,但体细胞变异也会导致植物的一些优良性状丢失,对植物材料的组培快繁、种质保存以及遗传转化等技术来说应该尽量避免[20]。目前SSR分子标记技术已广泛的用于上饶早梨、菊芋和红芽芋等植物的遗传变异检测[21-23],但对薏苡组培苗的遗传变异研究未见报道。本研究从已公布的薏苡SSR引物中筛选出4对多态性较好且稳定性高的SSR引物,用该4对引物对6次继代培养后的植株PCR扩增显示其谱带与亲本均保持一致。表明兴仁小白壳组培苗在DNA水平上并未发生变异,遗传物质稳定。兴仁小白壳茎尖组培快繁体系的研究,为薏苡的快速繁殖和大规模生产及推广提供了一定的理论基础。

