肉苁蓉总苷在人工胃、肠液中的代谢转化研究
王昕蕾 刘博男 张蒙蒙 刘贵玉 胡扬 孙向明 李文兰


摘 要 目的:研究肉蓯蓉总苷在人工胃、肠液中的代谢转化,推测其在体内的代谢转化途径。方法:采用超高效液相色谱串联飞行时间质谱法。色谱柱为ACQUITY UPLC BEH,柱温为25 ℃,流动相为0.2%甲酸水-乙腈溶液(梯度洗脱),流速为0.2 mL/min,检测波长为330 nm;离子源为电喷雾离子源,质荷比(m/z)为50→1 000;在正、负离子模式下,对肉苁蓉总苷在人工胃、肠液中的代谢成分进行鉴定分析,并结合文献推测肉苁蓉总苷在人工胃、肠液中代谢途径。结果:肉苁蓉总苷经人工胃液代谢后,共推测出69个成分,其中14个原型成分(如芥子醛葡萄糖苷、胡萝卜苷等)、55个代谢成分(如Methyl-O-Kankanoside J、Methyl-O-Kankanoside E等),推测其代谢途径有甲基化、去甲基化、羟基化、甲氧基化、乙酰化、硫酸化、葡萄糖醛酸化。肉苁蓉总苷经人工肠液代谢后,共推测出 90个成分,其中 4个原型成分(如Kankanoside M、Kankanoside L等)、86个代谢成分(如 Methyl-O-Kankanoside、Methyl-O-Kankanoside E等),推测其代谢途径有甲基化、去甲基化、羟基化、去羟基化、甲氧基化、乙酰化、硫酸化、葡萄糖醛酸化。结论:本研究初步推测肉苁蓉总苷在人工胃、肠液中可能通过甲基化、去甲基化、羟基化等多种途径进行代谢转化,可为肉苁蓉总苷的体内代谢转化研究提供参考依据。
关键词 肉苁蓉总苷;代谢;人工胃液;人工肠液;超高效液相色谱串联飞行时间质谱法;成分分析
中图分类号 R917 文献标志码 A 文章编号 1001-0408(2020)01-0053-09
DOI 10.6039/j.issn.1001-0408.2020.01.10
ABSTRACT OBJECTIVE: To study the metabolic transformation of total glycosides of Cistanche deserticola in artificial gastric and intestinal juice, and to speculate its metabolic transformation pathway in vivo. METHODS: UPLC/Q-TOF-MS was adopted. The determination was performed on ACQUITY UPLC BEH column with mobile phase consisted of 0.2% formic acid water-acetonitrile (gradient elution) at the flow rate of 0.2 mL/min. The detection wavelength was set at 330 nm, and column temperature was 25 ℃. The ion source was electrospray ion source, and mass to charge ratio (m/z) was 50→1 000. In the positive and negative ion mode, the metabolic components of the total glycosides of C. deserticola in artificial gastric and intestinal juice were identified analysis, and combined with the literature, the metabolic pathway of total glycosides of C. deserticola in artificial gastric and intestinal juice was speculated. RESULTS: After the total glycosides of C. deserticola were metabolized by artificial gastric juice, and a total of 69 components were estimated, including 14 prototype components (such as Mustard aldehyde glucoside, daucosstorol) and 55 metabolic components (such as Methyl-O-Kankanoside J, Methyl-O-Kankanoside E), it is speculated that its metabolic pathways were methylation, demethylation, hydroxylation, methoxylation, acetylation, sulfation, and glucuronidation. After the total glycosides of C. deserticola were metabolized by artificial intestinal juice, a total of 90 components were estimated, including 4 prototype components (such as Kankanoside M, Kankanoside L) and 86 metabolic components (such as Methyl-O-Kankanoside, Methyl-O-Kankanoside E). It was speculated that its metabolic pathways were methylation, demethylation, hydroxylation, dehydroxylation, methoxylation, acetylation, sulfation and glucuronidation. CONCLUSIONS: This study preliminarily speculates that the total glycosides of C. deserticola may be metabolized by methylation, demethylation, hydroxylation and other metabolic pathway in artificial gastrointestinal juice, which may provide reference for the in vivo metabolic transformation of total glycosides of C. deserticola.
KEYWORDS Total glycosides of Cistanche deserticola; Metabolism; Artificial gastric juice; Artificial intestinal juice; UPLC/Q-TOF-MS; Component analysis
肉苁蓉为列当科植物肉灰蓉(Cistanche desertico La Y.C.Ma)或花肉灰蓉[Cistanche tubulosa(Schenk)Wight]的干燥带鳞叶的肉质茎[1]。始载于《神农本草经》,列为上品,性甘、咸、温,归肾、大肠经[2]。传统药理学研究表明,肉苁蓉具有补肾阳、益精血、润肠通便等作用[3]。现代药理学表明,其具有抗疲劳、抗衰老、增强机体免疫力及显著的拟雌激素作用[4-7]。目前,从肉苁蓉中已分离并鉴定出多种化学成分,主要有苯乙醇苷类、环烯醚萜苷类、木脂素类等,其中苯乙醇苷类是肉苁蓉中主要的活性成分[8-12]。为进一步追踪肉苁蓉总苷的代谢过程,本课题组采用超高效液相色谱串联飞行时间质谱技术,通过体外人工胃、肠液研究体系,揭示肉苁蓉总苷在体外经胃、肠转化代谢的规律,从体外角度阐明肉苁蓉总苷在胃、肠中的代谢过程,为进一步阐明其药效物质基础提供依据。
1 材料
1.1 仪器
Acquity超高效液相色谱仪、Waters 2695液相色谱系统、LE204E/02电子分析天平(美国奥豪斯国际有限公司);Neofuge 13R高速冷冻离心机(上海力申科学仪器有限公司); 1290型6530系列飞行时间质谱联用仪(美国安捷伦科技有限公司)。
1.2 药品与试剂
肉苁蓉总苷(本课题组参考文献[12]方法自制,含量以毛蕊花糖苷计为62.5%);毛蕊花糖苷(批号:111530-201411,纯度:>98%)、松果菊苷(批号:111670-201304,纯度:>98%)均购自中国食品药品检定研究院;胃蛋白酶(批号:417B0314,活力:3 000~ 3 500 U)、胰酶(批号:417B0314,活力:3 000~3 500 U)均购自国药集团北京试剂有限公司;甲醇、乙腈、甲酸均为色谱纯;水为纯净水。
2 方法与结果
2.1 空白灌流液的制备
精密称取7.80 g NaCl、0.35 g KCl、0.37 g CaCl2、1.37 g NaHCO3、0.32 g NaH2PO4、0.02 g MgCl2、1.40 g葡萄糖,加水定容至1 000 mL量瓶中,调pH至7.40,即得空白灌流液。
2.2 供试品溶液的制备
取肉苁蓉总苷100 g,加入空白灌流液定容至100 mL,再用0.22 ?m滤膜过滤,即得供试品溶液。
2.3 人工胃、肠液的制备
2.3.1 人工胃液的制备 参考文献[13]方法,取16.4 mL 9.5%HCl,加入800 mL水以及胃蛋白酶10 g,充分混匀后加水稀释至1 000 mL,即得人工胃液。
2.3.2 人工肠液的制备 参考文献[13]方法,取6.8 g KH2PO4,加500 mL水使之溶解,采用0.1 mol/L NaOH溶液调pH至6.8;另取10 g胰酶,加水适量溶解,再将上述两液混合,加水稀释至1 000 mL,即得人工肠液。
2.4 孵育樣品的制备
2.4.1 人工胃液孵育样品的制备 取“2.3.1”项下的人工胃液100 mL预温孵5 min后,加入“2.2”项下的供试品溶液5 mL,于37 ℃下预孵育,1 h后取样7 mL,立即用0.1 mol/L NaOH溶液调pH至6.7终止反应,加水定容至10 mL,再用0.22 ?m滤膜过滤,即得。
2.4.2 人工肠液孵育样品的制备 取“2.3.2”项下的人工肠液100 mL预温孵5 min后,加入“2.2”项下的供试品溶液5 mL,于37 ℃下预孵育,4 h后取样7 mL,立即用0.1 mol/L NaOH溶液调pH至6.7终止反应,加水定容至10 mL,再用0.22 ?m滤膜过滤,即得。
2.5 色谱与质谱条件
2.5.1 色谱条件 色谱柱:ACQUITY UPLC BEH(100 mm×2.1 mm,1.7 ?m);流动相:0.2%甲酸水(A)-乙腈溶液(B),梯度洗脱(0~2 min,10%→12%B;2~7 min,12%B;7~10 min,12%→17%B;10~17 min,17%→23%B;17~18 min,23%B;18~19 min,23%→25%B;19~20 min,25%→10%B);流速:0.2 mL/min;检测波长:330 nm;柱温:25℃;进样量:5 ?L。
2.5.2 质谱条件 离子源:电喷雾离子源,正、负离子切换检测;干燥气温度:30 ℃;雾化气压力:30 psi;干燥气流速:8.0 L/min;毛细管电压:3.5 kV;鞘气流速:12.0 L/min;鞘气温度:400 ℃;扫描范围:质荷比(m/z)50→ 1 000;流速:0.2 mL/min。
2.6 肉苁蓉总苷在人工胃液中的成分分析
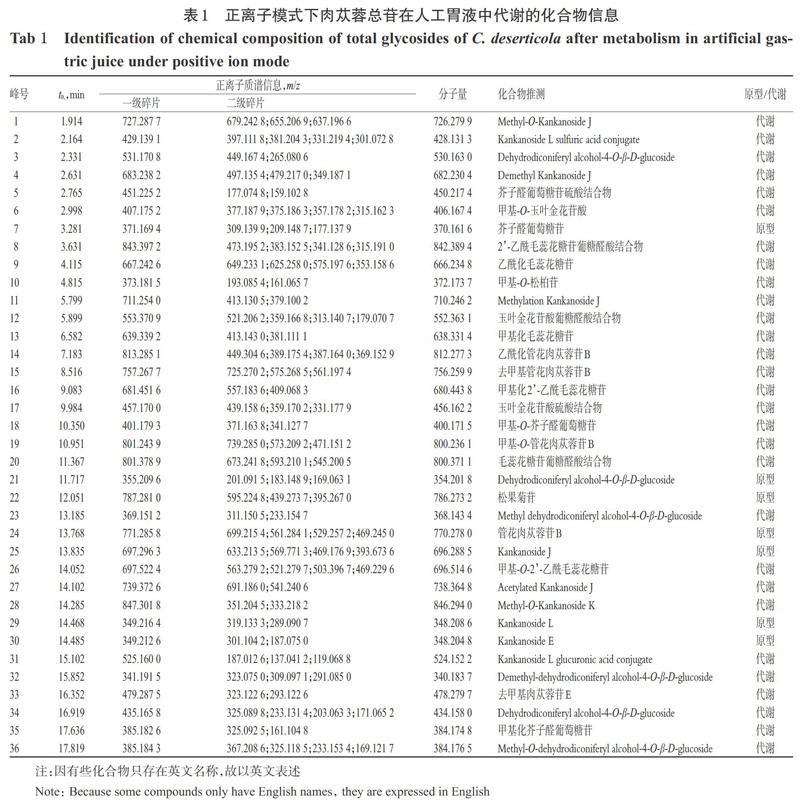
取“2.2”项下的供试品溶液、“2.4.1”项下的人工胃液孵育样品各1 mL,按“2.5”项下色谱与质谱条件于正、负离子模式下进样分析。应用超高效液相色谱串联飞行时间质谱技术对肉苁蓉总苷进行定性分析,通过与对照品的保留时间(tR)及一、二级质谱信息进行比较,利用Agilent Masshunter Qualitative Analysis B.07.00软件对数据进行处理,其中的准分子离子峰的m/z可初步判断化合物的分子量、元素组成和经验分子式,再结合数据库检索各级质谱信息和已有文献报道,对其化学成分进行了结构推测。正、负离子模式下各样品在人工胃液中代谢的总离子流图分别见图1、图2。
依据各色谱峰在正离子模式下得到的分子离子峰及其对应碎片离子所得的分子量与试验前期及相关文献报道[14-16]对比参考,共推测出36个化合物,其中7个原型成分(如芥子醛葡萄糖苷、松果菊苷)、29个代谢产物(如Methyl-O-Kankanoside J、乙酰化管花肉苁蓉苷B);负离子模式下共推测出33个化合物,其中7个原型成分(如Kankanoside M、胡萝卜苷)、26个代谢产物(如Methyl-O-Kankanoside E、羟基化丁香苷)。正、负离子模式下肉苁蓉总苷在人工胃液中代谢的化合物信息分别见表1、表2。
基于表1,笔者简述几种典型化学成分的MS/MS推导过程。
1号峰(tR=1.914 min)分子量为726.279 9,m/z 727.287 7为[M+H]+峰,m/z 679.242 8为[M+H-CH2O- H2O]+峰,m/z 655.206 9为[M+H-CH2O-C2H2O]+峰,m/z 637.196 6为[M+H-CH2O-C2H2O-H2O]+峰,推测其为Methyl-O-Kankanoside J。2号峰(tR=2.164 min)分子量为428.131 3,m/z 429.139 1为[M+H]+峰,m/z 397.111 8为[M+H-CH3OH]+峰,m/z 381.204 3为[M+H-CH2O-H2O]+峰,m/z 331.219 4為[M+H-SO3-H2O]+峰,m/z 301.072 8为[M+H-SO3-CH2O-H2O]+峰,推测其为Kankanoside L sulfuric acid conjugate;3号峰(tR=2.331 min)分子量为530.163 0,m/z 531.170 8为[M+H]+峰,m/z 499.147 4为[M+H-CH3OH]+峰,m/z 265.080 6为[M+H-C6H8O6- 3CH2O]+峰,推测其为dehydrodiconiferyl alcohol-4-O- β-D-glucoside葡糖醛酸结合物;4号峰(tR=2.631 min)分子量为682.230 4,m/z 683.238 2为[M+H]+峰,m/z 497.135 4为[M+H-C8H10O3-CH3OH]+峰,m/z 479.217 0为[M+H-C8H10O3-CH3OH-H2O]+峰,m/z 349.187 1为[M+H-C8H10O3-C5H8O5-H2O-CH2O]+峰,推测为Demethyl Kan- kanoside J;11号峰(tR=5.799 min)分子量为710.246 2,m/z 711.254 0为[M+H]+峰,m/z 379.100 2为[M+H-C7H8O2-C6H10O4-CH2O-CH3OH]+峰,推测其为Methylation Kankanoside J;14号峰(tR=7.183 min)分子量为812.277 3,m/z 813.285 1为[M+H]+峰,m/z 449.304 6为[M+H-C2H2O-C6H12O6-C6H6O2-CH3OH]+峰,m/z 389.175 4为[M+H-C2H2O-C9H6O2-C6H10O4-C3H6O3]+峰,m/z 387.164 0为[M+H-C2H2O-C9H6O2-C6H10O4-C2H4O2- CH3OH]+峰, m/z 369.152 9为[M+H-C2H2O-C9H6O2-C6H10O4-C2H4O2- CH3OH-H2O]+峰,推测为乙酰化管花肉苁蓉苷B。
基于表2,笔者简述几种典型化学成分的MS/MS推导过程。
1号峰(tR=1.333 min)分子量378.094 1,m/z 377.086 3为[M-H]-峰,m/z 303.163 4为[M-H-CH2O-CO2]-峰,推测其为Methyl-O-Kankanoside E;5号峰(tR=3.567 min)分子量334.091 1,m/z 333.083 3为[M-H]-峰,m/z 303.795 4为[M-H-CH2O]-峰,m/z 153.964 4为[M-H-C6H12O6]-峰,推测其为Demethyl Kankanoside E;7号峰(tR=3.751 min)分子量488.157 1,m/z 487.149 3为[M-H]-峰,m/z 423.111 5为[M-H-2CH3OH]-峰,m/z 393.270 5为[M-H-2CH3OH-CH2O]-峰,m/z 351.743 2为[M-H-C2H2O- C6H6O]-峰,推测其为乙酰化肉苁蓉苷G;10号峰(tR=3.917 min)分子量652.223 2,m/z 651.215 4为[M-H]-峰,m/z 523.911 8为[M-H-C6H6O2-H2O]-峰,m/z 495.036 0为[M-H-C8H10O2-H2O]-峰,m/z 443.420 3为[M-H-C5H10O5- C2H2O2]-峰,m/z 425.705 7为[M-H-C5H10O5-C2H2O2-H2O]-峰,推测其为去甲基管花苷B;11号峰(tR=4.468 min)分子量344.107 0,m/z 343.099 2为[M-H]-峰,m/z 313.191 4为[M-H-CH2O]-峰,m/z 279.452 0为[M-H-2CH3OH]-峰,m/z 251.829 3为[M-H-CH3OH-2CH2O]-峰,推测为甲基化巴尔蒂苷;14号峰(tR=7.485 min)分子量388.118 4,m/z 387.110 6为[M-H]-峰,m/z 295.296 8为[M-H- 2OCH2-CH3OH]-峰,推测其为羟基化丁香苷;17号峰(tR=9.853 min)分子量380.097 4,m/z 379.089 6为[M-H]-峰,m/z 361.515 0为[M-H-H2O]-峰,m/z 283.726 5为[M-H-C6H6-H2O]-峰,m/z 147.347 2为[M-H-SO3- C8H10O-CH2O]-峰,推测为红景天苷硫酸结合物;30号峰(tR=16.455 min)分子量726.516 3,m/z 725.508 5为[M-H]-峰,m/z 695.607 4为[M-H-CH2O]-峰,m/z 549.166 9为[M-H-C6H8O6]-峰,m/z 485.280 5为[M-H- C6H8O6-2CH3OH]-峰,推测其为Eucommin A glucuronic acid conjugate。
2.7 人工胃液中各化合物的代谢途径推测
肉苁蓉总苷在人工胃液中成分分析共推测出55个代谢物,根据总苷代谢相关文献[14-15]推测代谢途径主要有甲基化、去甲基化、羟基化、甲氧基化、乙酰化、硫酸化、葡萄糖醛酸化,表明肉苁蓉总苷在人工胃液中主要是以代谢物的形式存在。人工胃液中代谢产物的典型代谢途径见图3。
2.8 肉苁蓉总苷在人工肠液中代谢的成分分析
取“2.2”项下的供试品溶液、“2.4.2”项下的人工肠液孵育样品各1 mL,按“2.5”项下色谱条件与质谱条件于正、负离子模式下进样分析。正、离子模式下的总离子流图(人工肠液中)分别见图4、图5。
依据各色谱峰在正离子模式下得到的分子离子峰及其对应碎片离子所得的分子量与试验前期及相关文献报道对比参考[16-18],共推测出40个化合物,其中1个原型成分(如Kankanoside L)、39个代谢产物(如Methyl- O-Kankanside、甲基-O-芥子醛葡萄糖苷);负离子模式下共推测出50个化合物,其中3个原型成分(如Kankanoside M、巴尔蒂苷)、47个代谢产物(如乙酰化红景天苷、Methyl-O-Kankanside E)。正、负离子模式下人工肠液中各色谱峰的化学信息分别见表3、表4。
基于表3,笔者简述几种典型化学成分的MS/MS推导过程。
1号峰(tR=1.180 min)分子量为400.151 8,m/z 401.159 6为[M+H]+峰,m/z 311.261 4为[M+H-3CH2O]+峰,m/z 309.254 2为[M+H-2CH2O-CH3OH]+峰,m/z 279.093 3为[M+H-3CH2O-CH3OH]+峰,m/z 209.158 8為[M+H-CH2O-C6H10O5]+峰,推测其为甲基-O-芥子醛葡萄糖苷;2号峰(tR=1.196 min)分子量为260.148 5,m/z 261.156 3为[M+H]+峰,m/z 133.729 6为[M+H-SO3- CH2O-H2O]+峰,m/z 131.000 4为[M+H-SO3-CH3OH-H2O]+峰,m/z 115.054 5为[M+H-SO3-CH2O-2H2O]+峰,m/z 87.245 5为[M+H-SO3-2CH3OH-CH2O]+峰,推测其为D-葡萄糖硫酸结合物;3号峰(tR=3.280 min)分子量为530.284 3,m/z 531.292 1为[M+H]+峰,m/z 325.126 0为[M+H-C6H8O6-CH2O]+峰,推测为Dehydrodiconiferyl alcohol-4-O-β-D-glucoside glucuronic acid conjugate;4号峰(tR=3.314 min)分子量为858.460 8,m/z 859.468 6为[M+H]+峰,m/z 649.571 3为[M+H-C2H2O-C9H12O3]+峰, m/z 633.092 6为[M+H-C2H2O-C9H12O4]+峰,m/z 585.764 0为[M+H-C2H2O-C9H12O4-CH2O-H2O]+峰,m/z 561.751 1为[M+H-C2H2O-C6H6O2-C6H10O4]+峰,推测其为Acetylated Kankanoside K;5号峰(tR=3.464 min)分子量为340.091 0,m/z 341.098 8为[M+H]+峰,m/z 309.254 1为[M+H- CH3OH]+峰,m/z 279.094 3为[M+H-CH3OH-CH2O]+峰,推测其为Demethyldehydrodiconiferyl alcohol-4-O-β-D-glucoside;7号峰(tR=3.847 min)分子量为370.257 5,m/z 371.265 3为[M+H]+峰,m/z 279.065 6为[M+H-CH3OH- 2CH2O]+峰,推测其为 Hydroxylated dehydrodiconiferyl alcohol-4-O-β-D-glucoside;12号峰(tR=9.833 min)分子量为368.215 6,m/z 369.223 4为[M+H]+峰,m/z 309.254 5为[M+H-2CH2O]+峰,m/z 279.094 1为[M+H-3CH2O]+峰,推测其为Methylated dehydrodiconiferyl alcohol-4-O-β- D-glucoside。
基于表4,笔者简述几种典型化学成分的MS/MS推导过程。
1号峰(tR=1.567 min)分子量为342.109 8,m/z 341.102 0为[M-H]-峰,m/z 279.688 1为[M-H-CH3OH- CH2O]-峰,m/z 261.051 1为[M-H-CH3OH-CH2O-H2O]-峰,m/z 237.411 5为[M-H-C2H2O-CH3OH-CH2O]-峰,推测其为乙酰化红景天苷;2号峰(tR=1.834 min)分子量为432.147 8,m/z 431.140 0为[M-H]-峰,m/z 279.663 8为[M-H-C8H10O-CH2O]-峰,m/z 243.083 3为[M-H-C8H10O2- CH3OH-H2O]-峰,m/z 187.886 1为[M-H-C5H8O4-C6H6O- H2O]-峰,m/z 155.037 8为[M-H-C5H8O4-C6H6O-CH3OH- H2O]-峰,推测其为去甲基肉苁蓉苷G;3号峰(tR=1.951 min)分子量为580.212 0,m/z 579.204 2为[M-H]-峰,m/z 529.712 4为[M-H-CH3OH-H2O]-峰,m/z 471.026 4为[M-H-3CH2O-H2O]-峰,m/z 359.045 9为[M-H-CH2O- C6H12O6]-峰,推测其为Methyl-O-eucommin A;4号峰(tR=2.101 min)分子量为612.300 4,m/z 611.292 6为[M-H]-峰,m/z 596.873 7为[M-H-CH3]-峰,m/z 401.524 1为[M-H-C6H12O6-CH2O]-峰,m/z 321.851 7为[M-H- C6H10O5-4CH3OH]-峰,推测其为羟基化丁香脂素-O-β-D-葡萄糖苷;5号峰(tR=2.384 min)分子量为676.355 1, m/z 675.347 3为[M-H]-峰,m/z 577.566 9为[M-H-SO3- H2O]-峰,m/z 505.427 1为[M-H-SO3-3CH2O]-峰,推测其为丁香脂素-O-β-D-葡萄糖苷硫酸结合物;6号峰(tR=2.468 min)分子量为524.056 9,m/z 523.049 1为[M-H]-峰,m/z 385.045 9为[M-H-C4H8O4-H2O]-峰,m/z 347.800 0为[M-H-C6H8O6]-峰,推测为 Kankanoside L glucuronic acid conjugate;12号峰(tR=5.552 min)分子量为358.222 6,m/z 357.214 8为[M-H]-峰,m/z 311.977 6为[M-H- HCOOH]-峰,m/z 149.995 8为[M-H-C6H10O5-HCOOH]-峰,推测其为去羟基京尼平苷酸;16号峰(tR=7.803 min)分子量为388.122 1,m/z 387.114 3为[M-H]-峰,m/z 319.541 3为[M-H-CH3OH-2H2O]-峰,m/z 301.728 0为[M-H-CH3OH-3H2O]-峰,推测其为甲基化京尼平苷酸;21号峰(tR=8.153 min)分子量为388.1224,m/z 387.114 6为[M-H]-峰,m/z 323.702 8为[M-H-2CH3OH]-峰,m/z 293.839 4为[M-H-2CH3OH-CH2O]-峰,m/z 263.477 2为[M-H-2CH3OH-C2H4O2]-峰,m/z 159.166 4为[M-H- C6H12O6-CH2O-H2O]-峰,推测其为羟基化丁香苷。
2.9 人工肠液中各化合物的代谢途径
肉苁蓉总苷在人工肠液中成分分析共推测出86个代谢物,根据总苷代谢相关文献[14-15]推测其代谢途径主要有甲基化、去甲基化、羟基化、去羟基化、甲氧基化、乙酰化、硫酸化、葡萄糖醛酸化。表明肉苁蓉总苷在人工肠液中主要是以代谢物的形式存在。人工肠液中代谢产物的典型代谢途径见图6。
3 讨论
目前大多数药物都为口服给药,胃、肠道是口服给药的必经之路,胃、肠道内的酸碱性以及存在的大量肠道菌群和某些代谢酶,对中药的化学成分有生物转化功能,使某些化学成分的结构发生改变。因此,为了使中药药效发挥增效减毒的作用,中药化学成分的胃、肠道代谢研究必不可少[2,19-20]。
体外试验法是研究药物在胃、肠内代谢的主要方法,可以排除体内的干扰因素,更好地控制某些代谢条件,且简单易行[2,19-20],缺点是不能完全模拟体内环境以全方位地反映药物在体内的代谢情况,不太全面,与实际可能会有所差异。本试验通过采用UPLC/Q-TOF-MS技术对肉苁蓉总苷在人工胃液及肠液中成分进行分析,在人工胃液中,共推测出 69 个成分,其中 14个原型成分(如芥子醛葡萄糖苷、Kankanoside J等 )、55个代谢成分(如 Methyl-O-Kankanoside J、Methyl-O-Kankanoside E等),推測其代谢途径有甲基化、去甲基化、羟基化、甲氧基化、乙酰化、硫酸化、葡萄糖醛酸化。在人工肠液中,共推测出 90个成分,其中 4个原型成分(如Kankanoside M,Kankanoside L等)、86 个代谢成分(如Methyl-O-Kankanoside,Methyl-O-Kankanoside E等),推测其代谢途径有甲基化、去甲基化、羟基化、去羟基化、甲氧基化、乙酰化、硫酸化、葡萄糖醛酸化,进而推测肉苁蓉总苷经胃肠代谢的质变规律,为阐明肉苁蓉总苷的体内代谢过程,进一步揭示肉苁蓉总苷在体内的直接作用物质及其作用过程提供参考,也为深入研究肉苁蓉拟雌激素作用的药效物质基础及新药研发提供依据。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:135-136.
[ 2 ] 彭颖,李瑒,李晓波.肉苁蓉的抗抑郁活性及体内外代谢[J].世界科学技术-中医药现代化,2018,20(8):1351- 1356.
[ 3 ] 陈飞,陈卓,邢雪飞,等.肉苁蓉的研究进展[J].药物评价研究,2013,36(6):469-475.
[ 4 ] TIAN S,MIAO M,BAI M,et al. Phenylethanoid glycosides of Cistanche on menopausal syndrome model in mice[J]. Saudi Pharm J,2017,25(4):537-547.
[ 5 ] 刘文静,刘瑶,宋青青,等.利用1H-NMR比较管花肉苁蓉野生品和栽培品的化学成分组[J].中国中药杂志,2018,43(17):3506-3512.
[ 6 ] YANG FR,WEN DS,FANG BW,et al. Prevention of Cistanche salsa extract on hepatic fibrosis induced by carbon tetrachloride in rats[J]. Chin Herb Med,2013,5(3):199- 204.
[ 7 ] 王力伟,曹瑞,房永雨,等. UPLC-QQQMS法测定肉苁蓉中有效成分的含量[J].中药材,2017,40(2):295-300.
[ 8 ] 刘文静,曹妍,宋青青,等.荒漠肉苁蓉花及木质化茎的化学成分定性分析[J].中国中药杂志,2018,43(18):3708- 3714.
[ 9 ] 王力伟.肉苁蓉成分的分离鉴定、定量分析及生物活性研究[D].呼和浩特:内蒙古大学,2016.
[10] 王金芳.肉苁蓉不同部位苯乙醇苷类成分的定性定量研究[D].北京:北京协和医学院,2014.
[11] 覃夏岚.肉苁蓉增力有效成分及其相互作用初步研究[D].北京:北京中医药大学,2018.
[12] 朱芳菲.肉苁蓉总苷提取纯化工艺及成分分析[D].哈尔滨:哈尔滨商业大学,2016.
[13] 张继远,刘晓谦,杨立新,等.常山碱稳定性及其降解动力学研究[J].中国中药杂志,2017,42(16):3178-3184.
[14] 黄婧嫣.毛蕊花糖苷的大鼠体内分布和体内外代谢研究[D].南昌:南昌大学,2016.
[15] 钱浩,杨振亚,刘丹丹,等.人肠道菌群对松果菊苷体外代谢转化的研究[J].华西药学杂志,2017,32(6):641-643.
[16] 邢冷.肉苁蓉总苷指纹图谱的建立及拟雌激素活性研究[D].哈尔滨:哈尔滨商业大学,2017.
[17] 潘英妮.管花肉苁蓉鲜品化学成分及生物活性的研究[D].沈阳:沈阳药科大学,2011.
[18] LI WL,DING JX,LIU BM,et al. Phytochemical screening and estrogenic activity of total glycosides of Cistanche deserticola[J]. Open Chemistry,2019,17(1):279-287.
[19] 高佳雪,丁晶鑫,王靖雅,等.中药化学成分肠道代谢的研究[J].哈尔滨商业大学学报(自然科学版),2018,34(1):20-23.
[20] 王娟娟,冯芳.中药体内代谢研究方法与技术[J].广州化工,2016,44(11):1-2.
(收稿日期:2019-08-02 修回日期:2019-11-09)
(编辑:唐晓莲)

