鼠尾草酸通过激活AMPK降低游离脂肪酸诱导的HepG2细胞脂肪积累
程 静,刘 莹,刘垚杰,赵 江,吉洋琳,刘 东,王 浩*
(天津科技大学食品工程与生物技术学院,天津 300457)
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)是除酒精外其他因素导致的肝损伤,包括单纯的脂肪肝以及由其演变的脂肪性肝炎和肝硬化,该病与炎症因子增加、脂质代谢紊乱、动脉粥样硬化、高血压、2型糖尿病等密切相关[1],脂肪的过度摄入是诱发NAFLD的重要因素[2-3]。随着西方饮食文化的流行,NAFLD正在逐渐成为全球发病率最高的一种慢性肝病之一,据报道发展中国家NAFLD的平均患病率为15%~20%,而发达中国家的平均患病率为31%~46%,并且呈上升趋势[4]。目前NAFLD的发病机制尚不明确,最初认为是由胰岛素抵抗引起的,但是近几年的研究表明由肥胖导致的肝脂肪积累,以及肝脂肪变性等同样会引起NAFLD[5]。临床上还没有公认的治疗NAFLD的标准药物,一些降脂药,如他汀类药物和奥利司他,通常具有副作用,会增加肝脏的负担甚至会导致肝功能紊乱[6]。因此寻求一种药食同源的天然产物对于辅助治疗NAFLD疾病具有重要意义。

图1 鼠尾草酸分子结构式Fig. 1 Structural formula of carnosic acid
鼠尾草酸是一种从迷迭香中提取的双萜类化合物(图1),具有抗细胞突变、抗氧化、抗炎等作用[7-8]。目前鼠尾草酸抗肿瘤研究已经成为热点,但在降脂方面的研究较少且作用机制并不明确,前期研究表明迷迭香具有降低高脂饮食小鼠体内胆固醇的作用[9]。游离脂肪酸(free fatty acids,FFAs)常被用于诱导高脂损伤模型,研究药物或者天然产物的降脂作用[10-11]。因此本实验采用FFAs诱导HepG2细胞NAFLD变性模型,研究鼠尾草酸对FFAs诱导的肝脂肪变性的作用机制,以期为其在降脂功能产品中的应用提供有益参考。
1 材料与方法
1.1 材料与试剂
HepG2细胞购自中国培养物保藏中心。
TC、TG和BCA蛋白试剂盒 南京建成生物工程研究所;TRIzol试剂、cDNA合成试剂盒、SYBR Green试剂盒 上海宝生物生物工程有限公司;油酸、棕榈酸、AMP依赖的蛋白激酶(adenosine 5’-monophosphate activated protein kinase,AMPK)抑制剂(6-[4-[2-(1-哌啶基)乙氧基]苯基]-3-(4-吡啶基)吡唑并[1,5-α]嘧啶,Compound C) 美国Sigma公司;AMPK、磷酸化AMPK单克隆抗体、β-actin 美国Cell Signaling Technology公司;HRP标记山羊抗兔IgG二抗 美国Abbkine公司;胎牛血清、DMEM高糖培养基 美国HyClone公司;鼠尾草酸(纯度≥90%) 湖南先伟实业有限公司。
1.2 仪器与设备
二氧化碳培养箱 宁波海曙赛福实验仪器厂;IQ5实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qPCR)仪 美国Bio-Rad公司;酶标仪 美国Thermo公司;紫外-可见分光光度计日本岛津仪器公司;倒置荧光显微镜 日本Olympus公司;凝胶成像系统 美国PE公司。
1.3 方法
1.3.1 鼠尾草酸和FFAs溶液的准备
FFAs按照油酸:棕榈酸(浓度比2∶1)配比配制,参照文献[2]的方法。油酸和棕榈酸使用1%牛血清白蛋白配制,配制成的储备液浓度为0.1 mol/L,使用时稀释100 倍。称取33.243 mg鼠尾草酸加入1 mL二甲基亚砜溶液中,配制成100 mmol/L的储存液,然后分别稀释成1、5、10、15、20、25、30、35、40 mmol/L的储备液,使用时用完全培养基稀释1 000 倍。
1.3.2 HepG2细胞的培养,高脂模型的建立以及实验分组
HepG2细胞培养于完全培养基中(90%(体积分数,下同)DMEM、10%胎牛血清、1%双抗(含100 U/mL青霉素和100 mg/mL链霉素)),在5%二氧化碳、37 ℃、恒温恒湿的条件下培养。每2~3 d传代一次,待细胞长满后,分别接种到实验所需的培养板中,待细胞长至70%~80%且呈指数增长时用于后续实验[2]。
使用FFAs处理细胞建立细胞高脂模型[12]:将培养瓶中长满的细胞使用胰酶消化,制成细胞悬液,并接种于实验所需的培养板中,待细胞呈指数增长时,使用1 mmol/L的FFAs溶液处理细胞24 h获得高脂损伤模型。
实验共分为5 组:正常组(只用完全培养基培养)、FFAs组(用含FFAs的完全培养基培养)、低剂量组(用含有15 μmol/L鼠尾草酸和1 mmol/L FFAs的培养基培养)、高剂量组(用含有20 μmol/L鼠尾草酸和FFAs的培养基培养)、抑制剂组(用含有20 μmol/L鼠尾草酸、1 mmol/L FFAs以及2 μmol/L Compound C的培养基培养)。
1.3.3 细胞毒性实验
细胞毒性实验采用噻唑蓝(thiazolyl blue tetrazolium bromide,MTT)法检测[7]。实验原理为:MTT可以被活细胞线粒体内的琥珀酸脱氢酶还原为紫色的甲臜结晶,其结晶可被二甲基亚砜溶解形成紫色溶液。溶液紫色的深浅可以反映细胞的存活量,活细胞数越多,颜色越深。
将细胞(1×104个/mL)接种于96 孔板,每孔100 μL,待细胞呈指数增长时,按照上述实验分组加入相应试剂培养24 h,弃掉旧培养基,加入20 μL MTT(5 mg/mL)溶液,放入培养箱中继续培养4 h,弃掉MTT并加入150 μL二甲基亚砜溶液,充分溶解5 min,在570 nm波长处测吸光度。
1.3.4 油红O染色
油红O是一种脂肪染色剂,可以将细胞内的脂肪染成红色,在显微镜下可以观察到细胞染色情况,染色的油红O可以使用异丙醇溶解后在510 nm波长处测吸光度,吸光度越高说明细胞内脂肪含量越高。
将细胞(1×105个/mL)种于6 孔板,每孔2 mL,参照Lee等[2]的实验方法,待细胞呈指数增长时,按上述实验分组处理细胞24 h,弃掉旧培养基,使用磷酸盐缓冲液洗2~3 次,加入细胞固定液固定细胞30 min后使用新配制的油红O溶液染色30 min。染色完成后加入体积分数60%异丙醇溶液漂洗10~20 s,然后加入磷酸盐缓冲液清洗细胞4~5 次并在显微镜下观察。观察结束后使用异丙醇充分溶解5 min,在510 nm波长处检测吸光度。
1.3.5 细胞内甘油三酯和胆固醇含量的测定
将细胞(1×105个/mL)种于6 孔板,每孔2 mL,待细胞呈指数增长时,按上述实验分组处理细胞24 h,弃掉旧培养基。使用TC、TG试剂盒,按照说明书的方法检测细胞内TC、TG的含量。细胞内的蛋白质浓度使用BCA蛋白检测试剂盒检测。TC、TG含量表示为μmol/mg。
1.3.6 脂肪代谢相关基因表达量的测定
将细胞(1×105个/mL)种于6 孔板,每孔2 mL,待细胞呈指数增长时,按上述实验分组处理细胞24 h,弃掉旧培养基。采用逆转录qPCR检测细胞内与脂肪相关基因的表达,参照前期实验方法[9]。使用TRIzol提取细胞内的RNA,并使用cDNA试剂盒将RNA逆转录为cDNA用于检测脂肪代谢相关基因的表达,相关基因的序列在下表1中。按照SYBR Green试剂盒的方法,依次加入cDNA、上游引物、下游引物和SYBR Green mix试剂,然后在IQ5 qPCR仪上反应,反应条件为:95 ℃ 30 s预热;95 ℃ 5 s,58 ℃ 30 s,40 个循环。使用2-△△Ct法进行相对定量分析。

表1 细胞脂肪代谢相关基因及其上、下游引物序列Table 1 Genes related to lipid metabolism and their upstream and downstream primer sequences
1.3.7 蛋白免疫印迹实验
采用蛋白免疫印迹法检测细胞内蛋白的表达水平。使用NP-40裂解细胞后提取细胞内的蛋白质,用BCA蛋白检测试剂盒检测蛋白质浓度,并将各实验组蛋白浓度调至等量。将调好浓度的蛋白质等量上样,进行聚丙烯酰胺凝胶电泳(电泳条件:浓缩胶,100 V 30 min;分离胶,130 V 1~1.5 h)。电泳结束后在冰水浴条件下,将蛋白转至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜并使用质量分数5%的脱脂奶粉室温下封闭1 h。加入稀释后的一抗,在4 ℃条件下孵育过夜,TBS-T洗后,将PVDF膜放入二抗孵育40 min,使用TBS-T清洗4 次,加ECL化学发光试剂进行显色后在凝胶成像仪上观察拍照,并用Image J软件进行灰度分析。
1.3.8 分子对接实验
PT1是一种AMPK激活剂,已经被证实能对接到AMPK蛋白,激活AMPK从而起到降脂作用[13]。本实验中用于执行分子对接的小分子PT1和鼠尾草酸的分子结构来源于https://www.chemicalbook.com,用于对接的AMPK蛋白的PDB号为4CFH,其结构来自于PDB数据库(RCSB Protein Data Bank database),下载之后得到独立的PDB蛋白结构文件。使用DS 3.5软件打开准备好的蛋白受体和小分子,小分子配体与蛋白受体使用Discovery studio 3.5(DS 3.5 Accelrys)软件的Prepare Ligand tool和Prepare Protein tool模块的默认设置进行处理。使用DS 3.5软件的CDOCKER,进行蛋白受体与小分子的对接操作,并使用下列参数:Top Hits-10、Random Conformations-10、Orientations to Refine-10、Force fi eld-CHARMm和Use Full Potential-False。
执行完CDOCKER后,将每个小分子的构象与相应的蛋白受体在Calculate Binding Energies模块中计算配体与受体的结合能量,来评估结合体系的稳定程度。在蛋白受体中结合能量最低的小分子配体被选作最佳构象,用于结构能量分析。
1.4 数据统计分析
使用SPSS 17.0软件进行显著性分析,具有代表性的实验至少进行3 次,数据表示为平均值±标准偏差,进行单因素方差分析并执行Duncans Multiple Tests进行多重比较检验。
2 结果与分析
2.1 鼠尾草酸对细胞的毒性作用
与正常组相比25 μmol/L的鼠尾草酸能显著抑制细胞的活性(P<0.05),使细胞的活力大约降低至85%(图2A)。Compound C 2 μmol/L处理细胞对细胞的活力无显著性影响(图2B)。各组与正常组相比均无显著差异(图2C),因此以1 mmol/L FFAs、15 μmol/L和20 μmol/L鼠尾草酸及2 μmol/L Compound C用于后续实验。


图2 鼠尾草酸对细胞活力的影响Fig. 2 Effect of carnosic acid on cell viability
2.2 鼠尾草酸对FFAs诱导的脂肪积累的影响

图3 鼠尾草酸对FFAs诱导的脂肪积累的影响Fig. 3 Effect of carnosic acid on FFA-induced lipid accumulation in cells
鼠尾草酸对FFAs诱导的HepG2细胞脂肪积累的作用如图3所示,FFAs组吸光度显著高于正常组(P<0.05),约为正常组的2 倍。不同浓度的鼠尾草酸处理细胞后,吸光度显著降低(P<0.05),表明鼠尾草酸能显著降低细胞内脂肪含量且作用效果呈浓度依赖型。抑制剂组吸光度显著高于高剂量药物组(P<0.05),这说明鼠尾草酸的降脂作用可能和AMPK相关。
2.3 鼠尾草酸对细胞内TC、TG水平的影响

图4 鼠尾草酸对细胞内TC、TG水平的影响Fig. 4 Effect of carnosic acid on intracellular TC and TG levels
如图4所示,FFAs处理组细胞能显著增加TC、TG的水平,TC含量约高于正常组细胞的2 倍,TG含量约高于正常组细胞的3 倍,差异极显著(P<0.01)。不同浓度的鼠尾草酸处理FFAs诱导的HepG2细胞,能显著降低细胞内TC、TG含量(P<0.05),其中TC含量从0.085 μmol/mg减低到0.05 μmol/mg,TC含量从0.142 μmol/mg减低到0.075 μmol/mg。与高剂量鼠尾草酸组相比,抑制剂组能显著逆转鼠尾草酸的作用且具有显著性差异。这些结果说明在实验浓度下鼠尾草酸能显著降低由FFAs诱导的HepG2细胞内TC、TG含量,且这些作用与AMPK相关。
2.4 鼠尾草酸对FFAs诱导的脂肪相关基因表达的影响
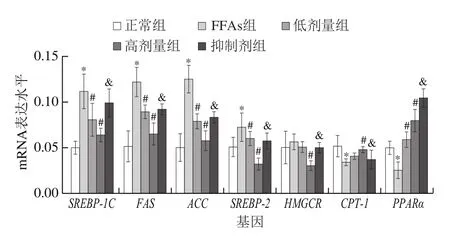
图5 鼠尾草酸对细胞内脂肪相关基因表达的影响Fig. 5 Effect of carnosic acid on the expression of lipid metabolismrelated genes in cells
如图5所示,FFAs组细胞内SREBP-1C、FAS、ACC和SREBP-2的基因表达水平显著高于正常组(P<0.05),同时CPT-1和PPARα的基因表达水平显著低于正常组(P<0.05)。不同浓度鼠尾草酸处理HepG2细胞能显著降低FFAs诱导的SREBP-1C、FAS、ACC、HMGCR和SREBP-2的基因表达水平(P<0.05),同时鼠尾草酸能显著增加FFAs诱导的CPT-1和PPARα基因表达的水平(P<0.05),作用效果表现为浓度依赖型。抑制剂组能显著逆转鼠尾草酸诱导的脂肪代谢基因的变化(P<0.05)。这些结果表明鼠尾草酸能显著上调FFAs诱导的HepG2细胞中脂肪氧化相关基因的表达水平和下调脂肪合成相关基因的表达水平,从而降低细胞内脂肪的积累,且这些作用与AMPK密切相关。
2.5 鼠尾草酸对FFAs诱导的磷酸化AMPK蛋白表达的影响
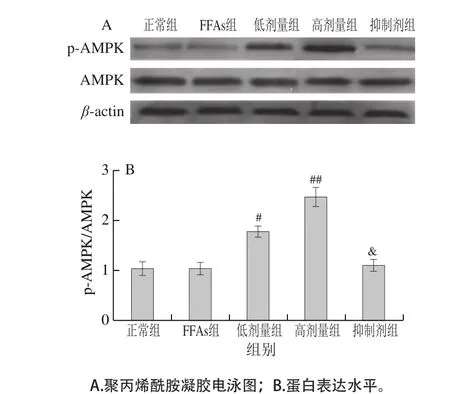
图6 鼠尾草酸对细胞内磷酸化AMPK蛋白表达的影响Fig. 6 Effect of carnosic acid on the protein expression of p-AMPK
由图6可知,与正常组相比,FFAs组AMPK磷酸化蛋白的表达无显著差异,而不同浓度的鼠尾草酸处理HepG2细胞能显著上调AMPK磷酸化蛋白的表达水平(P<0.05),说明鼠尾草酸能激活AMPK的磷酸化。Compound C处理细胞能显著抑制AMPK的磷酸化蛋白的表达,降至高剂量组的50%(P<0.05)。上述结果表明鼠尾草酸能激活AMPK蛋白的磷酸化。
2.6 鼠尾草酸与AMPK分子对接结果分析
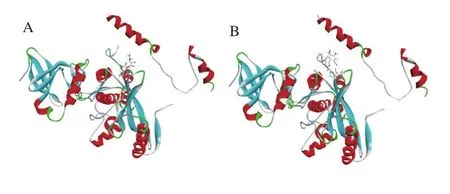

图7 鼠尾草酸与AMPK分子对接结果分析Fig. 7 Analysis of docking results between carnosic acid and AMPK
如图7所示,分析了3 个主要的参数:小分子与4CFH位点的结合能量,相关氨基酸残基以及氢键结合位点的氨基酸。PT1是AMPK的一个激活剂,在本实验中作为对接实验的阳性对照,被对接到4CFH位点。结果显示鼠尾草酸和PT1同样可以被对接到4CFH位点,且共享7 个残基,分别为:LYS 261、ASP 128、ARG 263、ILE 259、ARG 132、LYS 260、GLU 232;PT1、鼠尾草酸与4CFH的结合能量分别为-821.25 kJ/mol和-180.994 kJ/mol;氢键结合位点的氨基酸残基分别为ARG 263、ARG 132和GLU 232、ARG 132。这些结果表明鼠尾草酸与PT1以类似的方式结合到4CFH位点,因此鼠尾草酸和PT1可能有同样的生物活性,能激活AMPK蛋白的表达,这与细胞实验结果一致。
3 讨 论
FFAs能够诱导细胞内脂滴的积累,过量的脂肪积累能够引起细胞氧化应激,细胞凋亡等[11]。研究表明FFAs在肝中大量积累会引起机体内TC、TG含量的升高从而导致NAFLD疾病,并且该疾病的严重程度与脂肪的积累程度相关[14]。有研究报道1 mmol/L的FFAs处理细胞24 h能在对细胞无毒性作用下诱导HepG2细胞内脂肪积累[15]。因此,本实验选择1 mmol/L FFAs处理细胞24 h。Compound C是AMPK的抑制剂,可以直接抑制AMPK的表达,有研究报道称,使用Compound C 10 μmol/L处理细胞24 h进行实验[16],但在本实验中,大于2 μmol/L Compound C处理细胞24 h能显著抑制细胞的活性,而2 μmol/L Compound C对细胞活性没有影响且可以抑制AMPK蛋白的表达,这可能是由于细胞代数等原因引起的差异,本实验最终选用Compound C的浓度为2 μmol/L。
细胞活力实验结果表明小于20 μmol/L的鼠尾草酸对细胞的活性没有显著影响,而25 μmol/L的鼠尾草酸能显著抑制细胞的活性,因此选用15、20 μmol/L的鼠尾草酸进行后续实验。油红O染色在实验中常用来反映细胞或者组织中脂肪含量,它可以使细胞内脂滴呈现出红色[17]。本实验中油红O染色的结果显示,FFAs处理后,细胞内脂肪含量显著增加(P<0.05);而鼠尾草酸处理后,细胞内的脂肪含量显著降低,这些结果表明鼠尾草酸能够降低FFAs诱导的HepG2细胞脂肪的积累。细胞内TC、TG的含量与细胞内脂肪的积累密切相关,TC、TG的水平越高,脂肪积累越多[18]。本实验结果显示FFAs能显著增加细胞内TC、TG的含量,而鼠尾草酸能显著降低由FFAs增加的TG、TC含量,这说明鼠尾草酸能降低细胞内TC、TG的水平从而降低细胞内脂肪的积累。而Compound C处理细胞后,油红O染色结果表明,被鼠尾草酸降低的细胞内的脂肪含量以及细胞内的TC、TG水平均被显著增加(P<0.05),这些结果表明鼠尾草酸降低脂肪积累和TC、TG含量的作用与AMPK密切相关。
为了研究鼠尾草酸在FFAs诱导的HepG2细胞模型内的具体降脂机制,本实验检测了一些与脂肪代谢相关基因的表达水平。在人体中,SREBP家族基因主要由SREBP-1C和SREBP-2组成[19],可以分别调节甘油三酯和胆固醇的合成。SREBP-1C主要控制TG的合成,并且可以调节ACC、FAS的表达水平[20-21]。SREBP-2主要控制TC的合成,可以调节胆固醇合成相关的蛋白表达如HMGCR[16]。ACC是脂肪合成中的限速酶,可以控制脂肪的合成,另外ACC也可以合成丙二酰辅酶A,合成的丙二酰辅酶A能抑制CPT-1的表达[20]。ACC合成的产物丙二酰辅酶A经过FAS催化可以延长长链脂肪酸进而合成甘油三酯。PPARα在肝中高度表达,能够促进肉毒碱棕榈酰转移酶1(carnitine palmitoyl transferase 1,CPT-1)的转录表达,调节脂肪酸的氧化,加速脂肪的摄取,从而起到降脂的作用[22]。CPT-1是一种载脂蛋白可以将脂肪酸运送至细胞内进行β氧化[18]。有研究表明,在高脂饮食小鼠中,鼠尾草酸能降低SREBP-1C、ACC、FAS的蛋白表达并且能增加PPARα的蛋白表达,从而降低小鼠肝脂肪的积累[23]。与前人的研究结果一致,本实验研究结果显示鼠尾草酸可以降低由FFAs诱导的SREBP-1C、ACC、FAS基因表达的增加,从而降低细胞内甘油三酯的合成;降低由FFAs诱导的SREBP-2、HMGCR的基因表达的上调,从而降低细胞内胆固醇的合成;同时增加由FFAs诱导的PPARα、CPT-1基因表达的下调,从而促进脂肪酸的β氧化。综上所述,鼠尾草酸降低细胞内脂肪的积累主要是通过降低脂肪酸合成以及增加脂肪酸的氧化。
AMPK是能量代谢的总开关,能够调节多种信号通路,AMPK的激活能够改善炎症,缓解氧化应激,抗癌,降脂等[24]。AMPK主要通过调节下游与脂肪代谢相关的基因ACC[17]、SREBP-1C[25]、FAS、SREBP-2、HMGCR[26]、PPARα[27]、CPT-1[28]发挥其在代谢中的重要作用。在Compound C存在条件下,鼠尾草酸在FFAs诱导的HepG2细胞中的降脂作用被废除,这些结果表明鼠尾草酸的降脂作用与AMPK相关。同时蛋白免疫印记实验表明,鼠尾草酸可以显著增加AMPK的磷酸化。有研究表明AMPK的磷酸化可以调节SREBP-1C、ACC、FAS、PPARα和CPT1蛋白的表达[16,27]。Guo Weiwei等研究表明,黄酮类化合物(pinocembrin-7-O-β-D-glucoside、pinocembrin和5-methoxy-pinocembrin-7-O-β-D-glucoside)能提高AMPK基因和磷酸化蛋白的表达;抑制SREBP-1C基因和蛋白的表达;同时能提高PPARα蛋白的表达[27]。Forbes-Hernandez等研究表明,草莓提取物处理细胞24 h能显著提高细胞内AMPK磷酸化蛋白的表达,并伴随着ACC、HMGCR蛋白水平的降低,从而降低HepG2细胞内脂肪的积累[16]。本实验中使用Compound C处理细胞,细胞内的AMPK磷酸化蛋白表达明显被降低,说明AMPK磷酸化蛋白的表达受到抑制(P<0.05)。Compound C存在时,油红O染色结果可知,被鼠尾草酸降低的细胞内的脂肪含量被增加;同时降低的TG和TC含量以及SREBP-1C、SREBP-2、ACC、FAS、HMGCR基因的表达水平均被显著增加,增加的PPARα、CPT-1被显著降低(P<0.05)。这些结果表明鼠尾草酸降低FFAs诱导的脂肪积累作用机制主要通过激活AMPK信号通路。
为了进一步验证AMPK和鼠尾草酸的关系,本实验使用分子对接实验研究了AMPK和鼠尾草酸的相互作用。分子对接经常被用于模拟小分子与大分子之前可能的结合位点以及结合方式。PT1是AMPK的激活剂,在分子对接的研究中表明,PT1可以对接到AMPK的α亚基从而激活AMPK,更进一步在HeLa细胞研究中使用抗磷酸化AMPKα-Thr-172抗体进行蛋白免疫印记反应,结果显示PT1可以促进AMPK α亚基Thr-172的磷酸化[13]。而本实验研究表明鼠尾草酸与PT1小分子以类似的方式结合到AMPK蛋白,并且在细胞实验中表明鼠尾草酸能促进AMPK磷酸化蛋白的表达,从而调节脂肪代谢。因此,鼠尾草酸与PT1小分子可能具有相似的作用机制,促进AMPKα亚基Thr-172的磷酸化。
综上所述,本实验研究发现鼠尾草酸一方面能激活AMPK磷酸化,从而抑制SREBP-1C、ACC、FAS、SREBP-2、HMGCR基因的表达,达到抑制TG、TC合成的目的;另一方面能促进PPARα、CPT1基因的表达,达到促进脂肪β氧化的作用,从而在抑制脂肪合成,促进脂肪氧化两个方面起到降低脂肪积累的作用。

