瓜蒌叶黄酮的提取工艺优化及其生物活性研究
骆丽如,黄昭璇,谢文杰,胡璐曼,唐忠海
(湖南农业大学 食品科学技术学院,湖南 长沙 410128)
瓜蒌为葫芦科植物瓜蒌(TrichosantheskirikrwiiMaxim)或双边瓜蒌(TrichosanthesrosthorniiHarms)的干燥成熟果实,俗称瓜蒌、吊瓜,是一种具有多种药效的传统中药,可用于润肠道、降燥热、清热化痰等方面,常常被用于治疗由肺热引起的咳嗽、胸闷气结、痰稠不畅、大便不通等病症[1-2];含有糖苷类、色素等,具有抗心肌缺血、抗心肌纤维化等作用[3-4].
黄酮是一类植物次生代谢产物[5-6],具有抗氧化、防止血管增生、抗炎、抗病毒[7-9]、抗衰老、降血糖、降血脂[10-12]、抗骨质疏松[13]等多种生物活性.在人们日常接触到的蔬菜和水果中也含有黄酮.研究表明,饮食中黄酮摄入量的增加将降低人们患上结肠癌、前列腺癌、宫颈癌、乳腺癌等癌症的风险[14].不仅如此,不同植物中所含黄酮的生物活性也有着很大的不同.在一些文献中都是以1 mg/mL的不同植物的黄酮提取液作为最高浓度来进行各种抑菌试验.结果表明在抑制细菌生长方面即使是不同的植物其中所含的黄酮都有着不错的效果[15-16].
国内对瓜蒌的研究多局限于根、籽粒、皮方面,而瓜蒌叶未引起重视,但事实上其叶容易大量获得、保存、运输[17],且其黄酮含量丰富.研究瓜蒌叶的黄酮提取,测定瓜蒌叶黄酮的抗氧化能力和抑菌能力,可以帮助了解瓜蒌叶是否具备作为天然食品添加剂的条件,为进一步研究与瓜蒌叶有关的产品提供参考.
1 材料与方法
1.1 材料与仪器
干燥瓜蒌叶;芦丁标准品(纯度≥98%);SPL-250型恒温培养箱(天津市莱玻特瑞设备有限公司);SW-CJ-2D型双人单面垂直净化工作台(苏州智净净化设备有限公司);CP-214型电子天平(上海奥豪斯仪器有限公司);恒温水浴锅(天津泰斯特仪器有限公司);722S分光光度计(上海棱光技术有限公司);甲醇、无水乙醇、九水合硫酸铝、亚硝酸钠、氢氧化钠、酵母浸出膏、氯化钠、蛋白胨、葡萄糖、琼脂皆为分析纯;马铃薯.
1.2 瓜蒌叶黄酮的提取流程及含量的测定
1.2.1 绘制芦丁标准曲线
将天平预热0.5 h后称取干燥芦丁标准品5.0 mg放入50 mL容量瓶中,加入20 mL甲醇溶解摇匀.待芦丁完全溶解且溶液中无细小气泡后,用移液管移取2.0 mL、4.0 mL、6.0 mL、8.0 mL、10.0 mL,分别置于10 mL容量瓶中并标记,同时设置空白对照组.用乙醇(质量分数30%)稀释至10.0 mL,移取0.6 mL亚硝酸钠(质量分数5%),摇匀,放置反应8 min,移取0.6 mL硝酸铝(质量分数10%)于锥形瓶,摇匀,放置反应8 min,再用移液管移取8.0 mL的1 mol/L氢氧化钠溶液加入锥形瓶,蒸馏水定容后摇匀,放置20 min至反应完全,测定A510,记录数据,绘制标准曲线并计算回归方程.
1.2.2 原料处理
将准备好的瓜蒌叶放入恒温干燥箱,在50 ℃下直到完全干燥,取出后将茎等其他部位除去,然后放入粉碎机中,先于40目筛粉碎筛选,再于50目筛筛选,最后将干燥的瓜蒌叶粉末于有干燥剂的保鲜袋中封存.
1.2.3 提取并测定黄酮提取率及含量
将瓜蒌叶粉末按比例加入到一定浓度的乙醇溶液中,放入事先调整好温度的水浴中加热一段时间.将提取液用原提取溶剂稀释到100 mL,再依次加入亚硝酸钠(质量分数5%)、硝酸铝(质量分数10%)和1 mol/L的氢氧化钠溶液,反应一段时间后测量A510,以芦丁标准曲线计算所得瓜蒌叶提取液中的黄酮浓度,从而确定瓜蒌叶中的黄酮含量及提取率.
提取率(%)=m1/m2×100
式中,m1-黄酮含量(g),m2-原料重量(g)
1.3 瓜蒌叶黄酮最佳提取条件的确定
1.3.1 单因素试验设计
以瓜蒌叶黄酮提取率为指标,分固液比(g/mL)、提取时间(h)、提取温度(℃)、乙醇质量分数(%)4组,分别考察4个因素对瓜蒌叶黄酮提取率的影响.每组因素平行试验3次,取3次平行试验所得提取率的平均值.
固液比的筛选:提取溶剂选用乙醇质量分数70%,提取温度为60 ℃,提取时间1.5 h,固液比分别设定为1∶30、1∶40、1∶50、1∶60、1∶70.
提取时间的筛选:选用乙醇质量分数70%,提取温度为60 ℃,固液比为1∶50,提取时间分别为0.5 h、1 h、1.5 h、2 h、2.5 h.
提取温度的筛选:选用乙醇质量分数70%,提取时间为1 h,固液比为1∶50,提取温度分别是40 ℃、50 ℃、60 ℃、70 ℃、80 ℃.
乙醇质量分数的筛选:提取时间为1 h,提取温度为60 ℃,固液比为1∶50,所用乙醇质量分数分别为40%、50%、60%、70%、80%.
1.3.2 正交试验设计
根据正交试验设计原理,在单因素试验的基础上,以固液比( A)、提取时间( B)、提取温度( C)、乙醇质量分数(D)4个因素作考察因素,每个因素取 3 水平,用 1、2、3 编码,以瓜蒌叶黄酮提取率为评价指标,采用L9(34)正交试验设计,因素水平设计见表1.
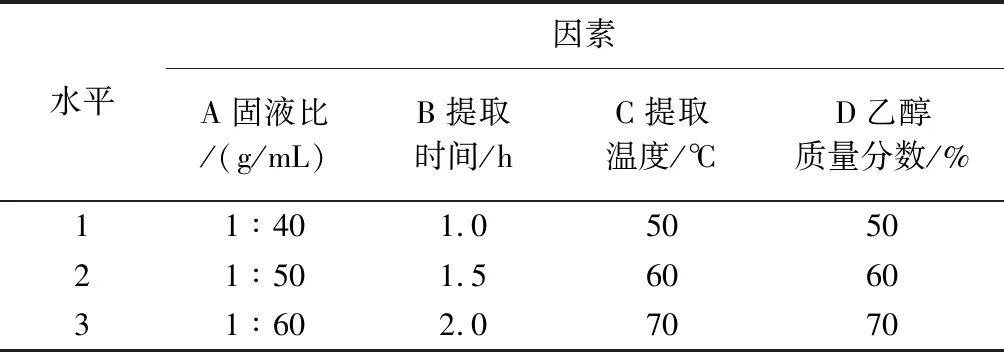
表1 正交试验因素及水平
1.4 黄酮抗氧化能力的测定
抗氧化试验采用DPPH自由基清除试验的方法[18].以DPPH自由基清除率来反映各个浓度的黄酮的抗氧化能力,瓜蒌叶黄酮对DPPH自由基的清除率越高,其抗氧化能力越大[19-20].
称DPPH自由基粉末3.9 mg于烧杯中,加入无水乙醇初步溶解后转移到250 mL容量瓶中,再用无水乙醇反复清洗烧杯,并将洗涤液转移至250 mL容量瓶中,最终将DPPH自由基完全转移至250 mL容量瓶中并用无水乙醇定容至刻度线,配成浓度为2×10-4mol/L的DPPH自由基溶液,备用.用移液管各取2 mL不同浓度的黄酮溶液与2 mL DPPH自由基溶液加入到同一试管中,混匀放置在阴凉处,25 min后测定517 nm处的吸光度,记录数据标记为A样品.同时设置对照组即测量2 mL DPPH自由基溶液和2 mL无水乙醇混合后在517 nm处的吸光值,记录为A对照,以及2 mL待测瓜蒌叶提取液液与2 mL提取液所用溶剂混合后在517 nm处的吸光度,记录为A空白.
清除率(%)=[1-(A1-A2)/A3]×100%
式中,A1为A样品,A2为A空白,A3为A对照.
1.5 黄酮抑菌活性测定
向含有细菌浓度相同的液体培养基中加入相同浓度的瓜蒌叶黄酮提取液,培养一段时间,测量液体培养基OD600值的变化,以细菌浓度变化反映黄酮抑菌的能力.
1)菌悬液制备.选取大肠杆菌、黑曲霉、金黄色葡萄球菌等3种菌作为抑菌试验的对象,将它们分别接种到已灭菌的装有50 mL LB液体培养基的锥形瓶中,置于37 ℃恒温培养箱中培养6 h .用分光光度计测定各种菌悬液在OD600时的吸光度值.再以初始OD600值为基础,按比例用无菌水将三种菌悬液的浓度配制成相同的浓度.配制LB液体培养基:准确称取各成分:蛋白胨2.5 g,酵母提取物1.25 g,氯化钠2.5 g,加蒸馏水定容至250 mL,搅拌完全溶解后灭菌待用.
2)瓜蒌叶黄酮抑菌能力测定.将浓度为0.12 mg/mL的瓜蒌叶黄酮溶液用已灭菌的移液管吸取4 mL,分别移至50 mL已灭菌的LB液体培养基中,以4 mL无菌水做对照.在各培养基中接种1 mL待用菌悬液,置于37 ℃恒温培养箱中培养15 h.由于细菌在LB培养基中37 ℃的条件下培养会在6 h后进入对数期,在12 h后进入稳定期,所以选定在15 h时进行测定以获得稳定可靠的数据.用可见分光光度计测定上述菌悬液在OD600时的吸光度值,以细菌前后两次测量值的差值计算细菌浓度减少的百分比,以此反映一定浓度的瓜蒌叶黄酮溶液在相同的培养时间内对不同细菌的抑制作用.
2 结果与分析
2.1 芦丁标准曲线方程
芦丁标准曲线方程为Y=11.219X+0.002 9,R2=0.997 8(图1).
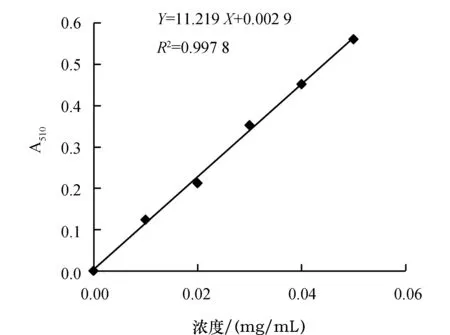
图1 芦丁标准曲线Fig.1 Rutin standard curve
2.2 单因素试验结果与分析
2.2.1 固液比对瓜蒌叶黄酮提取率的影响
由图2可知,在1∶30到1∶50之间,随着溶剂比例的增加,黄酮的浸出率迅速上升,当固液比为1∶50 时瓜蒌叶黄酮得率最大.
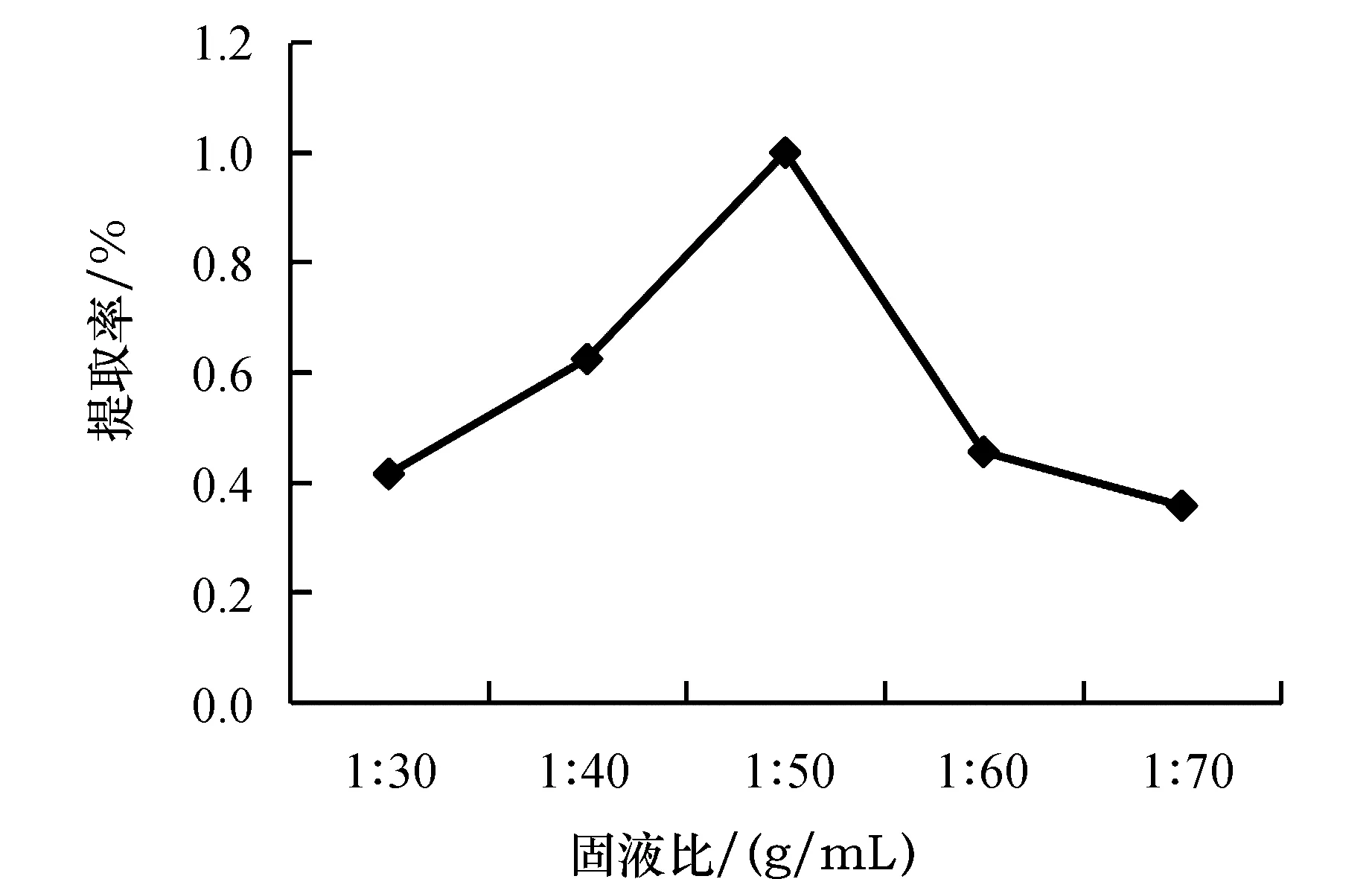
图2 固液比对瓜蒌叶黄酮提取率的影响Fig.2 Effect of solid-liquid ratio on the extraction rate of flavonoids from Trichosanthes
2.2.2 提取时间对瓜蒌叶黄酮提取率的影响
由图3可知,随着提取时间的增加,提取率先增加后减少,在1.5 h时最高.这因为分子热运动的逐渐剧烈而使黄酮浸出率增加,而后过于剧烈的分子热运动又会使黄酮类化合物逐渐分解,同时各种杂质也相继加速被溶解出来导致黄酮的提取率迅速降低.
2.2.3 提取温度对瓜蒌叶黄酮提取率的影响
由图4可知,随着温度升高,提取率先增加后慢慢减少,在70 ℃的时候达到最佳提取效果,过高的温度导致黄酮发生变化和分解使得提取率下降.
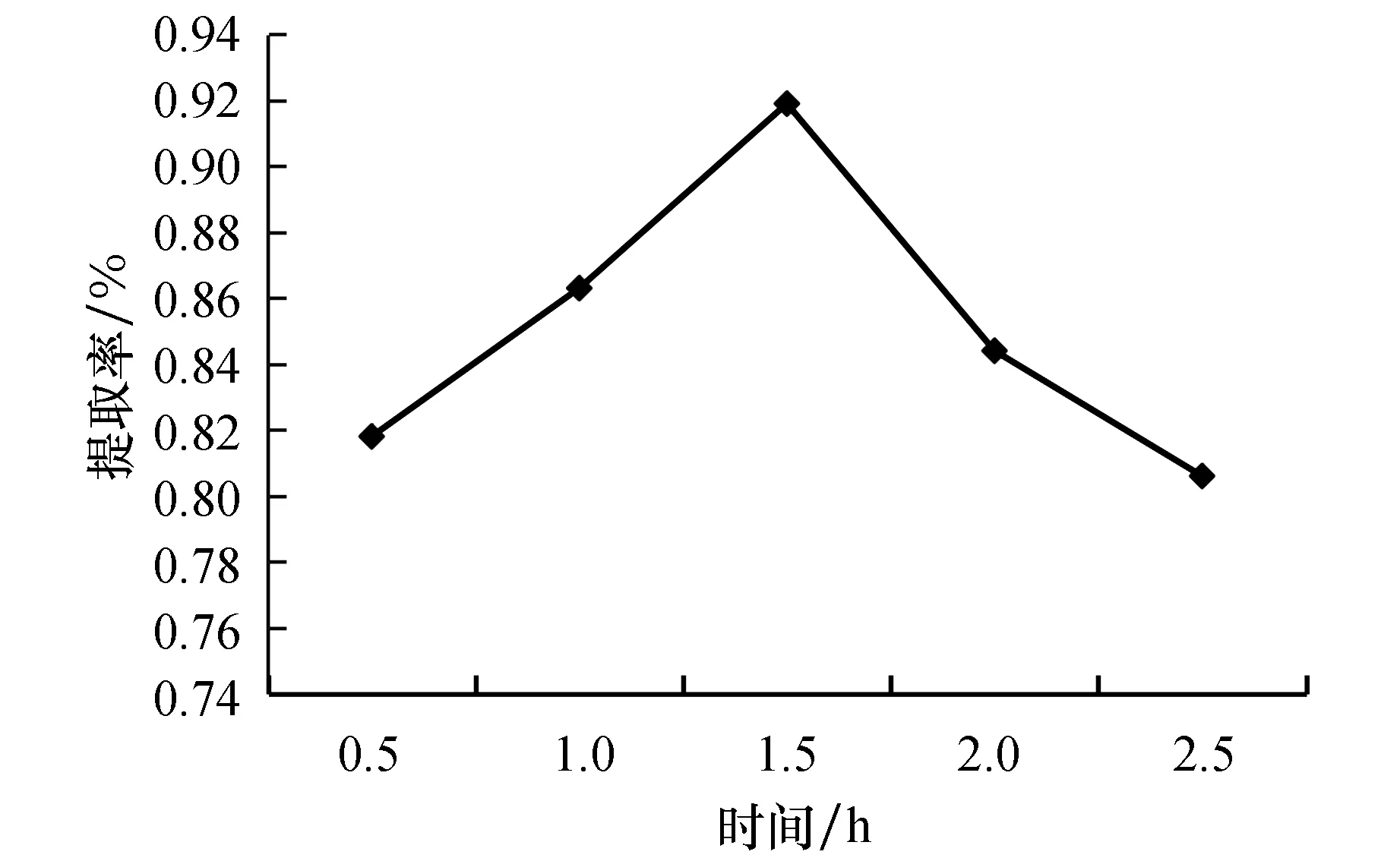
图3 提取时间对黄酮提取率的影响Fig.3 Effect of heating time on the extraction rate of flavonoids
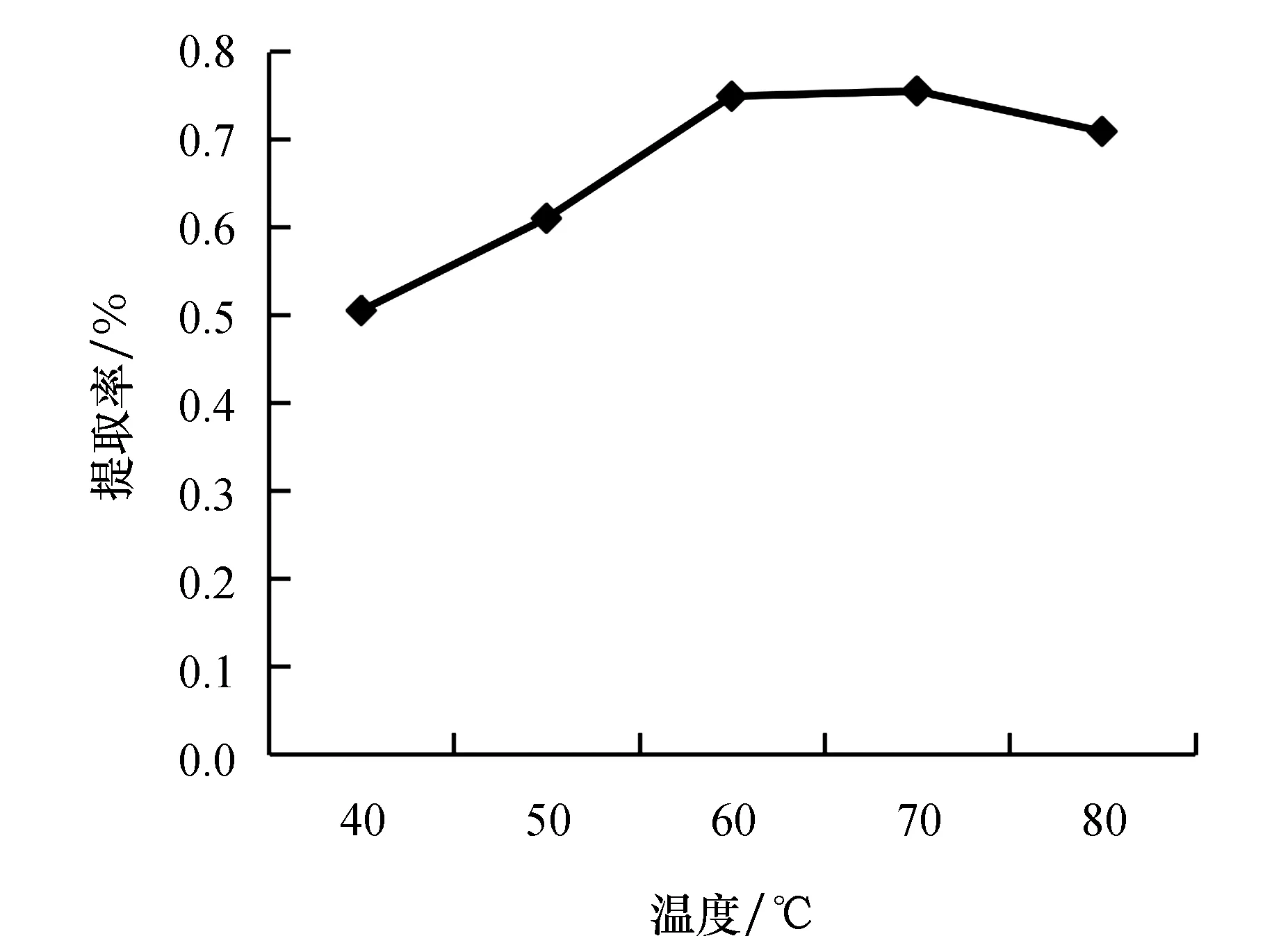
图4 提取温度对黄酮提取率的影响Fig.4 Effect of extraction temperature on the extraction rate of flavonoids
2.2.4 乙醇质量分数对瓜蒌叶黄酮提取率的影响
由图5可知,随着乙醇质量分数的增大,瓜蒌叶黄酮提取率先增后减,这是由于黄酮与乙醇的极性相近,增大乙醇质量分数会进一步增大瓜蒌叶黄酮的浸出率,在乙醇质量分数达到60%时提取率最高,继续增大乙醇质量分数会使渗透压增大,引发其他杂质的进一步溶解,使黄酮提取率下降.
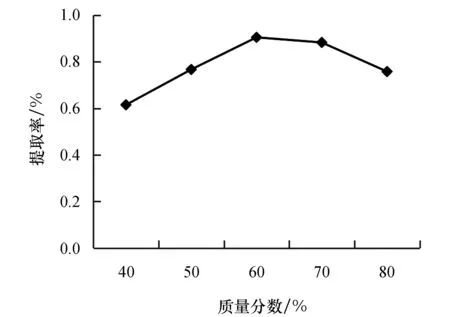
图5 乙醇质量分数对黄酮提取率的影响Fig.5 Effect of ethanol mass fraction on the extraction rate of flavonoids
2.3 正交试验结果与分析
根据单因素试验的结果,选取固液比、提取时间、提取温度、乙醇质量分数4个因素,以瓜蒌叶黄酮提取率为评价指标,设计正交试验,试验结果见表2、表3.
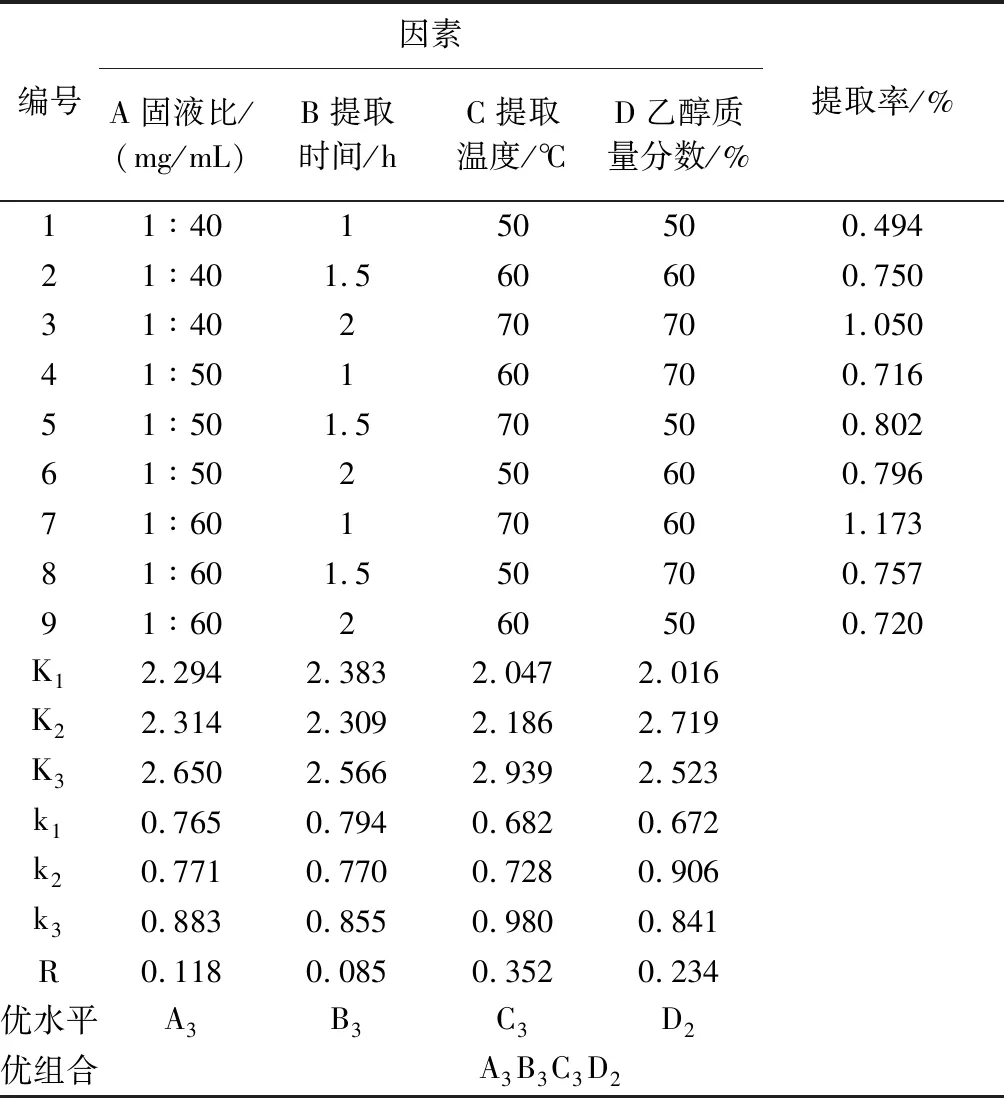
表2 正交试验结果与分析
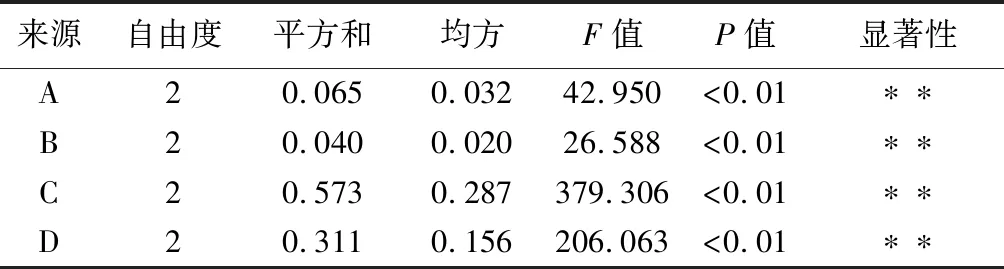
表3 方差分析表
*为差异显著(P<0.05);**为差异极显著(P<0.01)
如表2所示,由正交试验后得出的黄酮提取率可知,对瓜蒌叶黄酮提取率影响程度:提取温度>乙醇质量分数>固液比>提取时间.
由极差分析得到的最优组合是A3、B3、C3、D2,即固液比1∶60、提取时间2 h、提取温度70 ℃、乙醇质量分数60%,在此条件下的提取率达到最大值.
2.4 瓜蒌叶黄酮的抗氧化活性
由图6可知,瓜蒌叶黄酮的DPPH自由基清除能力与浓度有关,在试验浓度梯度范围内DPPH自由基清除能力随黄酮浓度上升而增强,在黄酮浓度达到0.124 8 mg/mL时,清除率达到了74.8%.
曲线前段随浓度增加清除能力的增强较为缓慢,在曲线的后半段清除能力迅速上升,说明高浓度的瓜蒌叶黄酮在抗氧化能力上要比低浓度的效果要好.
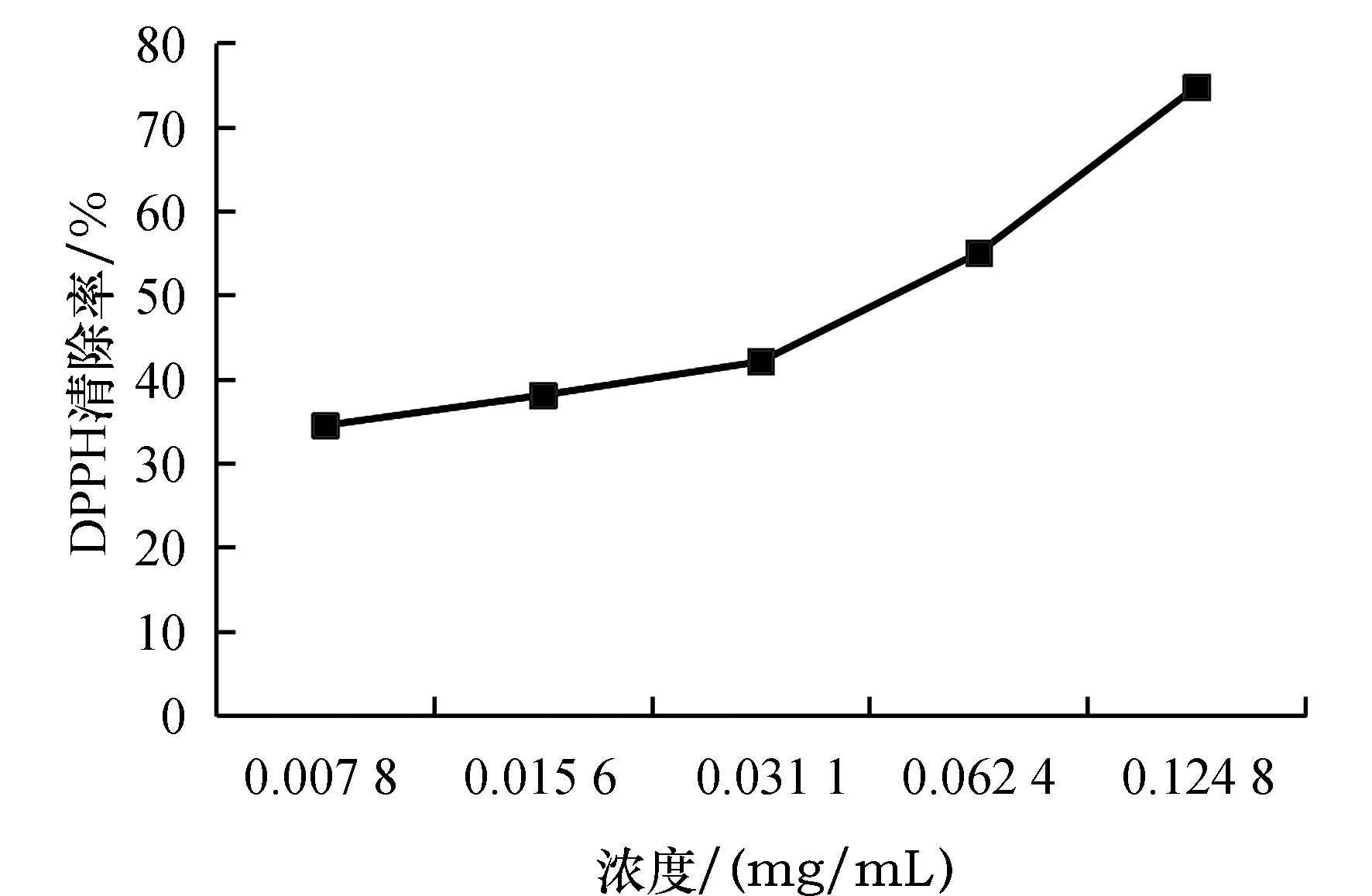
图6 黄酮浓度对黄酮抗氧化能力的影响Fig.6 Effect of concentration on antioxidant capacity of flavonoids
2.5 瓜蒌叶黄酮抑菌试验
选用最佳组合条件提取的瓜蒌叶黄酮溶液稀释至100 mL后进行抑菌试验,将其浓度固定在0.12 mg/mL左右,探究瓜蒌叶中所含的低浓度黄酮对于食品中常见的细菌的抑制作用.从表4的数据来看,该浓度的黄酮溶液对3种细菌没有明显的抑制效果,要想达到理想的抑菌效果或达到能够明显减缓食品因氧化而变质的速度的效果,可能还需要大幅度提高黄酮的浓度.
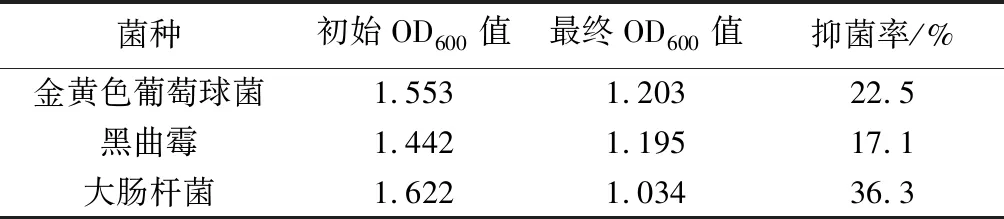
表4 固定浓度黄酮溶液的抑菌效果
3 讨论
通过单因素试验和正交试验的结果可知,提取温度是决定提取率的最重要因素之一,随着温度升高,分子扩散速度加快,提取率不断升高.分析正交试验数据得出的最佳提取温度在70 ℃,与单因素试验相符.而在提取过程中,提取时间对提取率也有一定影响,根据正交试验分析,提取时间为2 h时提取率最佳.同时,增大乙醇质量分数会进一步增大瓜蒌叶黄酮的浸出率,但当质量分数到达60%后,过高的乙醇质量分数会导致杂质的溶解,使提取率降低.因此,在实际的工业化生产中选取质量分数为60%的乙醇.由极差分析得到的最优固液比为1∶60,而在单因素试验中,最佳固液比1∶50.这可能是由于单因素试验未在其余条件的最佳情况下进行,导致固液比升高后提取率降低.所以在实际的工业化生产中,采用固液比为1∶60进行提取.以上得到的提取瓜蒌中黄酮的最佳提取工艺为后续瓜蒌叶黄酮生物活性的初步研究提供参考.
目前相较于瓜蒌根、皮、籽粒等,瓜蒌叶的研究与开发尚未引起重视.而事实上瓜蒌叶具有资源丰富、易于运输保存等优势,有很大的研究价值.本试验通过测定抗氧化能力和抑菌能力探究瓜蒌叶在初步物理处理后能否作为天然食品添加剂加入到食品中,使得食品能够保藏更久.从结果来看,瓜蒌叶中黄酮的抗氧化能力较强,作为食品添加剂能够给食品提供一定的抗氧化能力.但是在抑菌方面,抑菌试验反映出天然的瓜蒌叶黄酮溶液对3种菌的抑制效果并不理想,还未达到减缓食品氧化变质的效果,想要了解有效抑制浓度或半致死剂量,仍需加大黄酮浓度进行下一步研究.要想成功地将瓜蒌叶变为一种天然食品添加剂还需要更多的、更专业地研究.
4 结论
以瓜蒌叶黄酮提取率为评价指标,通过单因素结合正交试验,得到的最佳工艺为:固液比1∶60、提取时间2 h、提取温度70 ℃、乙醇质量分数60%.抗氧化试验结果表明当黄酮浓度达到0.124 8 mg/mL时对2×10-4mol/L的DPPH自由基溶液的清除率达到了74.8%.在抑菌试验中,天然的瓜蒌叶黄酮溶液对金黄色葡萄球菌、黑曲霉菌、大肠杆菌的抑菌率分别为22.5%、17.1%、36.3%.

