采用超疏水微柱阵列模板法制备多糖凝胶微米颗粒
包 寒, 罗 静, 时连鑫, 徐福建, 王树涛
(1. 北京化工大学生物医用材料北京实验室, 北京 100029;2. 中国科学院理化技术研究所, 中国科学院仿生材料与界面科学重点实验室, 北京 100190)
多糖及其衍生物作为一类天然高分子, 具有良好的生物相容性与可降解性能, 因此在生物材料领域具有广泛的应用[1]. 海藻酸钠、壳聚糖及纤维素等已被运用于药物可控释放[2]、组织工程骨架[3]或止血材料[4]等方面. 肝素(Heprin)由于具有高负电的特性[5], 可作为抗血栓药物[6]; 透明质酸(HA)作为高保水的多糖高分子, 在关节润滑治疗等方面具有一定的应用价值[7]. 因为富含羧基基团, 这两种多糖易于化学改性及修饰其它功能单元, 可制备出具有特殊功能的多糖基材料. 例如, Xu等[8]通过原子转移自由基聚合(ATRP)反应, 在肝素分子链上接枝阳离子聚合物, 负载基因后形成纳米粒子用于肿瘤治疗; Daveis等[9]通过席夫碱反应, 在透明质酸上修饰药物形成纳米粒子, 实现酸响应药物释放; Tae等[10]通过在肝素上修饰巯基基团, 采用点击化学反应制备水凝胶用于促进细胞生长; Ossipov等[11]在透明质酸高分子上修饰双膦酸盐后用银离子交联制备了抗菌敷料. 对于介观层面的微米级多糖凝胶, 一般采用乳液法[12,13]、注射法[14]及微流控法[15,16]制备, 但这些方法均存在所制备的微凝胶尺寸不均匀、难以形成非对称形貌及制备效率低等问题. 因此, 如何制备尺寸均一且非球形的多糖凝胶微米颗粒是极大的挑战.
作为一种周期性重复的具有可控形状的微结构, 微结构阵列常被用作模板材料. 通过调控微结构模板上的浸润特性, 可以获得多种形貌可控的阵列化器件. 近年来, 1D纳米线阵列[17]、1D纳米粒子组装体[18]、阵列化晶体[19]及特殊形貌粒子[20]等微纳体系的加工方式得到了广泛的研究. 其中, 利用超疏水高黏附的微米级柱状结构基底黏附微液滴或产生液桥的方法[21~23], Jiang等[21,24]制备了尺寸可控的阵列化氯化钠纳米晶体及阵列化聚合物纳米线等材料. 可见, 超疏水微米阵列模板法可为微米级多糖凝胶材料的制备提供新的机遇.
本文以超疏水微柱阵列硅基底为模板, 将巯基修饰后的肝素与透明质酸的多糖预聚液滴加在微柱阵列基底表面, 使液滴在微柱顶端移动并黏附, 通过微液滴挥发和紫外交联, 制备了大面积尺寸均一的多糖基微凝胶(PsMH). 通过改变微柱直径与凝胶预聚液浓度, 可以实现对微凝胶尺寸与形貌的调控. 采用不同材质的微柱基底均得到了相同形貌的微凝胶, 表明该方法适用于多种基底, 具有较好的加工弹性. 这种形貌尺寸可控的微凝胶有望应用于药物递送及纳米粒子载体等方面.
1 实验部分
1.1 试剂与仪器
肝素钠, 分子量20000, 购于山东万邦赛诺康生化制药股份有限公司; 透明质酸钠, 分子量10000, 购于华熙福瑞达生物有限公司; 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、1-羟基苯并三唑(HOBt)、半胱胺盐酸盐、二硫苏糖醇(DTT)及2-羟基-4′-(2-羟乙氧基)-2-甲基苯丙酮(光引发剂Irgacure 2959), 购于安耐吉化学, 萨恩化学技术(上海)有限公司; 双端丙烯酸酯基聚乙二醇(分子量3400, PEGDA3400)和1H,1H,2H,2H-全氟辛基三氯硅烷(PFOS)购于上海麦克林生化科技有限公司; 微米级柱状结构硅基底由北京大学微纳中心制备.
FE20-K型梅特勒酸度计, 瑞士梅特勒托利多公司; UV-2600型紫外-可见(UV-Vis)分光光度计, 岛津(香港)有限公司; HSX-UV型强紫外氙灯光源, 紫外光波长365 nm, 北京纽比特科技有限公司; SU8010型冷场发射扫描电子显微镜(SEM), 日立(中国)有限公司; Dimension Icon型原子力显微镜(AFM), 布鲁克(北京)科技有限公司; OCA20型接触角测试分析仪, 德国Dataphysics公司; DCAT11型表面张力仪, 德国Dataphysics公司.
1.2 实验过程
1.2.1 巯基修饰多糖高分子的制备 参照文献[10,25]方法, 采用酰胺化方法制备巯基修饰的多糖(Ps-SH). 将600 mg肝素钠和400 mg透明质酸钠作为多糖高分子(Ps)溶解于100 mL去离子水中(共含羧酸根2 mmol), 加入670 mg(3.5 mmol)EDC及472 mg(3.5 mmol)HOBt, 常温搅拌30 min, 使HOBt充分溶解; 加入460 mg(4 mmol)半胱胺盐酸盐; 待溶液澄清透明后, 缓慢滴加0.1 mol/L盐酸或氢氧化钠溶液至pH= 6.8, 溶液澄清透明; 室温搅拌约12 h后, 使用截留分子量为1000的透析袋, 在5 L去离子水中透析2 d, 每6 h换一次水; 透析结束后, 冻干得到粗产物. 将500 mg粗产物溶解于50 mL去离子水中, 加入600 mg DTT; 缓慢滴加0.01 mol/L氢氧化钠溶液调节pH=7.5; 室温反应3 h后使用1mol/L HCl调节pH=3.5; 使用截留分子量1000的耐酸透析袋, 在5 L pH=3.5 的100 mmol/L的NaCl溶液中透析1 d, 每6 h更换透析液一次; 在pH= 3.5的盐酸水溶液中透析1 d, 每6 h更换透析液一次; 透析结束后, 经过冷冻干燥即得到巯基修饰的多糖高分子, 密封真空保存.
1.2.2 凝胶预聚液的配制 将Ps-SH和PEGDA3400按照巯基与双键摩尔比1∶1溶解于光引发剂Irgacure 2959质量分数为0.1%的去离子水中, 配制不同浓度凝胶预聚液. 以质量分数为40%的凝胶预聚液为例, 将18 mg Ps-SH与22 mg PEGDA溶解于100 μL Irgacure 2959质量分数为0.1%的去离子水中, 搅拌得到半透明偏白溶液; 随着聚合物浓度降低, 溶液逐渐澄清透明.
1.2.3 超疏水微米阵列基底的构建 参照文献[16]方法制备超疏水微米阵列基底. 疏水微柱阵列硅基底由北京大学微纳中心制备, 聚乙烯醇(PVA)和聚二甲基硅氧烷(PDMS)基底则通过复型法制备[26], 微柱阵列基底的尺寸为1 cm2. 所有基底均通过气相化学修饰方法, 使用PFOS对微柱阵列基底进行超疏水修饰, 将氧等离子处理后的微柱阵列基底和100 μL PFOS于80 ℃真空反应12 h, 得到超疏水微柱阵列基底. 用2 μL去离子水对微柱阵列进行接触角测试, 并使用10 μL去离子水测试微柱阵列对水滴的黏附力.
1.2.4 微凝胶的制备 按照质量分数分别为10%, 20%, 30%和40%配制凝胶预聚液, 以经过PFOS修饰的微柱基底作为模板, 滴加20 μL左右凝胶预聚液, 以注射针头作为牵引, 带动凝胶预聚液液滴在超疏水微柱阵列基底上进行涂覆; 涂覆完全后将凝胶预聚液液滴吸去, 并将涂覆后的微柱基底置于低温高湿环境中, 在18 mW/cm2的紫外灯照射下固化10 min; 照射结束后取出微柱基底进行SEM测试, 观察未剥离时微柱顶端干态微凝胶形貌规律; 然后将微柱基底浸没于3 mL去离子水中, 超声振荡1 min, 以5000 r/min的速度离心水洗多次, 得到PsMH分散液.
1.2.5 微凝胶液下形貌测试 参照文献[27]方法, 使用原子力显微镜以液下模式对PsMH水下形貌及高度进行测试. 使用无水乙醇将盖玻片超声洗净后, 用N2气吹干; 采用浸渍提拉法, 将盖玻片放入质量分数为0.1%的PEI溶液中进行修饰, 取出后放于滤纸上自然风干; 在修饰后的载玻片上滴加50 μL PsMH分散液, 待水完全挥发后再次滴加, 重复3次后, 使用去离子水轻轻清洗载玻片, 洗去未黏附的PsMH及其它杂质; 在空气中待载玻片完全干燥后, 进行水下AFM测试.
2 结果与讨论
2.1 干态微凝胶的形貌
Scheme 1为微凝胶制备流程图. 将配制好的凝胶预聚液涂覆在超疏水微柱阵列结构硅基底上时, 一方面, 经疏水修饰后微柱阵列的水接触角约为150°, 呈现超疏水特性(图S1, 见本文支持信息), 液滴可以在微柱阵列上任意移动; 另一方面, 修饰后的微柱阵列对水的黏附力约为100 μN, 液滴在远离微柱阵列时产生形变(图S2, 见本文支持信息), 微柱阵列呈现高黏附力特性, 故液滴在微柱阵列上移动时, 液滴运动末端同微柱顶端产生液桥, 液桥断裂后在微柱顶端残留微液滴[21,23]. 微柱顶部均匀铺满微液滴后, 将其置于低温高湿环境中, 经紫外光照, 引发巯基基团与乙烯基基团的迈克尔加成反应, 固化得到分布于微柱顶端的PsMH[9,28]. 以微柱直径及凝胶预聚液浓度对PsMH进行命名, 如PsMH-310, 即代表在直径为3 μm的微柱结构基底上滴加质量分数为10%的预聚液液滴制备的PsMH.
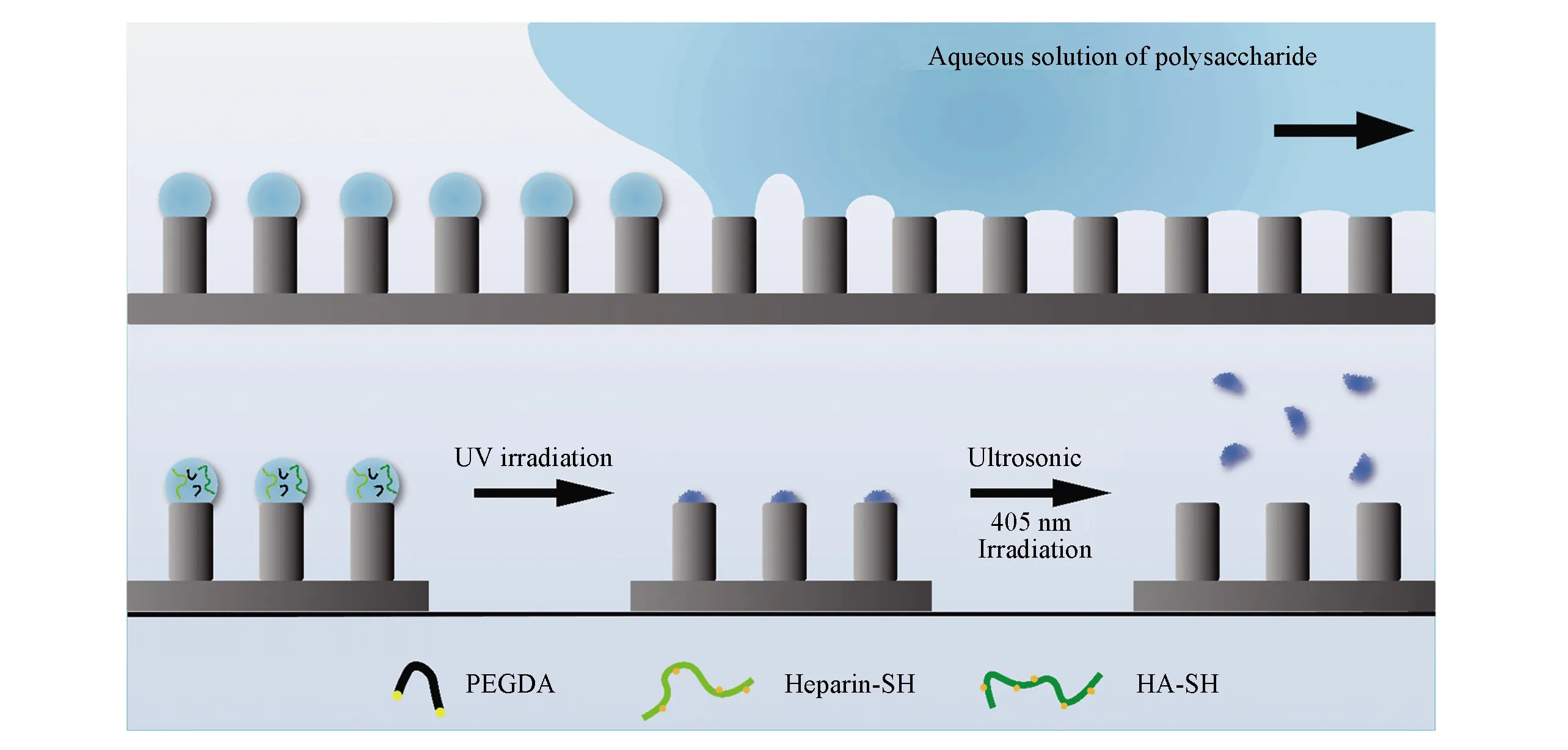
Scheme 1 Schematic diagram of fabricating polysaccharide micro-hydrogel(PsMH) on cylinder-structured Si substrate
为了研究微柱直径对微凝胶尺寸、形貌的影响, 使用质量分数为40%的凝胶预聚液, 以直径分别为(3, 6, 9, 12, 15 μm)的超疏水微柱基底为模板制备PsMH. 由图1(A~E)可见, PsMH均匀分布于微柱阵列顶端, 无明显缺陷, 且直径分布窄, PsMH尺寸随微柱直径增加而相应增加. 随着微柱尺寸增大至12 μm, 所制备的PsMH边缘略显不规则. 由对应的放大图可见, 处于干态的PsMH形状完整, 表面存在褶皱结构, PsMH同微柱之间边界明显. 侧视图[图1(F~J)]进一步验证PsMH均匀分布在微柱顶端, 且尺寸均一. 当微柱尺寸较小时, PsMH呈圆形扁平状结构; 随着微柱直径增加, PsMH高度与形貌也发生变化, 由扁平状逐渐转变为球冠状, 最终呈半球形. 这是由于随着微柱直径增大, 微柱顶端黏附的液滴体积迅速增大, 其中包含的聚合物总量也随之迅速增大, 所以固化后PsMH在形貌上有巨大差别. 由上述结果可见, 在凝胶预聚液浓度为40%时, 通过改变微柱直径, 可以调控PsMH的形貌, 在微柱结构基底上制备出结构规整、分布均匀、尺寸差异小的PsMH.

Fig.1 SEM images of top view(A—E) and side view(F—J) and relevant amplified images(insets) of PsMH fabricated on cylinder array with diameters of 3 μm(A, F), 6 μm(B, G), 9 μm(C, H), 12 μm(D, H) and 15 μm(E, J), respectively Mass fraction of the polymer precursor: 40%.
2.2 微凝胶的形貌变化
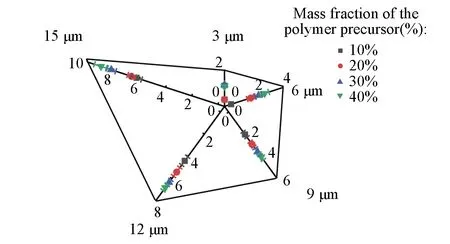
Fig.2 Size(diameter) distribution of PsMH
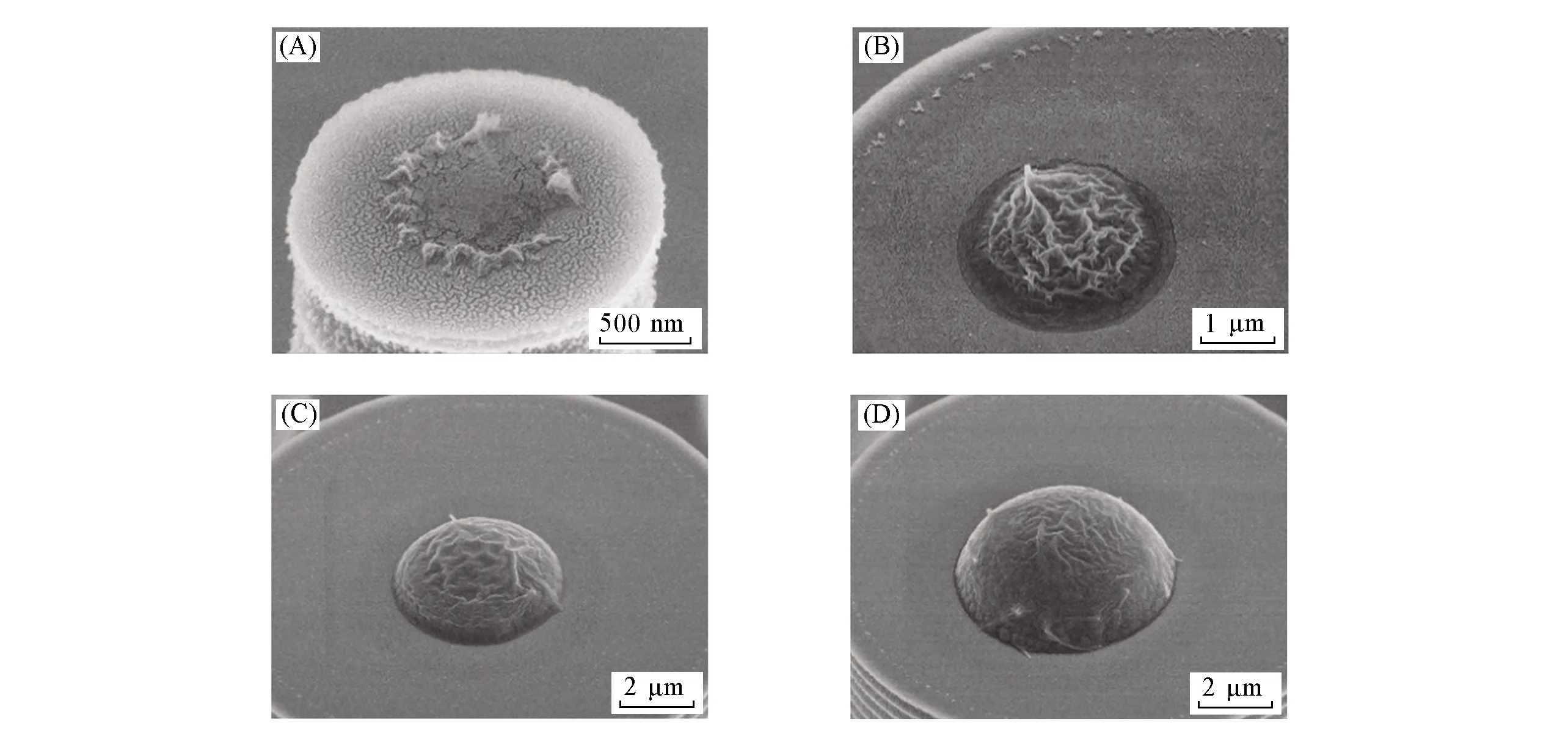
Fig.3 SEM images of side view of PsMH-310(A), PsMH-910(B), PsMH-1510(C) and PsMH-1540(D)
为了研究凝胶预聚液浓度对微凝胶尺寸和形貌的影响, 使用不同浓度(10%, 20%, 30%)凝胶预聚液重复上述实验. 由图2和图3可见, 当凝胶预聚液浓度与微柱直径均较小时(PsMH-310, PsMH-320, PsMH-610), PsMH呈现出不规则形貌, 而其它参数下均能形成结构完整的PsMH, 且具有较窄尺寸分布. 这是由于当微柱直径较小时, 微柱阵列顶端粘附的凝胶预聚液液滴尺寸较小, 凝胶预聚液中聚合物浓度较低, 导致微液滴中溶剂挥发过快, 微液滴在固化前聚合物和溶剂已经分相, 从而出现不完整凝胶形貌. 随着凝胶预聚液浓度或微柱直径增加, PsMH形貌趋于完整, 尺寸逐渐增加. 由图3(A)可见, 当凝胶预聚液浓度为10%时, 采用直径为3 μm的超疏水微柱阵列制备的凝胶存在凸起结构, 呈现非连续颗粒状, 未形成完整的PsMH形貌; 采用直径为9 μm超疏水微柱阵列制备的PsMH结构完整, 表面呈褶皱状, 但PsMH同微柱间边界不清晰[图3(B)]; 超疏水微柱阵列直径增加至15 μm时[图3(C)], PsMH表面褶皱减少, 与微柱间有清晰的边界; 保持超疏水微柱阵列直径不变, 增加凝胶预聚液浓度后, PsMH直径与厚度明显增大[图3(D)]. 上述结果表明, 通过改变预聚液浓度及微柱直径可以获得不同形貌的PsMH, 当预聚液浓度较低时, PsMH呈扁平状, 随着预聚液浓度增加, PsMH厚度增加, 并逐渐转变为半球状. 可以看出, 使用超疏水微柱阵列硅基底为模板可以进行不同形貌及尺寸的多糖基微凝胶的制备.
为了研究微凝胶尺寸与微柱黏附液滴中聚合物含量的关系, 以经疏水修饰的平整硅基底的水接触角模拟单个微柱顶端的水接触角. 由图S3(见本文支持信息)可见, 此时接触角为107°, 根据球缺体积公式估算黏附的微液滴体积. 不同直径微柱对应的液滴体积、聚合物含量及PsMH直径列于表1. 可见, 随着超疏水微柱阵列直径的增加, 其黏附微液滴的体积由11.5 μm3增加至1439.2 μm3, 聚合物含量亦由0.12 pg增加至57.57 pg, 微凝胶直径由(1±0.1) μm增加至(8.9±0.5) μm; 当预聚液浓度与超疏水微柱阵列直径均不相同时, 若黏附液滴中具有相似的聚合物含量, 也能制备出尺寸相似的PsMH. 这表明PsMH尺寸与形貌同微柱黏附液滴中聚合物含量相关.
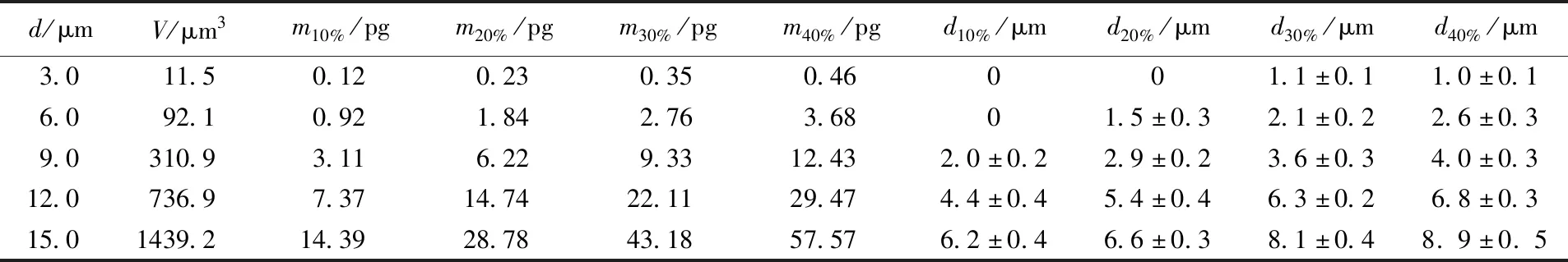
Table 1 Estimated micro-droplets volumes and polymer mass adhered to
*d: The diameters of cylinder array;V: the estimated volumes of micro-droplets;m10%—m40%: the estimated mass of polymer contained in the micro-droplets adhered to micro-cylinder with the concentration of 10%—40%;d10%—d40%: the diameter of PsMH fabricated with relevant concentration.
为了研究不同基底对PsMH制备的影响, 采用超疏水六边形微柱阵列基底、PVA超疏水微柱阵列基底及PDMS超疏水微柱阵列分别进行了微凝胶的制备. 首先改变超疏水微柱阵列的形状, 研究超疏水微柱阵列形状对PsMH形貌的影响, 使用经PFOS修饰的超疏水六边形微柱阵列基底进行PsMH制备, 凝胶预聚液质量分数为40%, 其它条件相同. 由图4(A)可见, 在超疏水六边形微柱阵列顶端, PsMH仍呈现出半球形形貌. 本文还研究了基底材料对PsMH制备的影响. 通过复型法制备了微柱直径为5 μm的PVA基底(PVA制备过程中收缩)和6 μm的PDMS基底, 经过PFOS修饰后, 得到不同材质的超疏水微柱阵列基底. 由图4(B)和(C)可见, 在PVA和PDMS超疏水微柱阵列基底上, 均能得到尺寸分布均一、均匀分布于超疏水微柱阵列顶端的半球形PsMH. 上述现象表明, 该制备方法不受微柱形貌的限制, 且适用于多种材料的基底, 具有一定的普适性.

Fig.4 SEM images and relevant amplified images(insets) of PsMH fabricated on hexagonal pillar-structured Si substrate(A), cylinder-structured PVA(B) and PDMS substrate(C)
2.3 湿态微凝胶的形貌

Fig.5 SEM images of the top view of PsMH-940(A) and the side view of PsMH-640(B) after being peeled off Insets are relevant amplified images.
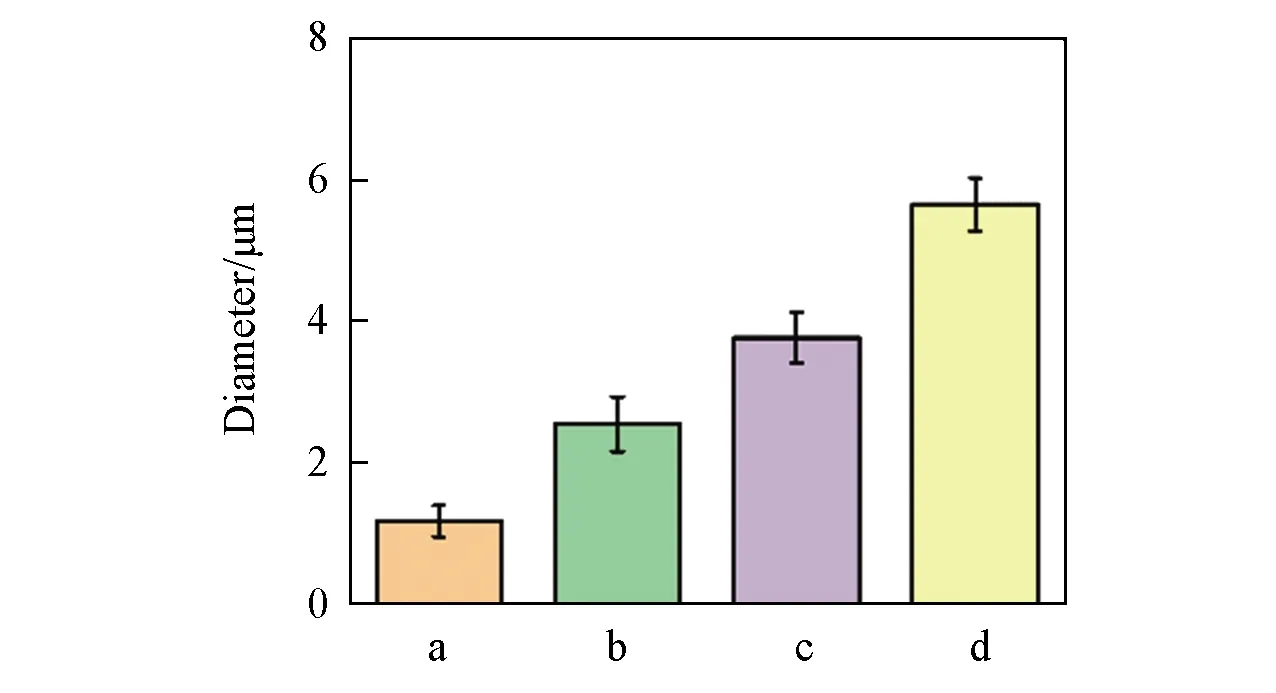
Fig.6 Size distribution of the peeled PsMH a. PsMH-340; b. PsMH-640; c. PsMH-940; d. PsMH-1240.
为研究剥离对PsMH形貌与尺寸的影响, 得到PsMH分散液后将其脱水干燥进行SEM测试. 由图5(A)和(B)可以看出, 剥离后的PsMH仍呈现半球形形貌, 结构未发生明显变化. 经统计后发现, 微凝胶尺寸同未剥离时相差较小, 但尺寸分布变宽(图6), 表明剧烈的超声剥离过程对PsMH的尺寸均一性有一定影响.

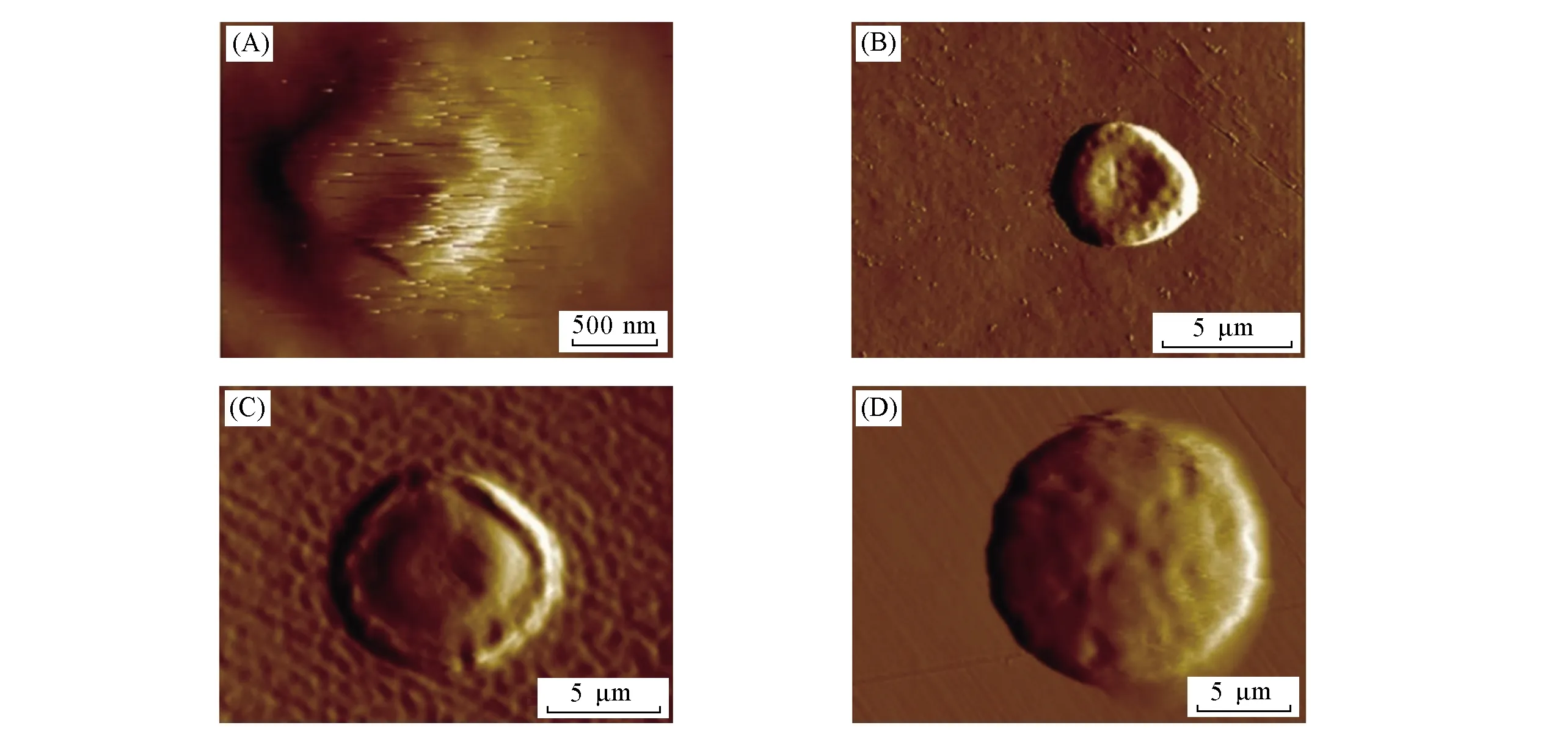
Fig.7 AFM images of PsMH-340(A), PsMH-40(B), PsMH-940(C), PsMH-1240(D) under water
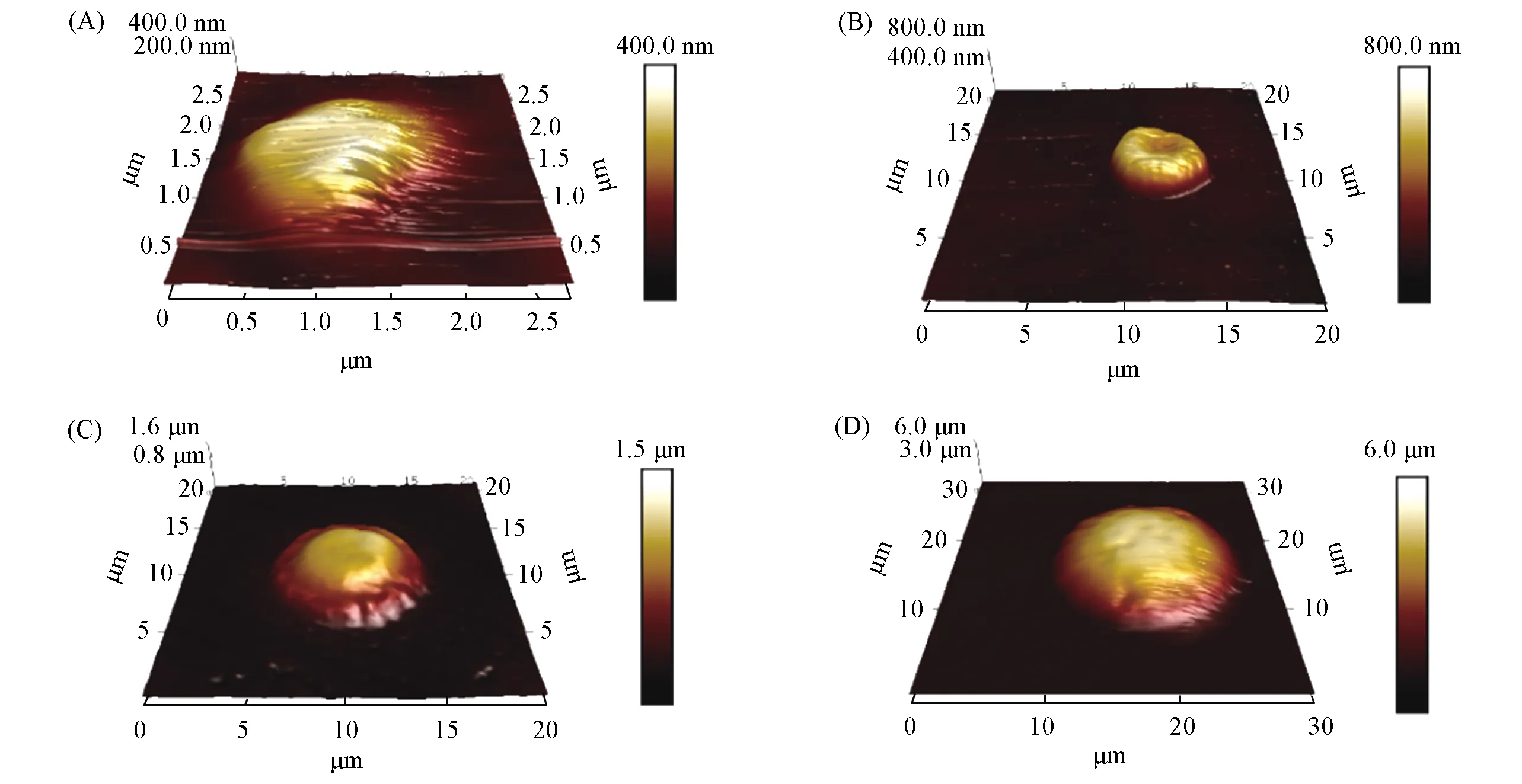
Fig.8 Height maps of PsMH-340(A), PsMH-40(B), PsMH-940(C), PsMH-1240(D) under water
3 结 论
提出了一种基于超疏水高黏附微柱阵列制备微米级凝胶的方法. 通过改变微柱尺寸及预聚液浓度, 制备出了一系列具有不同尺寸及不同形貌的PsMH. 研究发现, 随着微柱直径与预聚液浓度增大, PsMH的直径增大, 厚度增加. 经过超声水洗后, PsMH仍可保持完整形貌, 证明了该方法具有可控、有效及适用广泛的特点. 在今后的研究中, 有望在不同材料的基底表面实现多种高分子预聚液的大面积快速制备, 并有望通过功能分子的负载, 使多糖基微凝胶在药物递送、纳米粒子载体、细胞示踪及单细胞精准给药等领域得到广泛应用.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20200193.

