响应面优化酶解—微波辅助提取桑叶多糖的工艺研究
朱亚伟 王立涛 安娟艳 吕慕洁 孙建航 郭 娜 付玉杰*
(1.东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040;2.东北林业大学化学化工与资源利用学院,哈尔滨 150040;3.北京林业大学林学院,北京 100083;4.哈尔滨医科大学附属第一医院神经内科,哈尔滨 150000)
桑(MorusalbaL.)属于桑科(Moraceae)桑属(Morus)的乔木或灌木,原产我国中部和北部,现东北至西南各省区,西北直至新疆均有栽培[1]。桑叶不仅可以作为桑蚕的饲料,而且也是最常用的传统中药材,具有清热解表、疏散风热、清肝明目之功效[2]。桑叶中的活性物质主要有桑叶多糖、多酚、黄酮、生物碱、氨基酸以及维生素等[3],具有防治糖尿病、降低血压、抗氧化、抗炎[4]等药理作用。其中桑叶多糖(Mulberry leaves polysaccharides,MLPs)是桑叶的主要活性成分,具有多种生物活性,如降糖、抗炎、抗氧化和增强免疫力等[5]。随着人们健康意识的提高,对绿色食品的需求与日俱增,桑叶多糖受到了越来越多研究者的关注。程等[6]研究指出,桑叶多糖主要由鼠李糖、木糖、果糖、半乳糖、葡萄糖、甘露糖等单糖组成。Wu[7]通过α-淀粉酶辅助法提取了桑叶多糖MLP-1,通过动物实验指出MLP-1具有抑制肾纤维化的能力以及治疗糖尿病性肾病的潜力;Zhang等[8]研究指出,MLPsⅡ可抑制糖尿病大鼠胰岛细胞凋亡和改善胰岛β细胞分泌胰岛素的能力;Yuan等[9]研究指出,通过热水提取法得到的粗MLPs及其纯化馏分,通过体外研究,发现粗MLPs及其纯化馏分均表现出了较好的抗氧化活性,特别是具有清除超氧化物,ABTS自由基以及和Fe2+螯合的能力。目前对于桑叶多糖的提取方法主要有:超声提取法、酶——超声辅助提取法、微波辅助提取法、超高压提取法、热水——酶辅助提取法等[10]。其中酶解法具有耗能少,时间短以及提取的多糖品质高等特点,并且提取工艺简便,处理条件温和。微波辅助提取法相比其他传统提取方法,具有升温快速均匀、热效率高、无污染、溶剂回收率高等优点,可大大缩短提取时间,提高萃取率,节约成本。此外,当前以酶——微波辅助提取法进行桑叶多糖的提取未见报道。
因此本研究以桑叶多糖提取率为考察指标,采用酶解——微波辅助提取法,在单因素条件优化的基础上,结合具有试验次数少、周期短、精度高的Box-Behnken(BBD)-Response Surface Methodolog(RSM)响应面法进行桑叶多糖提取工艺的优化,以期获得桑叶多糖提取率较高的方法,为工业化提取桑叶多糖提供参考。
1 材料与方法
1.1 材料与试剂
桑叶,2018年采自于黑龙江省哈尔滨市东北林业大学林场(127°37′26″E,45°43′20″N),置鼓风干燥烘箱,45℃烘干至恒重,并粉碎至60目以下;纤维素酶,无水葡萄糖购自阿拉丁(上海)试剂有限公司;苯酚、浓硫酸、无水乙醇等均为分析纯。
1.2 仪器与设备
YP2002型电子天平,上海佑科仪器仪表有限公司;BT25S型电子天平,德国Sartorius公司;WFH-203型紫外分析仪,上海精科实业有限公司。
1.3 方法
1.3.1 葡萄糖标准曲线的绘制
本研究采用苯酚—硫酸法测定桑叶中的桑叶多糖含量[11],精密称取105℃下干燥至恒重的葡萄糖100.00 mg于100 mL容量瓶,用蒸馏水定容,摇匀后准确吸取10 mL该溶液,用蒸馏水稀释定容至100 mL,即得100 μg·mL-1的葡萄糖标准溶液;精密吸取葡萄糖标准溶液0、0.2、0.4、0.6、0.8、1.0和1.2 mL于7只试管中,分别补加蒸馏水至2 mL,然后再分别加入浓度为5%的苯酚溶液1.0 mL,摇匀,迅速加入5.0 mL浓硫酸,摇匀后置40℃水浴中加热15 min,取出后迅速冷却至室温,同时用蒸馏水的反应液做空白,通过分光光度计在波长490 nm处测定吸光值,以吸光度A为纵坐标(y),桑叶多糖浓度为横坐标(x)作标准曲线。
1.3.2 样品溶液的制备
取适量桑叶样品,加酶作用后,微波提取,减压过滤得到滤液,备用。
1.3.3 多糖含量与提取率的测定
精密吸取样品溶液1.0 mL置于10 mL容量瓶中,蒸馏水定容。然后精密量取0.125 mL稀释后样品溶液和0.875 mL蒸馏水(稀释80倍)于10 mL容量瓶中,加蒸馏水补至2 mL,然后再加入1.0 mL浓度为5%的苯酚溶液,摇匀,迅速加入5.0 mL浓硫酸,摇匀后置水浴中,40℃加热15 min,取出后迅速冷却至室温,同时用2.0 mL蒸馏水做空白,使用分光光度计在波长490 nm处测定吸光度。根据桑叶多糖的回归曲线方程求得其浓度。桑叶多糖提取率的计算公式:
桑叶多糖含量/%=(桑叶多糖质量/桑叶粉末质量)×100%
(1)
1.4 桑叶多糖提取的单因素试验
分别以超声辅助提取法(Ultrasonic assisted extraction,UAE)、酶解——超声辅助提取法(Enzymolysis-ultrasonic assisted extraction,EUAE)、微波辅助提取法(Microwave assisted extraction,MAE)、酶解——微波辅助提取法(Enzymolysis-microwave assisted extraction,EMAE),以及酶浓度(1%、2%、3%、4%、5%)、酶解温度(20、30、40、50和60℃)、pH(3、4、5、6、7)、酶解时间(20、30、40、50和60 min)进行单因素优化试验,考察这5个因素对桑叶多糖提取率的影响,每组单因素试验重复3遍。
1.5 BBD-RSM优化桑叶多糖的提取
根据Box-Behnken试验设计原理,在预实验结果基础上,选取液固比、提取时间和提取温度3实验因素进行3因素和3个水平实验,并对桑叶多糖提取工艺进行响应面分析,实验因素及水平见表1。

表1 因素水平表
2 结果与分析
2.1 桑叶多糖标准曲线的制备
在相同条件下通过分光光度计测定不同浓度桑叶多糖的吸光度,以桑叶多糖浓度为横坐标,以对应浓度下桑叶多糖的吸光度为纵坐标,得到桑叶多糖的标准曲线如图1。
拟合出的回归方程为y=0.006 5x+0.024 7,相关系数R2=0.992 8,说明在20~120 μg·mL-1范围中桑叶多糖与其吸光度之间线性关系良好,该标准曲线可用于后续实验分析。

图1 桑叶多糖的标准曲线Fig.1 Standard curve of MLPs
2.2 桑叶多糖提取的单因素试验结果
2.2.1 提取方法的筛选
提取方法是影响桑叶多糖提取率的重要因素,不同的提取方法机理各不相同,提取效果各异,因此本研究考察了不同提取方法对桑叶多糖提取率的影响。如图2所示,超声辅助提取法提取桑叶多糖时,其提取率为10.06%,采用酶解——超声辅助提取法时提取率升高至10.75%,采用酶解——微波辅助提取法桑叶多糖的提取效果最好,提取率为12.72%。因此本研究采用酶解——超声辅助提取法进行桑叶多糖的提取。

图2 不同提取方法对桑叶多糖提取率的影响Fig.2 Effect of different extraction methods on extraction yield of MLPs

图3 酶浓度、酶解温度、pH、酶解时间对桑叶多糖提取率的影响Fig.3 Effects of enzyme concentration, enzymolysis temperature, pH, and enzymolysis time on extraction yield of MLPs
2.2.2 酶浓度、酶解温度、pH、酶解时间对桑叶多糖提取率的影响
合适的酶浓度既可以最大限度的提高桑叶多糖的提取率,还可以节约酶试剂,减少资源的浪费。如图3A所示,酶浓度从1%升高至2%时,桑叶多糖的提取率得到了增加,但随着酶浓度的逐步增加,桑叶多糖的提取率呈现先降低后稳定的趋势,主要因为当酶浓度为2%时是酶活的最适浓度,酶浓度小于2%时,酶浓度偏低,酶解速率受限,当酶浓度大于2%,酶浓度的增加抑制了酶活性,造成桑叶多糖的提取率降低,因此桑叶多糖提取的最佳酶浓度为2%。
由于在酶解反应中,酶解温度显著影响酶活性,进而影响桑叶多糖的提取率,因此本研究考察了酶解温度对桑叶多糖提取率的影响。由图3B所示,随着温度的升高,桑叶多糖的提取率呈现先降低后急剧增高的趋势,当酶解温度为50℃时,桑叶多糖的提取率最高,较20℃升高了36.45%,但当温度升高至60℃时桑叶多糖的提取率降至最低。这是因为在20~50℃时,随着温度的升高,纤维素酶的活性和分子运动速率都得到增强,从而加速了细胞内物质的转移,但过高的温度可能会降低酶的活性,造成桑叶多糖提取率的降低。因此,桑叶多糖提取时的酶解温度为50℃。
在桑叶多糖提取过程中,pH也是通过影响酶活性进而影响桑叶多糖的提取率。由图3C所示,随着pH值的升高,桑叶多糖的提取率基本呈现先增高后降低的趋势,当pH为6时,酶活性最高,酶促反应效率最好,桑叶多糖提取率最高,当高于或低于此pH时,酶活降低,酶解速率减弱,桑叶多糖提取率降低。因此,提取桑叶多糖时的pH选择为6。
如图3D所示,当酶解时间从20 min增加至60 min过程中,桑叶多糖的提取率基本呈现先降低后稳定的趋势,当酶解时间为20 min时桑叶多糖的提取率最高,随着酶解时间的延长,酶解反应变得复杂,可能是因为生成其他非糖物质的含量增加,从而造成桑叶多糖提取率降低。因此,桑叶多糖提取的最适酶解时间为20 min。
2.3 桑叶多糖的BBD-RSM分析
2.3.1 桑叶多糖提取工艺的BBD分析
在单因素实验基础上,根据Box-Behnken实验设计原理,选择液固比、提取时间和提取温度进行三因素三水平的响应曲面分析法,对桑叶多糖的提取工艺进行优化,以确定桑叶多糖的最佳提取条件,实验结果见表2。实验结果采Design-Expert软件进行多元回归拟合,得到桑叶多糖提取得率(%)对液固比X1(mL·g-1)、提取时间X2(min)和提取温度X3(℃)的二次多项回归方程:Y=-192.85+3.73X1+2.39X2+4.27X3+8.61×10-3X1X2+0.01X1X3-1.08×10-3X2X3-0.15X12-0.10X22-0.03X32。
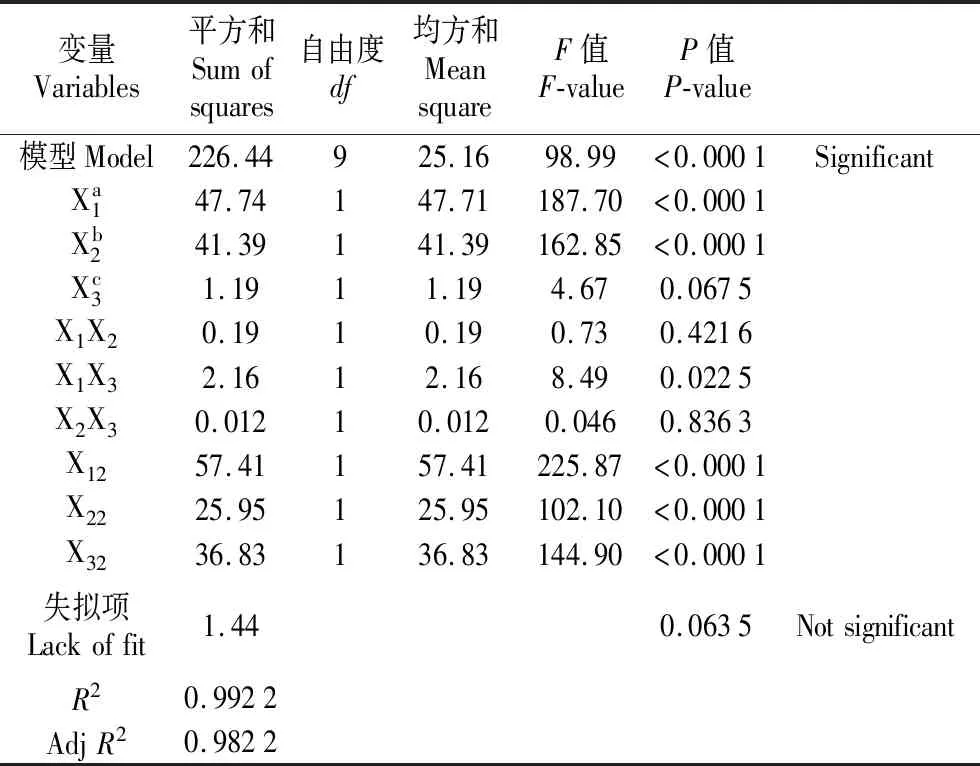
2.3.2 桑叶多糖提取工艺的方差分析
为了检验方程的有效性,对桑叶多糖提取的数学模型进行方差分析结果见表3。从表3可以看出,模型P<0.000 1,说明该回归模型达到了极显著水平,而失拟项P>0.05不显著,同时模型的相关系数R2=0.992 2,表明该回归模型拟合程度良好。此外,模型的修正相关系数AdjR2=0.982 2,说明该拟合方程很好的反映了液固比、提取时间以及提取温度与桑叶多糖提取率的关系。从该回归模型的方差分析还可以看出,液固比和提取时间对桑叶多糖提取率的影响极显著,二次项中X12,X22,X32的影响均达到极显著水平。因此,该模型可以用于对桑叶多糖的提取进行分析与预测。

图4 酶水解微波辅助提取桑的反应面 A.提取时间和液固比;B.提取温度和液固比;C.提取温度和提取时间Fig.4 The response surfaces of enzymolysis-microwave assisted extraction of MLPs A.Varying extraction time and liquid/solid ratio; B.Varying temperature and liquid/solid ratio; C.Varying temperature and extraction time
表2 从桑叶中提取桑叶多糖的Box-Behnken设计与结果
Table 2 Results of the Box-Behnken design for the extraction of MLPs from mulberryM.albaL. leaves

序号No.因素FactorsX1(La,mL·g-1)X2(tb,min)X3(Tc,℃)桑叶多糖提取率YieldofMLP(%)1-1(10)-1(5)0(75)4.2121(20)-1(5)0(75)7.963-1(10)1(15)0(75)8.1141(20)1(15)0(75)12.735-1(10)0(10)-1(65)5.5561(20)0(10)-1(65)9.677-1(10)0(10)1(85)4.4281(20)0(10)1(85)11.4790(15)-1(5)-1(65)5.95100(15)1(15)-1(65)10.82110(15)-1(5)1(85)7.26120(15)1(15)1(85)11.91130(15)0(10)0(75)13.98140(15)0(10)0(75)14.63150(15)0(10)0(75)14.28160(15)0(10)0(75)14.61170(15)0(10)0(75)14.63
注:a.液固比(mL·g-1);b.提取时间(min);c.提取温度 下同。
Note:a.Liquid/solid ratio(mL·g-1);b.Extraction time(min);c.Extraction temperature(℃) The same as below.
表3 从桑叶中提取桑叶多糖的二次模型的方差分析统计
Table 3 ANOVA statistics of the quadratic model for the extraction yield of MLPs from mulberryM.albaL. leaves
变量Variables平方和Sumofsquares自由度df均方和MeansquareF值F-valueP值P-value模型Model226.44925.1698.99<0.0001SignificantXa147.74147.71187.70<0.0001Xb241.39141.39162.85<0.0001Xc31.1911.194.670.0675X1X20.1910.190.730.4216X1X32.1612.168.490.0225X2X30.01210.0120.0460.8363X1257.41157.41225.87<0.0001X2225.95125.95102.10<0.0001X3236.83136.83144.90<0.0001失拟项Lackoffit1.440.0635NotsignificantR20.9922AdjR20.9822
2.2.3 响应面分析
通过响应面优化实验得到各因素之间交互作用的三维立体图,液固比、提取时间、提取温度的交互作用如图4所示。由图4A可以看出,随着提取时间的延长,桑叶多糖得率逐渐增高,提取时间达到12 min后,桑叶多糖的提取率趋于平衡,随着液固比的增大,桑叶多糖的提取率先增大后减小。由提取温度与液固比对桑叶多糖提取率的交互影响的响应面(图4B)可以看出,温度升高,桑叶多糖提取率增加,同时由于温度升高,桑叶多糖的降解也加剧,因此,温度过高不利于桑叶多糖的提取,随着液固比的增加,桑叶多糖的提取率也呈现出先增加后降低的趋势。由提取温度与提取时间对桑叶多糖提取率的交互影响的响应面(图4C)可以看出,提取时间增加,有助于提取的进行,但提取时间过长,也会引起桑叶多糖的部分降解,温度太低不利于反应的进行,太高反而会造成桑叶多糖水解。综上所述,液固比、提取时间、提取温度之间存在明显的交互作用。
2.4 优化提取参数与实验验证
在建立的数学模型的基础上,获得最佳实验条件如下:液固比15.59 mL·g-1,提取时间13.29 min,提取温度75.92℃,相应的桑叶多糖提取率为15.12%。考虑到桑叶多糖提取时的实际操作,将液固比,提取时间和提取温度分别修改为15 mL·g-1,13 min和76℃,此时MLPs的实际提取率为15.23%,与预测值之间的相对误差仅为0.72%,建立的模型真实可靠。
3 结论
本研究以桑叶多糖提取率为考察指标,在考察不同的提取方法、酶浓度、酶解温度、pH、酶解时间5个单因素的基础上,结合BBD-RSM方法优化了液固比、提取时间、提取温度。该模型拟合程度较高,能够适用于桑叶多糖提取条件的优化,最终获得了桑叶多糖的最佳提取条件:采用酶解—微波辅助提取法,在酶含量2%、酶解温度50℃、pH6、酶解时间20 min、液固比15 mL·g-1、提取时间13 min、提取温度76℃,在此条件下桑叶多糖的实际提取率为15.23%,与预测值之间的相对误差仅为0.72%,模型真实可靠。本研究为桑叶多糖的开发利用提供了重要的研究基础,具有一定的潜在应用价值。

