左旋多巴与脯氨酸或谷氨酸构成的环二肽的合成及其DPPH自由基清除活性测试
张小燕,任 毅,何延淼,胡碧煌,刘中强
(热带生物资源教育部重点实验室,海南大学 生命科学与药学院,海南 海口 570228)
环二肽(cyclodipeptide)含有一个2,5-二酮哌嗪(2,5-diketopiperazines)六元环结构;它广泛分布于多种生物体内,在细菌、真菌、植物和动物(包括人)中均有发现.许多环二肽表现出良好的生物活性,例如抗病毒、抗细菌、抗肿瘤、抗氧化和神经保护作用[1-3].氧化应激(oxidative stress) 可以导致细胞和组织损伤,引起炎症性肠病、早衰和癌症等疾病[4].2008年,Minelli等指出:cyclo(His-Pro)对血清缺乏下的大鼠肾上腺嗜铬细胞瘤细胞系(PC12)具有保护作用,可以阻止由自由基氧化、钙离子移动和创伤所引起的神经元死亡[5].
左旋多巴(L-3,4-dihydroxyphenylalanine,L-DOPA)是一种天然存在的稀有氨基酸;在生物体内一般由酪氨酸在酪氨酸羟化酶作用下转化而来[6].类似于丹参素和儿茶素等多酚类物质,左旋多巴分子中包含一个儿茶酚基团,因此左旋多巴及其衍生物具有一定的抗氧化活性[7],例如,Manchineella等在实验中发现,含多巴环二肽cyclo(DOPA-DOPA)与cyclo(DOPA-Phe)不仅具有良好的1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除活性,而且安全性好,在实验浓度下对PC12细胞没有细胞毒性[8].
含多巴环二肽的经典制备方法是:以酸催化并在高沸点醇中加热回流的方式促进含多巴直链二肽发生分子内环化反应[9-12],例如cyclo(DOPA-Gly)与cyclo(DOPA-Phe)的化学合成[8].该方法一般不适用于含活泼侧链的氨基酸,因为多数侧链保护基难以承受剧烈的高温和酸性条件.2008年,张崇敬等采用固相吸附加微波辐射的方法来制备脯氨酸与多巴形成的环二肽,结果由于高温(>200 ℃)引起了氨基酸严重消旋,虽采用液相色谱分离得到一对非对映异构体cyclo(L-DOPA-L-Pro) (1) (图 1.)和cyclo(L-DOPA-D-Pro) (1’)[13],但却难以排除非手性柱无法区分的旋光对映异构体的存在.最近,任毅等提出了采用缩丙酮保护多巴的儿茶酚基团,液相法合成N-Fmoc保护的直链二肽甲酯,然后在常温下以哌啶脱去Fmoc保护并催化分子内缩合来制备含多巴环二肽的方法[14].该方法有效避免了高温条件,所制得的保护状态的环二肽中间产物在常温下非常稳定,有利于储存,而且其又可以在95%的三氟乙酸(TFA)溶液中快速高效地转化成脱保护的环二肽,方便使用.

图1 左旋多巴与L/D-谷氨酸、L/D-脯氨酸形成的环二肽
本文首次在常温下以弱碱为催化剂,通过不引起氨基酸消旋的化学反应制备了光学纯的环二肽cyclo(L-DOPA-L-Pro)(1),并第一次合成了左旋多巴与L-或D-谷氨酸形成的一对环二肽非对映异构体.另外,采用DPPH自由基清除实验,以丹参素为对照,首次研究了这三种环二肽的抗氧化活性.
1 材料与方法
1.1 实验材料与仪器Fmoc-DOPA(Acetonide)-OH和H-DOPA(Acetonide)-OMe,依据文献报道由实验室合成[15-16];L-脯氨酸甲酯盐酸盐(H-Pro-OMe·HCl)、L-谷氨酸甲酯盐酸盐(H-Glu(OtBu)-OMe·HCl)和芴甲氧羰基-D-谷氨酸-5-叔丁酯(Fmoc-D-Glu(OtBu)-OH),购自吉尔生化;DPPH和其他相关试剂都购自阿拉丁或麦克林等公司.使用的仪器包括:Waters 2695-2998高效液相色谱仪、Bruker 400 MH超导核磁共振仪、LCMS-IT-TOF高分辨液质联用质谱仪、BUCHI(R-210)旋转蒸发仪、HERMLE 2326K高速冷冻离心机、FD-1C-50冻干机和BioTekGen5TM酶标仪.
1.2 合成途径A. 左旋多巴在N-端的直链二肽的合成及其环化反应路线(图2)
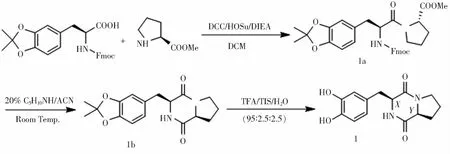
图2 左旋多巴在N-端的直链二肽的合成及其环化反应路线
1.2.1 Cyclo(L-DOPA-L-Pro)的合成
(1) Fmoc-DOPA(Acetonide)-Pro-OMe (1a) 的合成 将4.59 g(10 mmol) Fmoc-DOPA(Acetonide)-OH,2.27 g(11 mmol) 二环己基碳二亚胺(DCC), 2.3 g(20 mmol)N-羟基琥珀酰亚胺(HOSU)和100 mL二氯甲烷(DCM)加入到250 mL圆底烧瓶中,室温下反应1小时后,再加入1.65 g(10 mmol) H-Pro-OMe·HCl和3.42 mL(20 mmol) N,N-二异丙基乙胺(DIEA),然后室温下继续搅拌24 h.过滤掉不溶性白色固体,滤液采用饱和食盐水和蒸馏水各洗两遍,然后用无水硫酸镁(MgSO4)干燥4 h.滤掉MgSO4,滤液浓缩后采用柱层析法分离,接着用正己烷/DCM/乙酸乙酯(EtOAc)按极性由小到大梯度洗脱,得直链二肽1a 4.57 g,产率80%.HR-MS(ESI) m/z: Calcd for C33H34N2O7{[M+H]+} 571.243 9, Found: 571.244 5.
(2) Cyclo[DOPA(Acetonide)-Pro] (1b) 的合成 取一个100 mL的单口圆底烧瓶,加入一个搅拌子、15 mL乙腈和5 mL哌啶.称取2 g(3.5 mmol) 1a溶于10 mL 乙腈中并置入一10 mL注射器内,配制10 mL哌啶/乙腈(1:1)溶液并置入另一10 mL注射器内.把两个注射器固定在微量进样器上,以相同的速度(1 mL/h)缓慢滴入上述烧瓶中.加样后,室温下继续搅拌并使其反应12 h.采用柱层析法分离纯化,以正己烷/DCM/EtOAc按极性从小到大梯度洗脱.产物分离完成后,将所得滤液浓缩至少量,用石油醚沉淀出不溶性白色固体,离心5 min(4 ℃, 8000 r/min),倒掉上清液,放入真空干燥箱中干燥48 h,得到白色固体1b 0.86 g, 产率78%.1HNMR(400 M Hz, DMSO-d6):δ7.86(s, 1H), 6.76 (s, 1H), 6.692 (s, 1H), 6.690(s, 1H), 4.27(t,J=5.2 Hz, 1H), 4.07(t,J=8.1 Hz 1H), 3.42(m, 1H), 3.28(m, 2H), 2.99(dd,J=14.2, 5.1 Hz, 1H), 2.90(dd,J=14.2, 5.2 Hz, 1H), 2.05(m, 2H), 1.74(m, 2H), 1.60(s, 6H), 1.49(m, 2H).13C NMRδ:169.03, 165.08, 146.54, 145.36, 130.15, 122.29(CH), 117.47, 109.84(CH), 107.54(CH), 58.37(CH), 55.91(CH), 44.55(CH2), 35.03(CH2), 27.72(CH2), 25.46(CH3), 21.90(CH2). HR-MS(ESI)m/z: Calcd for C17H20N2O4{[M+H]+} 317.149 6, Found 317.150 3.
(3)Cyclo(L-DOPA-L-Pro) (1) 的合成 将100 mg(0.32 mmol) 1b加入到3 mL的脱保护液(TFA: TIS(三异丙基硅烷)∶H2O的体积比为95∶2.5∶2.5)中,搅拌两小时.反应完成后浓缩至少量液体,加入冰乙醚沉淀得白色絮状沉淀,离心5 min(4 ℃, 8000 r/min),倒掉上清液后得到白色固体沉淀,将其放入真空干燥箱中干燥4 h,加入5 mL冰乙酸冷冻成冰后放入冻干机冻干48 h,得蓬松白色固体状环二肽1 80.35 mg, 产率92%.1H (400 M Hz, DMSO-d6):δ7.71(s, 1H), 6.64(s, 1H), 6.58(d,J=8.0 Hz, 1H), 6.48(d,J=8.0 Hz, 1H), 4.20(t,J=5.2 Hz, 1H), 4.06(t,J=8.3 Hz, 1H), 3.44(m, 1H), 3.27(m, 1H), 2.89(dd,J=14.2, 4.9 Hz, 1H), 2.81(dd,J=14.2, 5.2 Hz, 1H), 2.00(m, 2H), 1.73(m, 2H), 1.46(m, 2H).13C NMRδ: 168.91, 165.23, 145.23, 144.23, 127.59, 120.43(CH), 117.60(CH), 115.57(CH), 58.43(CH), 55.95(CH), 44.58(CH2), 34.88(CH2), 27.81(CH2), 21.91(CH2). HR-MS(ESI)m/z: Calcd for C14H16N2O4{[M+H]+} 277.118 3, Found: 277.118 9.
1.2.2 Cyclo(L-DOPA-L-Glu)的合成采用类似于图2的合成路线,首先Fmoc-DOPA(Acetonide)-OH与H-L-Glu(OtBu)-OMe缩合成L-DOPA在N-端的直链二肽衍生物,然后经25%哌啶催化环化和在95% TFA中脱去保护基.
(1)Fmoc-DOPA(Acetonide)-L-Glu(OtBu)-OMe (2a) 的合成 将1.15 g(2.5 mmol) Fmoc-DOPA(Acetonide)-OH、0.95 g(2.5 mmol) HBTU、0.63 g(2.5 mmol) H-Glu(OtBu)-OMe·HCl、0.83 mL(5 mmol) DIEA和100 mL DMF加入圆底烧瓶中,在室温下搅拌24 h.采用高真空旋转蒸发浓缩反应液至少量,加入饱和NaHCO3水溶液,以乙酸乙酯萃取.然后,用无水Na2SO4将有机相干燥3 h,过滤除去Na2SO4,旋蒸除去溶剂,过滤,得到直链二肽2a 1.24 g,产率75%.HR-MS(ESI)m/z: Calcd for C37H42N2O9{[M+H]+} 659.296 3, Found 659.299 3.
(2)Cyclo[DOPA(Acetonide)-L-Glu(OtBu)] (2b) 的合成 将0.66 g(1 mmol)直链二肽Fmoc-DOPA(Acetonide)-Glu(OtBu)-Ome加入到10 mL 的25%哌啶/乙腈溶液中,搅拌24 h.将所得悬浊液旋蒸浓缩,用乙醚沉淀,离心5 min (4 ℃, 8000 r/min),并洗涤5次,得白色固体2b 0.27 g, 产率68%.1HNMR (400 M Hz, DMSO-d6)δ: 8.18(s, 1H), 8.10(s, 1H), 6.68(d,J=7.8 Hz, 1H), 6.59 (d,J=1.6 Hz, 1H) 6.55(dd,J=7.8,J=1.6 Hz, 1H), 4.13(m, 1H), 3.71(t,J=5.5 Hz 1H), 3.17(d,J=3.4 Hz, 2H), 3.05(dd,J=13.6, 3.5 Hz, 1H), 2.73(dd,J=13.6, 4.8 Hz, 1H), 1.68(m, 2H), 1.59(s, 6H), 1.36(s, 9H).13C NMRδ:171.57, 166.36, 166.17, 146.60, 145.79, 128.79, 122.76(CH), 117.58, 110.37(CH), 107.62(CH), 79.50, 55.32(CH), 53.02(CH), 37.61(CH2), 29.65(CH2), 28.74(CH2), 27.73(CH3), 25.51(CH3). HR-MS(ESI)m/z: Calcd for C21H28N2O6{[M+H]+} 405.202 0, Found 405.231 3.
(3)Cyclo(L-DOPA-L-Glu) (2) 的合成 环二肽2的合成方法与1的类似,取0.40 g (1 mmol) 2b,在12 mL 的TFA/TIS/ H2O(95∶2.5∶2.5)脱保护液中反应,得到环二肽2 0.3 g,产率96%.1H NMR (400 M Hz, DMSO-d6+CD3COOD):δ8.08(d,J=2.4 Hz, 1H), 8.03(d,J=2.4 Hz, 1H),6.59(d,J=8.0, 1H), 6.55(d,J=2.0 Hz, 1H), 6.40(dd,J=8.0,J=2.0 Hz, 1H), 4.03(t,J=5.3 Hz, 1H), 3.70(t,J=5.7 Hz, 1H), 2.91(dd,J=13.7, 4.4 Hz, 1H), 2.68(dd,J1=13.7, 4.8 Hz, 1H), 1.91(m, 2H), 1.37~1.20(m, 2H).13C NMRδ: 173.97, 166.85, 166.73, 144.89, 144.20, 126.72, 120.93(CH), 117.66(CH), 115.13(CH), 55.59(CH), 53.09(CH), 37.81(CH2), 28.93(CH2), 28.81(CH2). HR-MS(ESI)m/z: Calcd for C14H16N2O6{[M-H]-} 307.093 6, Found 307.093 7.
B. 左旋多巴在C-端的直链二肽的合成及其环化反应路线(图3)
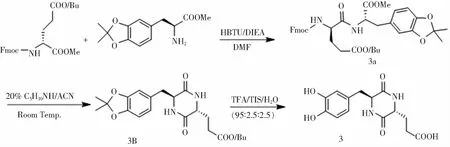
图3 左旋多巴在C-端的直链二肽的合成及其环化反应路线
1.2.3 Cyclo(L-DOPA-D-Glu)(3)的合成
(1)Fmoc-D-Glu(OtBu)-DOPA(Acetonide)-OMe (3a) 的合成 将0.72 g(2.5 mmol) H-DOPA(Acetonide)-OMe·HCl、0.95 g(2.5 mmol) HBTU、1.06 g(2.5 mmol) Fmoc-D-Glu(OtBu)-OH、0.83 mL (5 mmol) DIEA和100mL DMF加入圆底烧瓶中,在室温下搅拌反应24 h.采用高真空旋转蒸发浓缩反应液至少量,加入饱和NaHCO3水溶液,以乙酸乙酯萃取.然后,用无水Na2SO4将有机相干燥3 h,过滤除去Na2SO4,旋蒸除去溶剂,过滤,得到直链二肽3a 1.2 g,产率75%.HR-MS(ESI)m/z: Calcd for C37H42N2O9{[M+H]+} 681.278 3,Found 681.275 4.
(2) Cyclo[DOPA(Acetonide)-D-Glu(OtBu)] (3b) 的合成 化合物3b的合成方法与化合物2b的类似,最终得3b 0.23 g,产率56%.1H NMR (400 M Hz, DMSO-d6):δ8.10(d,J=2.3 Hz, 1H), 8.04 (s, 1H), 6.70(d,J=7.8 Hz, 1H), 6.61(d,J=1.6 Hz, 1H), 6.58(dd,J=7.8,J=1.6 Hz, 1H), 4.05(m, 1H), 3.20(t,J=5.2 Hz, 1H), 2.98(dd,J1=13.6, 4.6 Hz, 1H), 2.78(dd,J1=13.7, 4.8 Hz, 1H), 2.16 (m, 2H), 1.78(m, 2H), 1.60(s, 6H), 1.37(s, 9H).13C NMRδ: 171.52, 167.41, 167.26, 146.54, 145.67, 128.91, 122.61(CH), 117.60, 110.02(CH), 107.73(CH), 79.66, 55.48(CH), 52.41(CH), 38.04(CH2), 30.01(CH2), 27.69(CH3), 27.53(CH) 25.40(CH3). HR-MS(ESI)m/z: Calcd for C21H28N2O6{[M+H]+}427.184 0, Found 427.180 1.
(3) Cyclo(L-DOPA-D-Glu) (3) 的合成 环二肽3的合成方法与1的类似,取0.41 g(1 mmol) 3b, 在12 mL 的TFA/TIS/ H2O(95∶2.5∶2.5)脱保护液中反应,得环二肽3 0.27 g,产率89%.1H NMR (400 M Hz, DMSO-d6+CD3COOD):δ8.08(d,J=2.5 Hz, 1H), 7.98(s, 1H), 6.60(d,J=8.0 Hz, 1H), 6.56(d,J=2.0 Hz, 1H), 6.40(dd,J1=8.0,J2=2.0 Hz, 1H), 3.99(s, 1H), 3.08(t,J=5.0 Hz, 1H), 2.91(dd,J1=13.7, 4.3 Hz, 1H), 2.68(dd,J1=13.7, 4.8 Hz, 1H), 2.19(m, 1H), 2.09(m, 1H), 1.77(m, 2H).13C NMRδ: 173.97, 167.80, 167.32, 144.87, 144.12, 126.55, 120.90(CH), 117.61(CH), 115.32(CH), 55.84(CH), 52.34(CH), 38.15(CH2), 28.85(CH2), 27.20(CH2). HR-MS(ESI)m/z: Calcd for C14H16N2O6{[M-H]-} 307.093 6, Found 307.093 8.
1.3 DPPH自由基清除活性测定DPPH自由基清除活性测定参考了Manchineella、Furukawa[2,17]和何延淼[18]的方法,并做了略微修改.
(1)DPPH自由基清除测试溶液的配制 DPPH溶液的配制:将5.91 mg(15 μmol)的DPPH加入到10 mL无水乙醇中,超声10 min,使其充分溶解,制成浓度为1.5 mmol·L-1的DPPH母液,备用.取母液1 mL,用无水乙醇稀释至0.15 mmol·L-1,用微孔滤膜(0.22 μm) 过滤备用,避光保存,在3.5 h内用完.待测样品溶液的配制:将待测样品用超纯水或二甲基亚砜(DMSO)充分溶解,用无水甲醇稀释成浓度为300、240、180、120、60 μmol·L-1的溶液,用微孔滤膜(0.22 μm) 过滤,备用.
(2)DPPH自由基清除活性的测定方法 以丹参素为阳性对照,取100 μL不同浓度的待测样品或阳性对照溶液于96孔板中,各加入200 μL的DPPH(0.15 mmol·L-1)溶液,避光静置反应30 min后,在酶标仪515 nm处测定吸光度值OD1;取样品溶剂100 μL,加入200 μL 的DPPH(0.15 mmol·L-1)溶液,测得的吸光度为OD0,取200 μL无水乙醇溶液代替DPPH为空白组,测得的吸光度为OD2;每个浓度设置3个复孔,每个样品重复3次,取平均值.按下式计算DPPH自由基清除率:DPPH自由基清除率= [1-(OD1-OD2)/OD0]×100%;计算IC50,IC50的计算是通过软件GraphPad Prism 6的Log(agonist)vs.response—Variable slope(four parameters)方法求出.
2 结果与讨论
2.1 三种含多巴环二肽的合成在20种常见氨基酸中,脯氨酸是唯一以刚性五元环作侧链的仲胺氨基酸,其α-氨基的反应活性比相应的伯胺基要弱,因此脯氨酸氨基端肽键的形成最好发生在合成直链二肽的反应中,而不是发生在进行分子内环化反应时,以避免后者反应困难或不进行.在常见碳二亚胺型缩合剂DCC作用下,Fmoc-DOPA(acetonide)-OH与H-Pro-OMe·HCl 反应成功合成了L-DOPA在N-端的直链二肽衍生物1a:HR-MS m/z Calcd for C33H34N2O7{[M+H]+} 571.243 9, Found 571.244 5.在有机碱哌啶作用下,N-Fmoc经β-消除快速脱去,新产生的α-伯胺基与直链二肽另一端的活泼甲酯发生分子内胺酯交换反应形成热力学上更稳定的环二肽结构1b:HR-MS(ESI)m/zCalcd for C17H20N2O4{[M+H]+} 317.149 6, Found 317.150 3.采用缩丙酮保护L-DOPA的侧链,有效避免了其儿茶酚基团在碱性条件下的氧化交联等多种副反应,使得在DIEA碱性条件下的直链二肽合成和在哌啶碱性条件下的分子内环化反应可以顺利进行.化合物1b在95% TFA溶液中快速(2h)高效地脱去缩丙酮保护而转化成目标环二肽1.本文采集了该环二肽的NMR数据,发现与文献报道的、经液相色谱纯化后的环二肽1的数据吻合很好,表明本方法避免了分离结构相似的旋光对映体或非对映体杂质.
谷氨酸是一种常见的、侧链带负电荷的氨基酸;其L-和D-型旋光异构体可分别与L-DOPA反应而形成一对环二肽非对映异构体.采用上述合成路线,Fmoc-DOPA(Acetonide)-OH 与购买的叔丁酯保护的谷氨酸衍生物H-L-Glu(OtBu)-OtBu反应,经三步反应制备了环二肽cyclo(L-DOPA-L-Glu).由于D-型谷氨酸叔丁酯衍生物价格贵且难以购买到,环二肽cyclo(L-DOPA-D-Glu)的制备采用了另一种合成策略(图3):以可购买到的Fmoc-D-Glu(OtBu)-OH中间体与实验室合成的多巴甲酯衍生物H-DOPA(Acetonide)-OMe反应,制备了多巴在C-端的直链二肽甲酯3a:HR-MS(ESI) m/z Calcd for C37H42N2O9{[M+H]+} 681.278 3,Found 681.275 4.同样,经哌啶催化环化,然后在TFA中脱去缩丙酮保护,获得了目标环二肽cyclo(L-DOPA-D-Glu).环二肽2由两种L-型氨基酸构成,其氨基酸残基侧链处于二酮哌嗪六元环的同一面(顺式结构);环二肽3由手性不同的L-DOPA和D-Glu构成,其残基侧链分处于二酮哌嗪环的不同面(反式结构);因此环二肽3的两个侧基相隔更远,不易产生空间阻碍效应,导致其哌嗪环结构要比环二肽2的结构在热力学上更稳定.
比较3对非对映异构环二肽的核磁数据(表1)发现,L-DOPA残基上X-H和X-C的化学位移分别保持在一个小范围内变动,3.86×10-6~4.21×10-6和5.532×10-5~5.727×10-5.顺式环二肽的X-H化学位移一般都大于相应反式环二肽的值,暗示反式结构降低了X-H的去电子屏蔽效应;X-C的情况则相反,顺式环二肽的X-C化学位移一般小于相应反式环二肽的.这表明,环二肽的另一个氨基酸对L-DOPA残基的性质可以产生一定的影响,但程度不是很大.
对于环二肽的Y位点而言,不同环二肽的Y-H化学位移差别明显,范围在2.92~4.06 ppm之间;顺式环二肽Y-H的化学位移一般都大于反式环二肽的,且差别较大(5.2×10-7~1.12×10-6).顺式环二肽1的Y-C化学位移远大于反式环二肽1′的位移,差值约为4.05×10-6;然而,顺式环二肽2和2b的Y-C化学位移却小于相应的反式环二肽3和3b的化学位移,虽然差值只有6.1×10-5~7.5×10-5.这表明环二肽Y位点的化学位移受其所在氨基酸残基侧链的性质影响较大;另外,L-DOPA与D-Glu成反式结构导致了Y-H上电子屏蔽效应增强,这可能归因于儿茶酚的芳香性.
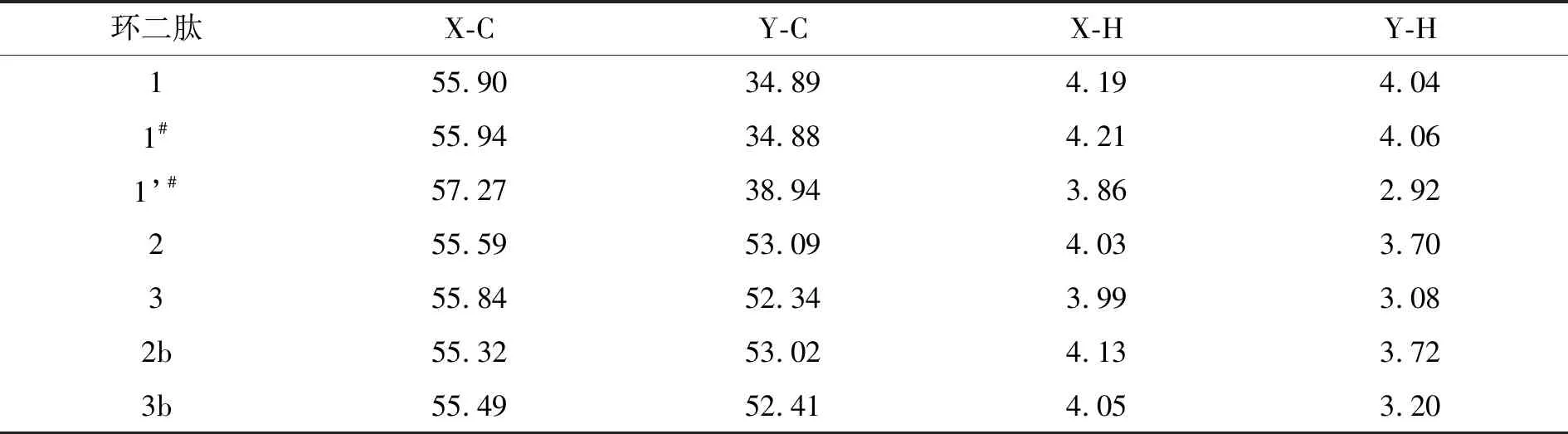
表1 三对环二肽非对映异构体的核磁数据对比 ×10-6
2.2 含左旋多巴环二肽L-Glu、D-Glu、L-Pro的自由基清除活性以常见抗氧化剂丹参素为对照,DPPH 自由基清除实验(图 1)表明:含多巴环二肽1, 2, 3都具有一定的抗氧化能力,但都不如L-DOPA;这暗示含多巴环二肽的自由基清除能力主要来自于其侧链的儿茶酚基团,而且环二肽的哌嗪环并不能提高其自由基清除能力.在被测试的3种环二肽中,环二肽2的清除能力最强,其IC50(18.9 μmol·L-1)值低于Vc(32.8 μmol·L-1)和丹参素(22.5 μmol·L-1);另外,环二肽2的自由基清除能力高于与其结构非常类似的非对映异构体环二肽3,暗示顺式结构有利于儿茶酚捕获DPPH自由基.
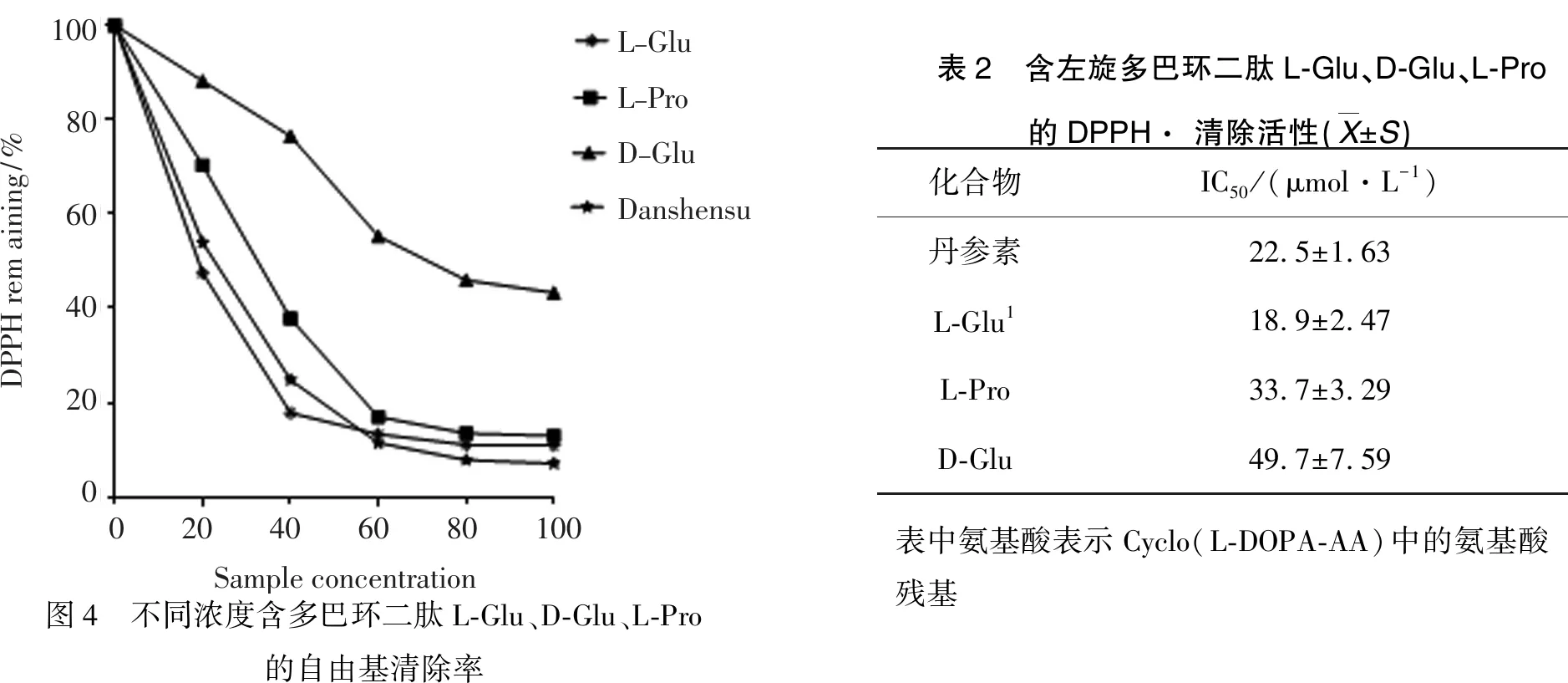
100806040200DPPHremaining/%L-GluL-ProD-GluDanshensu020406080100Sampleconcentration图4 不同浓度含多巴环二肽L-Glu、D-Glu、L-Pro的自由基清除率表2 含左旋多巴环二肽L-Glu、D-Glu、L-Pro的DPPH· 清除活性(X±S)化合物IC50/(μmol·L-1)丹参素22.5±1.63L-Glu118.9±2.47L-Pro33.7±3.29D-Glu49.7±7.59表中氨基酸表示Cyclo(L-DOPA-AA)中的氨基酸残基
3 结 论
采用缩丙酮保护L-DOPA的儿茶酚基,成功地避免了L-DOPA在碱性环境下的氧化交联问题,减少了在制备含多巴直链二肽的反应中副产物的生成,简化了中间产物的分离和纯化,提高了目标直链二肽的收率和纯度.其次,缩丙酮保护在碱性条件下非常稳定,从而可以让含多巴的直链二肽于常温下和在哌啶催化下稳定地进行分子内环化反应,有效避开了高温加热环化的不利条件,非常适合用于制备L-DOPA与含活泼侧链氨基酸组成的环二肽.缩丙酮保护的环二肽不仅性质稳定和易于保存,且使用方便.含多巴的环二肽具有一定的抗氧化活性,其中,由L-DOPA于L-Glu构成的顺式环二肽的活性最好,高于其反式对映异构体.

