CD8+T淋巴细胞表面抑制性受体NKG2A高表达在肺腺癌组织中的临床研究
马名扬 原翔 刘怡文 孙江涛


[摘要] 目的 分析CD8+T淋巴细胞表面抑制性受体NKG2A表达与肺腺癌患者临床病理特征及5年生存期的相关性,并探讨其临床意义及预后价值。 方法 选择2014年1月~2015年3月河南科技大学第一附属医院手术切除的130例表皮生长因子受体(EGFR)为阳性的肺腺癌患者癌组织及相应癌旁肺组织石蜡包埋标本为研究对象,采用免疫组织化学方法检测其组织中浸润的CD8+T淋巴细胞表面NKG2A蛋白表达情况,并分析NKG2A的表达与肺腺癌患者临床病理特征及5年生存期的相关性;采用Cox回归法分析各因素对预后的影响;采用Kaplan-Meier法分析NKG2A蛋白高表达与生存时间之间相关性。 结果 肺腺癌及相应癌旁肺组织中浸润的CD8+T淋巴细胞胞膜均可见NKG2A蛋白表达,在肺腺癌组织中,中、低分化NKG2A免疫组化评分高于高分化,且低分化高于中分化(P < 0.05)。NKG2A蛋白高表达与肺腺癌患者的分化程度、淋巴结转移、临床分期及5年生存情况具有相关性(P < 0.05)。NKG2A蛋白高表达为影响肺腺癌患者预后的独立危险因素。且NKG2A蛋白高表达患者的5年生存率及中位生存时间均明显低于低表达,差异有统计学意义(P < 0.05)。 结论 CD8+T淋巴细胞表面抑制性受体NKG2A高表達,可能通过削弱其抗肿瘤免疫,促进了肺腺癌的发生发展。抑制NKG2A表达可能为肺腺癌的免疫治疗提供新的思路和有效治疗手段。
[关键词] 肺腺癌;CD8+T淋巴细胞;自然杀伤细胞表面抑制性受体A;预后
[中图分类号] R734.2 [文献标识码] A [文章编号] 1673-7210(2020)06(c)-0015-05
[Abstract] Objective To analyze the correlation between expression of CD8+T cell surface inhibitory receptor NKG2A and clinicopathological characteristics and 5-year survival in patients with lung adenocarcinoma, and to explore its clinical significance and prognostic value. Methods From January 2014 to March 2015, 130 cases of lung adenocarcinoma with epidermal growth factor receptor (EGFR) (+) were resected in the First Affiliated Hospital of He′nan University of Science and Technology, and the paraffin-embedded samples of the carcinema tissues and adjacent lung tissues of patients with lung adenocarcinoma were selected as the research objects, immunohistochemistry was used to detect the expression of NKG2A protein on the surface of infiltrated CD8+T lymphocytes, and the correlation between NKG2A expression and clinicopathological characteristics and 5-year survival in patients with lung adenocarcinoma was analyzed. The influence of each factor on prognosis was analyzed by Cox regression method. The correlation between NKG2A protein expression and survival time was analyzed by Kaplan-Meier method. Results The expression of NKG2A protein was observed in the membrane of infiltrated CD8+T lymphocytes in lung adenocarcinoma and corresponding adjacent lung tissues, in lung adenocarcinoma tissues, the immunohistochemical score of NKG2A was higher than that of high differentiation and low differentiation than that of medium differentiation (P < 0.05). High expression of NKG2A protein was associated with differentiation, lymph node metastasis, clinical stage and 5-year survival in patients with lung adenocarcinoma (P < 0.05). The degree of differentiation, lymph node metastasis, clinical stage and high expression of NKG2A protein were independent risk factors for the prognosis of patients with lung adenocarcinoma. Moreover, the 5-year survival rate and median survival time of patients with high NKG2A protein expression were significantly lower than those with low expression, with statistically significant differences (P < 0.05). Conclusion The high expression of the inhibitory receptor NKG2A on the surface of CD8+T lymphocytes may promote the development of lung adenocarcinoma by weakening its anti-tumor immunity. Inhibition of NKG2A expression may provide a new idea and an effective treatment for lung adenocarcinoma.
[Key words] Lung adenocarcinoma; CD8+T lymphocytes; NKG2A; Prognosis
肺癌已成为世界发病率增幅最大的癌症之一,且在相当长的时间内,它将稳居癌症死亡原因之首位[1],主要分为两大组织学类型,小细胞肺癌与非小细胞肺癌。肺腺癌为非小细胞肺癌的重要组织学亚型,早期多表现为呼吸系统疾病的一般症状,如咳嗽、低热、胸痛等,易被忽略,确诊时多发展至晚期,预后极差[2]。随着医学研究的不断发展、进步,靶向治疗逐渐成为一种新的治疗方式。前期研究大都集中在癌细胞自身,有关肿瘤微环境的作用则探讨不多。实际上,肿瘤的发生发展与肿瘤微环境密切相关[3-4]。
肿瘤微环境是肿瘤细胞赖以生长的特殊环境,研究显示肿瘤细胞与肿瘤微环境之间的互相作用可能参与了肿瘤的发生发展,且对免疫细胞抑制性受体表达进行调节,导致肿瘤的免疫逃逸[4]。著名的NKG2A属于C型(钙依赖型)凝集素超家族的Ⅱ型糖蛋白,基因定位于人12号染色体短臂,胞内段含有2个ITIM,因而具有抑制功能,传递负反应信号。相关研究[5-6]表明,特异CD8+T淋巴细胞表面都会表达NKG2A等抑制性受体,从而削弱其抗肿瘤免疫,增加肿瘤微环境免疫抑制状态,促进肿瘤的发生发展。
本研究通过免疫组织化学方法检测肺腺癌患者癌组织及相应癌旁肺组织中浸润的CD8+T淋巴细胞NKG2A蛋白表达情况,并分析其高表达与肺腺癌患者临床病理特征及5年生存期之间相关性,发现NKG2A蛋白高表达与肺腺癌的恶性进展之间存在相关性,抑制NKG2A蛋白的表达可以作为靶向治疗的一个新途径。
1 资料与方法
1.1 一般资料
选择2014年1月~2015年3月河南科技大学第一附属医院手术切除的表皮生长因了受体(EGFR)为阳性的肺腺癌患者癌组织及相应癌旁肺组织石蜡包埋标本为观察对象,纳入标准:①治疗性肺腺癌切除术后,同时具备癌组织及相应癌旁肺组织(距癌组织边缘> 5 cm);②术前均未接受免疫治疗及放、化疗;③术后病理诊断为肺腺癌;④随访时间为5年。共纳入组织标本130例,其中男73例,女57例;年龄≤60岁57例,年龄>60岁73例;高、中及低分化分别有34、70及26例;有淋巴结转移51例,无淋巴结转移79例;临床分期Ⅰ~Ⅱ期75例,Ⅲ~Ⅳ期55例。本研究经河南科技大学第一附属医院及河南科技大学肿瘤研究所医学伦理委员会审核批准,并于术前获得患者书面知情同意。
1.2 试剂与仪器
免疫组织化学试剂盒(北京中杉金桥生物技术有限公司,SP-9000);磷酸盐缓冲液(phosphate buffer saline,PBS)、柠檬酸抗原修复液与二氨基联苯胺(diaminobenzidine,DAB)显色剂(北京索莱宝生物技术有限公司,P1010、C1010与DA1010);CD8兔多克隆抗体(美国abcam公司,ab4055)与NKG2A兔多克隆抗体(美国abcam公司,ab96319)。光学显微镜(日本尼康公司,E100+ISH500)。
1.3 免疫组织化学法检测组织中浸润的CD8+T淋巴细胞表面抑制性受体NKG2A蛋白的表达
每例患者癌组织及相应癌旁肺组织各取两张石蜡包埋标本连续切片,片厚2 μm;常规溶蜡脱蜡,梯度乙醇水化(体积分数100%、90%、80%与70%);柠檬酸抗原修复15 min;PBS冲洗;过氧化物酶阻断剂封闭20 min;PBS冲洗;山羊血清封闭30 min;于两张连续切片上分别加入CD8+T淋巴细胞抗体与NKG2A抗体(PBS稀释比1∶200)各50 μL,4℃孵育过夜;PBS冲洗;山羊抗鼠/兔聚合物室温下孵育20 min;PBS冲洗;链霉菌抗生物素蛋白-过氧化物酶室温封闭15 min;PBS冲洗;DAB显色10 min;蒸馏水终止显色;苏木精复染10 min;梯度乙醇脱水(体积分数70%、80%、90%与100%);二甲苯透明;封片;使用光学显微镜观察两张连续切片中同一位置CD8+T淋巴细胞与NKG2A蛋白的表达,以两张连续切片同一位置细胞膜出现浅黄色、棕黄色或棕褐色颗粒为阳性表达,随机取5个高倍镜视野(400×)评分均值为最终免疫组织化学评分(评分细则见参考文献[7])。
1.4 统计学方法
采用SPSS 23.0对所得数据进行统计学分析,计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间比较采用LSD-t检验,计数资料采用百分率表示,组间比较采用χ2檢验。各因素对预后的影响采用Cox回归分析;生存曲线绘制采用Kaplan-Meier法;生存时间之间差异分析采用Log-rank检验(生存时间为入院时间至最后一次随访日期或死亡),以P < 0.05为差异有统计学意义。
2 结果
2.1 肺腺癌及癌旁肺组织中CD8+T淋巴细胞表面抑制性受体NKG2A蛋白的表达
肺腺癌及癌旁肺组织中均可见间质淋巴细胞胞膜出现棕黄色颗粒,为浸润的CD8+T淋巴细胞(图1A、C、E、G),在右侧连续切片中可见同一位置淋巴细胞胞膜出现棕黄色颗粒,为CD8+T淋巴细胞NKG2A蛋白表达阳性(图1B、D、F、H)。高、中、低分化肺腺癌组织CD8+T淋巴细胞表面抑制性受体NKG2A蛋白免疫组织化学评分中、低分化评分高分化,且低分化高于中分化(P < 0.05)。见图1(封三)、表1。
2.2 肺腺癌患者CD8+T淋巴细胞表面抑制性受体NKG2A蛋白表达与其临床病理特征相关性
CD8+T淋巴细胞表面抑制性受体NKG2A蛋白高表达与肺腺癌患者的分化程度、淋巴结转移、临床分期及5年生存情况具有相关性(P < 0.05)。见表2。
2.3 肺腺癌患者预后影响因素的Cox回归分析
以生存和死亡作为因变量,NKG2A蛋白表达为自变量(阳性=1,阴性=0),结果显示CD8+T淋巴细胞表面抑制性受体NKG2A蛋白表达阳性为影响肺腺癌患者预后的独立危险因素(β = 0.85,Wald = 7.78,HR = 2.35,95%CI:1.29~4.28,P < 0.05)。
2.4 CD8+T淋巴细胞NKG2A蛋白表达与肺腺癌患者5年生存预后相关性
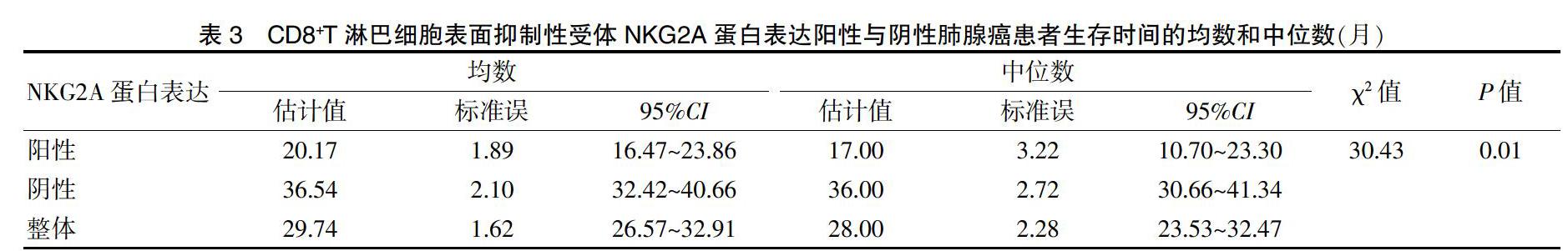
130例肺腺癌患者中CD8+T淋巴细胞NKG2A蛋白表达阳性者的5年生存率及中位生存时间均明显低于表达阴性者,差异有统计学意义(P < 0.05)。见表3、图2~3。
3 讨论
肺腺癌是一种临床上较为常见的恶性肿瘤,虽然目前已有手术、放疗、化疗等治疗手段,但治疗效果仍不理想。因此,寻找与肺腺癌恶性进展密切相关的因素,为治疗提供可能的新靶点意义重大[8]。鲜有关于肿瘤微环境作用的相关报道。肿瘤的发生和转移与肿瘤细胞所处的内外环境密切相关[9-13]。研究表明肿瘤细胞与宿主之间的相互作用是肿瘤生长与存活的起始选择压力,这种相互作用可能参与了肿瘤的发生发展[3,14-16]。同时肿瘤细胞对免疫细胞抑制性受体表达的调节,是肿瘤削弱宿主微环境中免疫细胞杀伤力、诱导免疫耐受甚至功能耗竭,最终导致肿瘤免疫逃逸的重要机制[17-19]。
本研究显示肺腺癌组织中CD8+T淋巴细胞表面抑制性受体NKG2A蛋白表达显著升高,提示肿瘤组织中可聚集大量不具备杀伤能力的CD8+T淋巴细胞,从而增加肿瘤微环境的免疫抑制状态。且NKG2A蛋白表达随分化程度降低而逐渐升高,提示随着肿瘤恶性程度的增加,NKG2A蛋白表达逐渐升高;同时淋巴结有转移患者及临床分期为Ⅲ/Ⅳ期患者的NKG2A蛋白表达显著增高,提示NKG2A蛋白高表达与肺腺癌的恶性进展密切相关。本研究还显示NKG2A蛋白表达阳性者的5年生存率及中位生存时间均显著低于表达阴性者,提示NKG2A蛋白可作为免疫治疗的新靶点,有效抑制其表达可能延长肺腺癌患者的生存期。
综上所述,在肺腺癌中,NKG2A通过负性调控CD8+T淋巴细胞活性,从而增加肿瘤微环境的免疫抑制状态,促进肿瘤的发生发展,抑制NKG2A可能是肺腺癌免疫治疗的潜在靶点之一,在肺腺癌的临床治疗方面具有十分重要的科学理论意义和广泛的应用前景。
[参考文献]
[1] 李媛秋,刘剑君,么鸿雁.肺癌發病和死亡流行情况与人类发展指数的关系分析[J].中国肿瘤,2019,28(9):646-650.
[2] Kichenadasse G,Miners JO,Mangoni AA,et al. Association Between Body Mass Index and Overall Survival With Immune Checkpoint Inhibitor Therapy for Advanced Non-Small Cell Lung Cancer [J]. JAMA Oncol,2019,124:248-261.
[3] Phuengkham H,Ren L,Shin IW,et al. Nanoengineered immune niches for reprogramming the immunosuppressive tumor microenvironment and enhancing cancer immunotherapy [J]. Adv Mater,2019,31(34):1803322.
[4] Liu Z,Han C,Dong C,et al. Hypofractionated EGFR tyrosine kinase inhibitor limits tumor relapse through triggering innate and adaptive immunity [J]. Sci Immunol,2019, 4(38):53-59.
[5] Su S,Zhao J,Xing Y,et al. Immune Checkpoint Inhibition Overcomes ADCP-Induced Immunosuppression by Macrophages [J]. Cell,2018,175(2):442-457.
[6] Yao M,Ventura PB,Jiang Y,et al. Astrocytic trans-Differentiation Completes a Multicellular Paracrine Feedback Loop Required for Medulloblastoma Tumor Growth [J]. Cell,2020,180(3):502-520.
[7] 杨成轩,贾良,孙艳霞,等.共刺激因子B7同源体4在肺腺癌组织中的表达及临床意义[J].新乡医学院学报,2019, 36(9):833-836.
[8] Shi P,Oh YT,Deng L,et al. Overcoming acquired resistance to AZD9291,a third-generation EGFR inhibitor,through modulation of MEK/ERK dependent Bim and Mcl-1 degradation [J]. Clin Cancer Res,2017,23(21):6567-6579.
[9] 潘雅娜,王雪,罗清.肿瘤微环境影响肿瘤多药耐药的研究进展[J].重庆医学,2018,47(4):555-558.
[10] Vivien Béziat,Hervier B,Achour A,et al. Human NKG2A overrides NKG2C effector functions to prevent autoreactivity of NK cells [J]. Blood,2011,117(16):4394-4396.
[11] Fausther-Bovendo,Wauquier N,Cherfils-Vicini J,et al. NKG2C is a major triggering receptor involved in the V[delta]1 T cell-mediatedcytotoxicity against HIV-infected CD4 T cells [J]. AIDS,2008,22(2):217-226.
[12] Gooden M,Lampen M,Jordanova ES,et al. HLA-E expression by gynecological cancers restrains tumor-infiltrating CD8+T lymphocytes [J]. Proc Natl Acad Sci USA,2011,108(26):10656-10661.
[13] Wesch D,Kabelitz D. Differential expression of natural killer receptors on Vdelta1 gammadelta T cells in HIV-1-infected individuals [J]. J Acquir Immune Defic Syndr,2003,33(2):420-425.
[14] Handgretinger R,Schilbach K. The potential role of γδ T cells after allogeneic HCT for leukemia [J]. Blood,2018, 131(10):1063-1072.
[15] Zumwalde NA,Sharma A,Xu X,et al. Adoptively transferred Vγ9Vδ2 T cells show potent antitumor effects in a preclinical B cell lymphomagenesis model [J]. JCI Insight,2017,2(13):11-72.
[16] Qaqish A,Huang D,Chen CY,et al. Mycobacterium tuberculosis Adoptive Transfer of Phosphoantigen-Specific γδ T Cell Subset Attenuates Infection in Nonhuman Primates [J]. J Immunol,2017,198(12):4753-4763.
[17] Qin GM,Ao H,Zhang G,et al. Type 1 responses of human Vγ9Vδ2 T cells to influenza A viruses [J]. J Infect Dis,2011,85 (19):10109-10116.
[18] Tu W,Zheng J,Liu Y,et al. The aminobisphosphonate pa-midronate controls influenza pathogenesis by expanding a gammadelta T cell population in humanized mice [J]. J Exp Med,2011,208(7):1511-1522.
[19] Wang T,Welte T. Role of Natural Killer and Gamma-Delta T cells in West Nile Virus Infection [J]. Viruses,2013,5(9):2298-2310.
(收稿日期:2020-03-09 本文編辑:封 华)

