浮萍叶面细菌群落对砷的氧化及该过程受抗生素的影响
谢婉滢,邹希
(南京农业大学资源与环境科学学院/江苏省固体有机废弃物资源化高技术研究重点实验室/江苏省有机固体废弃物资源化协同创新中心,江苏 南京 210095)
稻田环境中砷(As)的生物地球化学循环与人类健康密切相关。As在环境中的形态决定其毒性及生物有效性[1]。作为As代谢的主要过程,环境中As的氧化还原显著影响植物对As的吸收和累积[1-2]。稻田环境中,水稻根际微生物介导As的氧化和还原[2]。淹水条件下,土壤中的As主要被微生物还原为三价砷(AsⅢ)。AsⅢ被矿物吸附的能力弱,且移动性强,通过水稻硅吸收通道被吸收,导致水稻相对于旱作植物更容易累积As[3]。五价砷(AsⅤ)容易被矿物表面的铁锰化合物吸附,水稻根际微生物将AsⅢ氧化为AsⅤ能够降低水稻对As的吸收[2]。因此,增加水稻环境中AsⅢ的氧化是降低水稻As累积的潜在途径[4]。从水稻环境中分离AsⅢ氧化细菌,可以作为水稻环境As污染的潜在修复手段[5]。
浮萍是水稻环境中常见的浮水植物,其叶面好氧与厌氧结合的微环境中生存着丰富多样的细菌群落[6]。浮萍叶面的As代谢细菌由AsⅢ氧化菌主导[7]。然而,从浮萍或者其他水生植物叶面分离AsⅢ氧化细菌的研究报道较少。同时,由于抗生素在医疗和养殖业中的广泛使用,环境中的抗生素污染日趋严重,这其中也包括水稻田环境[8-9]。在抗生素污染的条件下,浮萍叶面细菌群落及可培养菌株对AsⅢ的氧化是否会有变化,这种变化对浮萍吸收和累积As影响如何还未见报道。因此,本研究主要测定浮萍叶面细菌群落对AsⅢ的氧化能力和对浮萍吸收累积As的作用,以及抗生素对该AsⅢ氧化过程、浮萍吸收累积As的能力和可培养AsⅢ氧化菌株的影响,探讨As和抗生素复合污染条件下As生物地球化学循环的变化。
1 材料与方法
1.1 试验材料与处理
浮萍(Wolffiaaustraliana)由苏黎世联邦理工学院的Prof. Dr. Elias Landolt提供。有菌浮萍在温室中培养于水稻土(采集于湖南常德)中,液面保持5~10 cm。根据浮萍的生长情况,不定期向土壤中施加240 mg·kg-1CO(NH2)2和240 mg·kg-1K2HPO3·3H2O。无菌浮萍的获取和维持方法为:纯净水洗净在温室中培养的浮萍,于10 g·L-1NaClO中浸泡3 min,用无菌水彻底冲洗;将单个叶片转移至含10 g·L-1蔗糖的固体 Hoagland 培养基中。待浮萍成活后,选取培养基上不含细菌菌落的浮萍用于传代培养。传代培养基为含10 g·L-1蔗糖的Hoagland溶液。传代浮萍于光照培养箱中培养,每月更换培养基。为检查浮萍的无菌条件,定期采集培养液涂布于LB培养基观察是否有菌落生长。舍弃有菌落的传代培养或者将传代浮萍再按照以上的方法进行除菌,直到获得不含细菌的浮萍。
Hoagland营养液(pH6):10 mmol·L-1KNO3,1 mmol·L-1KH2PO4,2 mmol·L-1MgSO4,2 mmol·L-1Ca(NO3)2,48.5 μmol·L-1H3BO3,20 μmol·L-1FeSO4-EDTA,10 μmol·L-1MnCl2,0.7 μmol·L-1ZnSO4,0.35 μmol·L-1CuSO4,0.1 μmol·L-1Na2MoO4。细菌筛选培养基(pH7):0.25 g·L-1NH4Cl,0.5 g·L-1KCl,0.1 g·L-1CaCl2,0.4 g·L-1MgCl2·6H2O,0.5 g·L-1NaCl,0.6 g·L-1NaH2PO4。培养基高温灭菌冷却至50 ℃左右加入10 mL·L-1矿质元素母液和10 mL·L-1维生素母液[10]。
试验处理设置为:无菌浮萍、有菌浮萍、有菌浮萍+抗生素(50 mg·L-1氯霉素[11])处理及不加浮萍的培养液对照。每个处理4个重复。
1.2 试验方法与测定
1.2.1 浮萍叶面菌群对As的转化能力测定于100 mL锥形瓶中加入50 mL培养液,用无菌塑料封膜封住瓶口,于121 ℃灭菌30 min。分别向灭菌后的培养液中加入2.5 g无菌浮萍、有菌浮萍和有菌浮萍+抗生素,以不加浮萍的培养液为空白对照。将锥形瓶于光照培养箱中培养24 h后加入0.1 mL 50 mg·L-1无菌AsⅢ溶液(0.22 μm无菌过滤),使培养液中AsⅢ的最终质量浓度为110 μg·L-1。加入AsⅢ后,于0、10、24、72和168 h分别取1 mL溶液,用于测定As的形态和总量。于168 h收集溶液,一部分用于测定As的形态和总量,一部分用于筛选浮萍叶面可培养细菌。光照培养条件为:相对湿度60%,光照强度 50 μmol·m-2·s-1,昼/夜时间14 h/10 h,昼/夜温度30 ℃/25 ℃。
1.2.2 浮萍培养液和叶面可培养细菌的筛选和鉴定将浮萍叶面细菌用0.02%(体积分数)Tween-20洗脱[6],将洗脱液和浮萍培养液按10倍梯度稀释,涂布于培养基上,于光照培养箱中培养3~7 d,挑选形态不同的菌落,于固体培养基划线纯化。纯化后的菌落通过菌落PCR用于细菌鉴定。PCR引物为27F和1492R。PCR体系:12.5 μL Dream Taq Green PCR Master Mix(2×)(Thermo Scientific),前、后引物各1 μL,无菌水10.5 μL,无菌牙签蘸取适量菌落。PCR条件:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 40 s,35个循环;72 ℃ 10 min。PCR产物测序由上海美吉生物医药有限公司完成。
1.2.3 浮萍培养液和叶面可培养细菌对As的转化能力测定将从浮萍培养液和叶面筛选到的菌株在含100 μg·L-1AsⅢ的液体培养基中培养至D600值为0.8,转接50 μL菌液于含100 μg·L-1AsⅢ的5 mL液体培养基中,于30 ℃、200 r·min-1避光培养50 h。以不加菌液的含AsⅢ培养液为空白对照(CK),测定培养液中的As形态和浓度。
1.2.4 As形态的测定浮萍中As形态测定:称取0.5 g新鲜浮萍于50 mL特氟龙的微波消煮管中,加入10 mL 1%(体积分数)硝酸(优级纯,Merck,德国),静置过夜后,微波消煮仪中消煮。消煮程序为:55 ℃ 10 min,75 ℃ 10 min,95 ℃ 30 min,每个阶段温度上升时间为5 min。消解液冷却、过滤(0.22 μm滤头)后用高效液相色谱-电感耦合等离子体-质谱联用(HPLC-ICP-MS,PerkinElmer NexIon 300x)测定As形态。样品中As形态通过与混标中As标准形态的出峰时间对比获得。As标准形态包括:三价砷(AsⅢ)、五价二甲基砷(DMAⅤ)、五价单甲基砷(MMAⅤ)和五价砷(AsⅤ)。4种As形态的浓度采用峰面积外标法计算,以已知浓度DMAⅤ的峰面积为标准。空白试剂和标准物质(大米,GBW10010,国家标准物质研究中心)各3个重复。大米中As的回收率为(95.8±2.0)%。溶液样品过滤(0.22 μm滤头)后,采用上述相同的方法测定溶液中As的形态和浓度。
1.2.5 As总浓度的测定浮萍中As总浓度测定:称取0.2 g新鲜浮萍于50 mL特氟龙的微波消煮管中,加入2.0 mL 65%硝酸,静置过夜,加入1 mL 30% H2O2。微波消煮程序同1.2.4节。消解液冷却后用超纯水稀释到50 mL,过0.45 μm过滤器。采用电感耦合等离子体质谱测定滤液中As总浓度。试剂空白和标准物质(灌木枝叶,GBW07603,国家标准物质研究中心)各3个重复。标准物质总As回收率为(97.5±4.6)%。溶液样品中各种As形态浓度的总和作为As总浓度。
1.3 数据统计与分析
试验数据采用Sigmaplot 12和Adobe Illustrator CS5软件绘图和处理。用Excel 2010计算平均值和标准差(SE,n=4)。用SPSS 18.0中One-way ANOVA或者t测验对数据进行显著性差异分析(P<0.05)。
2 结果与分析
2.1 不同处理溶液中AsⅢ的转化
从图1可知:浮萍培养液中只检测到AsⅢ和AsⅤ,有机As形态未检出。在加浮萍的3种处理中,AsⅢ质量浓度随时间不断降低,降低的速率从大到小的处理依次为有菌浮萍、有菌浮萍+抗生素、无菌浮萍处理。有菌浮萍处理中AsⅢ质量浓度在10 h时降低为初始浓度的2.6%,之后一直保持低浓度(小于0.5 μg·L-1)。溶液中AsⅤ质量浓度随时间不断增加,增加速率从大到小的处理依次为有菌浮萍、有菌浮萍+抗生素、无菌浮萍处理。对照处理中AsⅢ和AsⅤ的质量浓度变化较小,但也有小部分AsⅢ被氧化为AsⅤ,AsⅤ质量浓度在168 h时为7.2 μg·L-1。无菌浮萍处理溶液中AsⅤ质量浓度在10 h时仅为3.3 μg·L-1,略低于空白对照(5.0 μg·L-1);但168 h后溶液中AsⅤ质量浓度达22 μg·L-1,显著高于空白对照。有菌浮萍处理中,10 h时溶液中 AsⅤ 质量浓度急剧增加到96 μg·L-1(占As总质量浓度的比例为97.1%),168 h后,溶液中AsⅤ质量浓度降低到75 μg·L-1(占As总质量浓度的比例为99.5%)。添加抗生素的有菌浮萍处理中,AsⅤ质量浓度的增加速率相比有菌浮萍处理急剧降低,72和168 h时溶液中AsⅤ质量浓度分别为49和54 μg·L-1(分别占As总质量浓度的70.2%和72.9%)。有菌浮萍和添加抗生素的有菌浮萍处理中,AsⅤ质量浓度超过AsⅢ质量浓度的取样时间分别为10和72 h,而在整个培养过程中,无菌浮萍体系中AsⅢ的质量浓度始终高于AsⅤ质量浓度。
2.2 不同处理中浮萍对As的吸收与累积
添加浮萍的溶液中As总质量浓度随处理时间延长不断降低,72 h时,溶液中As总质量浓度达到平衡(图2)。无菌浮萍溶液中As总质量浓度的降低速度最快,在72 h时已降低至初始值的50%。有菌浮萍处理溶液中As总质量浓度降低速度比无菌浮萍慢,而添加抗生素可在一定程度上提高As总质量浓度的降低速度。根据As在培养体系中的质量守恒,无菌浮萍和有菌浮萍+抗生素处理溶液中减少的As主要被浮萍吸收,分别为2.83和2.04 μg(表1)。此外,与空白对照(0.48 μg)类似,无菌浮萍和有菌浮萍+抗生素处理溶液中还有一小部分As被溶液中的沉淀吸附,分别为0.55和0.39 μg(表1)。无菌浮萍以及添加抗生素的有菌浮萍中As的总含量和总量显著高于有菌浮萍(P<0.05),总含量分别为后者的3.4和2.9倍(图3,表1)。根据有菌浮萍初始体系与168 h体系间As差量(1.65 μg)可判断,有菌浮萍处理中,除了浮萍吸收和沉淀吸附的As以外,还有部分As可能被体系中的微生物吸收或者吸附(表1)。无菌浮萍和有菌浮萍+抗生素处理的浮萍中As形态主要为AsⅢ(分别占As总含量的96.8%和94.0%),而AsⅤ所占比例小(分别只占As总含量的3.2%和6.0%)(图4)。有菌浮萍中AsⅤ的比例显著增加(P<0.05),占As总含量的49.7%(图4)。
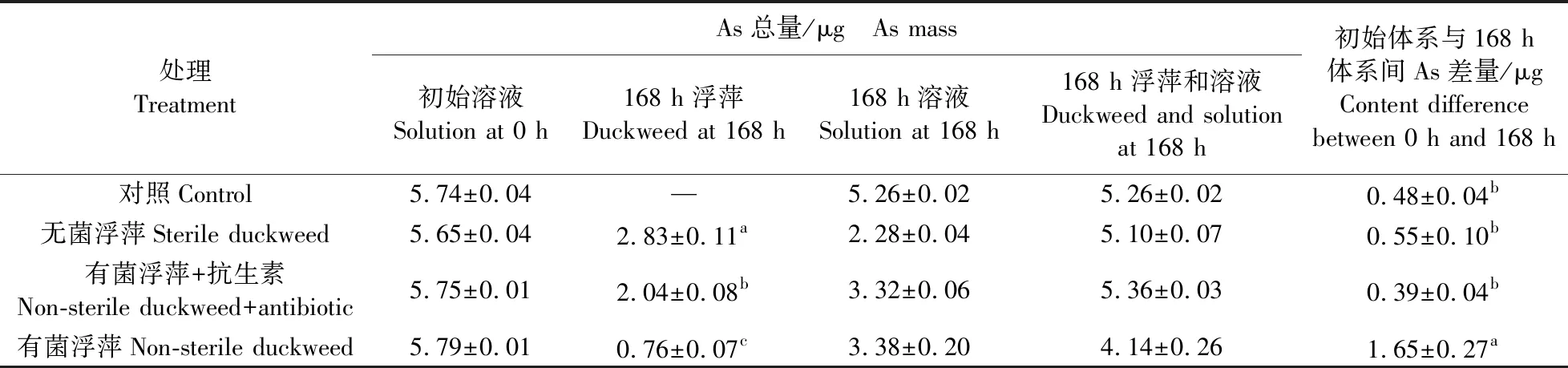
表1 浮萍培养体系中As的质量平衡Table 1 Mass balance of As in the duckweed incubation systems
2.3 不同处理中可培养细菌对As的转化
空白对照和无菌浮萍体系中没有分离到可培养细菌。有菌浮萍和添加抗生素的有菌浮萍培养体系中总共分离到38株细菌。从图5可知:培养50 h后,空白对照中的AsⅢ有小部分被氧化为AsⅤ。相对于空白对照,有25株可培养细菌表现出对AsⅤ的还原能力,只有7株菌株表现出微弱的AsⅢ氧化能力。D2、D3、D6、D8、D10、D12和D13都从有菌浮萍叶面上分离得到,对AsⅢ具有氧化能力。然而,这些细菌对AsⅢ氧化能力较弱,菌株培养液中AsⅤ的浓度都没有超过空白对照的2倍。有菌浮萍的培养液中,以及添加抗生素的浮萍培养处理(包括叶面和溶液)中分离到的细菌都没有表现出对AsⅢ的氧化能力。
其中D2、D8、D12和D13属于α-变形菌,其16S rRNA基因与Asticcacaulissp.(GU199450.1)、Sphingomonassp.(AM900786.1)、Novosphingobiumsp.(MH392629.1)和Porphyrobactersp.(AB033326.1)的同源性分别为99.8%、97.7%、98.8%和99.3%;D3和D10属于β-变形菌,其16S rRNA基因与Kinneretiasp.(KU360713.1)和Hydrogenophagasp.(MK751587.1)的同源性分别为99.0%和99.2%;D6属于γ-变形菌,其16S rRNA基因与Pseudomonassp.(MG674651.1)的同源性为99.7%。
3 讨论
水生植物叶面生存着具有较高多样性的细菌群落,这些细菌群落在生物地球化学循环中有着不可忽略的作用[6]。本研究结果表明,浮萍叶面细菌群落导致有菌浮萍体系中AsⅢ的氧化,这主要体现在3个方面:1)有菌浮萍处理相对于无菌浮萍处理对AsⅢ的快速氧化;2)抗生素对该氧化过程的显著抑制;3)AsⅢ氧化菌株全部分离于有菌浮萍叶面。在空白对照中,AsⅢ转化为AsⅤ的速率非常慢,为AsⅢ的化学氧化[12]。当加入无菌浮萍后,体系对AsⅢ氧化速率增强。高等植物对As的转化主要表现为还原,因此无菌浮萍体系对AsⅢ的氧化可能主要由于浮萍的代谢(例如光合作用释放氧气)在一定程度上促进 AsⅢ的化学氧化。含有浮萍的3个处理中,被氧化的AsⅤ不断在溶液中累积。这主要是由于植物主要通过磷吸收蛋白吸收AsⅤ[13],而培养液中高浓度的磷(1.0 mmol·L-1)抑制浮萍对AsⅤ的吸收。在大田环境中,由于磷肥的广泛使用,水生植物吸收AsⅤ受到高浓度磷的抑制,这就使表层水体中的AsⅢ不断被浮水植物叶面细菌群落氧化为AsⅤ,并以AsⅤ的形态进行累积。同时,由于AsⅤ相对于AsⅢ更容易被矿物质吸附,叶面细菌群落驱动的AsⅢ氧化有利于降低水环境中As的生物有效性[1]。
由于不同培养体系中As形态动态变化的差异,浮萍对As的总累积量和形态在不同处理间也表现出显著差异。无菌浮萍培养体系中AsⅢ为主要形态,植物对AsⅢ的吸收主要受Si通道蛋白控制[13]。超纯水配制的培养液中Si浓度低,对浮萍吸收AsⅢ的抑制作用小,因而无菌浮萍对AsⅢ的总吸收速率快,对As的累积浓度高。有菌浮萍体系中,叶面细菌快速将AsⅢ氧化为AsⅤ,受溶液中高浓度磷的抑制,AsⅤ进入浮萍的速率慢,导致As在浮萍中的累积浓度低。本研究中,有菌浮萍体系中微生物群落累积了非常高比例的As。这些结果表明叶面细菌群落的存在对浮萍累积As具有非常好的阻控作用。同时,由于叶面细菌的快速氧化,有菌浮萍培养溶液中AsⅢ长时间处于低浓度状态。这增加浮萍与溶液中AsⅢ的浓度梯度,导致有菌浮萍中的AsⅢ更容易外排。有菌浮萍相对于无菌浮萍含有更低比例的AsⅢ,说明水生植物叶面细菌群落对水生植物中As的形态有显著的影响。
添加抗生素抑制浮萍叶面细菌对AsⅢ的氧化,增加溶液中AsⅢ的比例,并减少浮萍叶面微生物对As的累积,这导致浮萍对AsⅢ的吸收增加,从而使浮萍中AsⅢ的比例和As累积总量也增加。本研究中采用的氯霉素能够抑制细菌蛋白合成[14],因此有效抑制浮萍叶面细菌群落对AsⅢ的氧化。氯霉素的添加也能够抑制沉积物中微生物群落对AsⅢ的氧化,但对AsⅤ的还原影响不显著[10]。这说明环境中 AsⅢ的氧化更容易受抗生素污染的影响。近年来,由于抗生素在人类医疗和动物养殖中的大量使用,水体受抗生素污染的现象普遍[15-16]。抗生素在水体中的污染除了可能增加环境中的抗生素抗性基因外[16],在污染程度严重的情况下可能也存在增加水生植物对As的总累积量和改变水生植物中As形态比例的风险。这对水生生态系统中As的生物地球化学循环产生不可忽视的影响,值得进一步研究。
可培养的AsⅢ氧化细菌主要位于浮萍叶面,但这些细菌在单独培养条件下对AsⅢ的氧化能力并不强。Zhang等[5]从被As污染的水稻土中分离到1株AsⅢ氧化菌株SY(Paracoccussp.),其能够在24 h内将 1 mmol·L-1AsⅢ完全氧化为AsⅤ。从浮萍叶面可培养细菌对AsⅢ较弱的氧化能力以及浮萍叶面细菌群落对AsⅢ的快速氧化推测,浮萍叶面可能存在不可培养的对AsⅢ氧化能力更强的细菌,同时浮萍叶面细菌群落对AsⅢ的氧化能力也可能由多种细菌协作完成。与浮萍培养试验的结果类似,氯霉素可显著减少具备As氧化能力的可培养的叶面细菌,这也证明AsⅢ氧化细菌对氯霉素的敏感性。从浮萍叶面分离到的AsⅢ氧化细菌均属于变形菌。通过对以往的研究调查发现,从不同生境中分离获得纯培养的大部分AsⅢ氧化细菌也属于变形菌[5,12]。Xie等[6]研究结果表明,浮萍叶面细菌群落中变形菌的比例达97%以上。结合本研究中浮萍叶面细菌群落对AsⅢ的快速氧化能力,稻田环境中浮萍或者其他浮水植物的叶面可能是获取AsⅢ氧化菌株的理想生境,值得进一步探索。

