英诺克李斯特菌侵染果蝇S2细胞后的转录组分析
吴坤钟,李荣松,曹 阳,黄志君,田 铃
(华南农业大学 动物科学学院/广东省农业动物功能基因组学与分子育种重点实验室/广东省蚕桑工程技术研究中心,广东 广州 510642)
李斯特菌属Listeria是革兰阳性菌,隶属厚壁菌门Firmicutes芽孢杆菌纲Bacilli芽孢杆菌目Bacillales,该属包括17个种。狭义上的李斯特菌属包括6个种,即单增李斯特菌L.monocytogenes、绵羊李斯特菌L.ivanovii、威尔斯李斯特菌L.welshimeri、默氏李斯特菌L.murrayi、西尔李斯特菌L.seeligeri和英诺克李斯特菌L.innocua,公认的致病菌只有2种,即单增李斯特菌和绵羊李斯特菌[1-2]。其中单增李斯特菌致病性最强,可导致人与动物患李斯特菌病[3]。绵羊李斯特菌又称伊氏李斯特菌,仅能引起动物李斯特菌病[4],但也有引起人患李斯特菌病的个别案例[2]。此外,非常罕见英诺克李斯特菌和西尔李斯特菌引起人李斯特病的报道,且二者不具有溶血活性,因此它们一般被认为是非致病菌。其中,英诺克李斯特菌常伴随单增李斯特菌出现,并被视为后者的指示菌[5]。李斯特菌属成员的中间宿主范围较广,常常生存于蔬菜、乳类和肉类制品中;适应性强,在2~42 ℃均能正常生长[6-7]。李斯特菌病的潜伏期一般小于24 h[8],临床表现为脑膜炎、菌血症、眼内炎、颈淋巴结炎、胆囊炎、骨髓炎及关节炎等,易感人群为老人、孕妇、新生儿和免疫缺陷患者[9]。在动物中,由绵羊李斯特菌引起的李斯特菌病可表现为流产、败血症等,但不引起脑膜炎[10]。鉴于李斯特菌有危害性大、宿主谱广和适应性强的特点,很多国家都已经采取相关措施防控食品中李斯特菌的污染,一些发达国家如美国等已将李斯特菌病定为法定传染病,但目前我国仅在部分省市对李斯特菌病开展相关检测工作[11]。
目前对李斯特菌的研究多集中在单增李斯特菌上,对其他李斯特菌的研究较少。已知的单增李斯特菌毒力因子主要有溶血素基因hly编码的李斯特溶血素 O(Listerriolysin O,LLO)、plcA编码的磷脂酰肌醇特异性磷脂酶C(Phospholipase C,PIPLC)、plcB基因编码的磷脂酰胆碱磷脂酶(Phosphatidylcholine-specific phospholipase C,PCPLC)、SmcL基因编码的神经磷脂酶C(Nerve phoshpolipase C,NPI-PLC)、肌动蛋白 A (Actin A,Act A)、内化素 (Internalins,Inl)和细胞壁水解酶(p60)[12]。其中LLO是重要的毒力因子,相对分子质量为60 000,是一种孔成形毒素,与细胞膜表面分子结合后可以直接插入细胞膜上,是李斯特菌逃逸初级吞噬和双层膜吞噬体所必须的毒力因子[13-14]。此外,LLO还可以调节巨噬细胞的细胞因子表达,从而诱导树突细胞凋亡。当李斯特菌借助细胞内吞侵入宿主细胞后被包裹在吞噬体中,随后李斯特菌分泌LLO和PI-PLC裂解吞噬体膜,从而逃逸进入宿主细胞浆中[15]。但此时,李斯特菌仍存在被宿主细胞自噬所清除的危险,而Act A在李斯特菌从宿主胞质中逃逸的过程中发挥着重要的作用[16]。Act A是一种表面蛋白,当李斯特菌逃出吞噬体进入细胞浆中时,Act A可以模仿Wiskott-Aldrich综合征蛋白 (Wiskott-Aldrich syndrome protein,WASP)机制,调用宿主细胞自身的肌动蛋白,这些肌动蛋白在李斯特菌一端形成1条彗星状的尾巴,赋予李斯特菌在胞质中运动的能力,并向邻近的细胞迁移,实现细胞间侵染[17]。Act A还可以与宿主细胞中的Ena/VASP和Arp2/3复合体相结合,以此逃避宿主细胞的自噬识别系统[18]。
研究表明,英诺克李斯特菌与单增李斯特菌的关系密切,两者可能具有共同的毒力祖先,在进化过程中英诺克李斯特菌丢失了编码主要毒力因子的基因[19]。英诺克李斯特菌在基因组上与单增李斯特菌非常相似,例如两者都有300多个编码运输蛋白的基因,包括80多个碳转运蛋白,两者都含有糖酵解所必需的酶[20]。典型的英诺克李斯特菌已在进化过程中缺失了LIPI-1毒力岛,但Johnson等[21]和Moura等[22]研究发现某些天然非典型英诺克李斯特菌株却含有完整的LIPI-1毒力岛,这类菌株具有溶血活性,可以主动穿过肠上皮,传播到肝脏和脾脏,但危害程度远低于单增李斯特菌。由于英诺克李斯特菌与单增李斯特菌的亲缘关系最为接近,所以在一些食品的研究中,英诺克李斯特菌常常作为单增李斯特菌的替代菌种[23]。例如,Sorrentino等[24]发现在低pH条件下3−苯基乳酸可以抑制英诺克李斯特菌的生长。另外Tremonte等[25]发现,英诺克李斯特菌在面对酸胁迫时会显著上调普遍胁迫蛋白(Universal stress protein,USP)基因的表达,表明在抵御酸胁迫时USP基因发挥着至关重要的作用。
目前,李斯特菌引起的相关并发症尚无特效药,也鲜有其侵染后寄主基因组水平的详细反应情况的研究报道。由于典型的英诺克李斯特菌被认为是非致病菌[26],人们对宿主与其互作的机制关注较少。鉴于英诺克李斯特菌与单增李斯特菌的亲缘关系最近,我们如果能够深入挖掘其侵染后宿主基因表达的变化情况,将为宿主调控、防御单增李斯特菌的危害提供对比与参考。利用英诺克李斯特菌可以侵染果蝇Drosophila melanogasterS2细胞的特性,我们在英诺克李斯特菌侵染果蝇S2细胞3 h后,对果蝇S2细胞进行了转录组测序。
1 材料与方法
1.1 细胞与菌株的培养
英诺克李斯特菌(ATCC,33090,由上海海洋大学提供)用李斯特菌培养基(HB4160,海博生物技术有限公司)活化和培养。果蝇S2细胞(由中国科学院上海植物生理生态研究所提供)在含有体积分数为5%胎牛血清(FBS500-S,AusGeneX,澳大利亚)的 Insect SIM SF 培养基 (MSF1-1,信和生物公司)中培养。
1.2 英诺克李斯特菌侵染果蝇S2细胞
果蝇S2细胞铺板培养18 h后,用50 nmol/L水溶性胆固醇 (134428,BIOBERRY)孵育 30 min。
试验组处理:胆固醇孵育30 min后加入英诺克李斯特菌悬浮液(约20个细菌)在28 ℃条件下孵育1.5 h。然后用pH 7.4的PBS缓冲液洗涤果蝇S2 细胞,在含 100 μmol/L CuSO4和 10 μg/mL 庆大霉素的Insect SIM SF培养基基中继续培养果蝇S2细胞3 h。对照组处理:不加英诺克李斯特菌悬浮液,其他操作同试验组。培养结束后,收集试验组和对照组果蝇S2细胞进行后续试验。
1.3 RNA的抽提及转录组测序
用 TRIzol试剂 (9108-1,Takara,日本)抽提感染英诺克李斯特菌后的果蝇S2细胞中的总RNA。使用 2100 Bioanalyze(Agilent Technologies,美国)定量总RNA模板。通过凝胶电泳确定每个样品中总RNA的完整性。根据浓度和质量值,分别选取试验组与对照组3个最好的RNA样品用于文库制备和Illumina Novaseq 6000测序。原始配对的末端读数修整后由SeqPrep(https://github.com/jstjohn/SeqPrep)和Sickle(https://github.com/najoshi/sickle)使用默认参数进行质量控制。然后使用TopHat软件 (http://tophat.cbcb.umd.edu/,版本2.1.1)以定向模式将原始的读数与参考基因组比对。根据每百万条映射片段中每千个碱基的转录本所包含的片段 (Fragments per kilobase of transcript per million fragments mapped,FPKM)计算每个转录本的表达水平。使用RSEM软件(http://deweylab.biostat.wisc.edu/rsem/)定量基因丰度。R统计软件包EdgeR(http://www.bioconductor.org/packages/2.12/bioc/html/edgeR.html)用于基因差异表达分析。此外,使用Goatools(https://github.com/tanghaibao/Goatools)和 KOBAS 2.1.1 (http://kobas.cbi.pku.edu.cn/download.php)进行GO和KEGG分析。对照组和试验组样品均设置3个生物学重复。
1.4 实时定量PCR检测
对差异基因进行qPCR验证:用TRIzol试剂分别提取对照组与试验组果蝇S2细胞的总RNA,使用 PrimeScriptTM RT 试剂盒 (RR047A,Takara,日本)反转录生成cDNA,进行qPCR检测。以果蝇的rp49基因作为内参基因。对照组和试验组样品均设置3个生物学重复。
利用qPCR对英诺克李斯特菌的增殖情况进行检测:英诺克李斯特菌侵染果蝇S2细胞3 h后,收集果蝇S2细胞,用基因组提取试剂盒(D3129-01,Magen)提取总基因组,以此为模板,以果蝇rp49基因作为内参基因,用英诺克李斯特菌的凋亡抑制蛋白 (Inhibitor of apoptosis protein,IAP)基因特异性引物进行qPCR检测英诺克李斯特菌的增殖情况[27]。
1.5 数据分析
采用 Microsoft Office Excel2010 软件绘图。试验组和对照组的差异显著性通过t检验进行统计分析。
按以下公式计算每个基因的差异表达倍数:

2 结果与分析
2.1 英诺克李斯特菌在果蝇S2细胞内的增殖情况
利用qPCR对英诺克李斯特菌的增殖情况进行检测,结果表明,英诺克李斯特菌的IAP基因拷贝数剧烈上升,果蝇S2细胞中侵染了大量的英诺克李斯特菌(图1)。因此,我们在英诺克李斯特菌侵染果蝇S2细胞3 h后收集果蝇S2细胞提取总RNA用于转录组测序以及后续的qPCR验证。
2.2 果蝇S2细胞转录组测序数据质控与评估
对照组和试验组分别平均产生了59 125 670和 60 779 885 条原始数据,错误率均在 0.025 6% 以下(表1)。果蝇S2细胞被英诺克李斯特菌侵染前基因组的GC质量分数在50%左右,被侵染3 h后基因组GC质量分数变化不大(表1)。对照组和试验组的3次生物学重复之间的相关性系数均在0.994 9以上,表明各组之间重复性良好,可进行下一步分析。

图1 英诺克李斯特菌侵染果蝇S2细胞3 h后英诺克李斯特菌增殖情况Fig.1 Proliferation ofListeria innocua after its infection in Drosophila S2 cells for three hours

表1 果蝇S2细胞转录组测序数据统计表Table 1 Statistics of transcriptome sequencing data forDrosophila S2 cells
2.3 果蝇S2细胞基因表达差异
英诺克李斯特菌侵染宿主果蝇S2细胞3 h后,韦恩分析表明对照组与试验组共同表达的基因有7 808个,仅在试验组表达的基因有98个,仅在对照组表达的基因有187个。
与对照组相比,试验组共有54个基因呈现显著性差异(上/下调倍数≥2),其中21个基因上调,33个基因下调,变化幅度最大的是DmCR46081,上调了232倍,其次是DmDef(DmDefensin)、DmDro(DmDrosomycin)、DmDpt A(DmDptericin A)和DmDpt B(DmDptericin B)等抗菌肽基因。DmCR46081基因编码rRNA前体加工蛋白,提示果蝇S2细胞被英诺克李斯特菌侵染后某些基因的转录和翻译水平大幅度提升(表2)。
2.4 果蝇S2细胞差异表达基因的功能注释分析
GO注释分析显示,21个上调的基因共涉及10个GO条目,可分为生物进程、细胞组分和分子功能3大类,其中富集基因数目最多的GO条目分别是胞外区(9个)、应激反应(5个)、代谢进程(4个)、免疫系统进程(4个)、多细胞生物进程(3个)、催化活性 (3个)、结合 (3个)、细胞进程(1个)、细胞成分组织或生物合成(1个)、胞外区组件 (1 个)(表 3)。
下调的33个基因共涉及22个GO条目,其中富集基因数最多的GO条目分别是催化活性(11个)、代谢进程(10个)、细胞膜(10个)、单组织进程(8个)、细胞膜组件(8个)、结合(8个)、细胞进程(7 个)、定位 (6 个)、细胞 (6 个)、细胞组件 (6 个)、细胞器(4个)、细胞器组件(3个)、大分子复合物(3个)、转录活性(3个)、排毒(1个)、生物进程调控(1个)、多细胞组织进程(1个)、生物调控(1个)、应激反应(1个)、胞外区(1个)、抗氧化活性(1个)、电子转运活性(1个)(表4)。
结果显示,上调基因多集中在胞外区,下调基因多集中在代谢进程、细胞膜和催化活性,说明被英诺克李斯特菌侵染后果蝇S2细胞的某些代谢反应下降。

表3 英诺克李斯特菌侵染后果蝇S2细胞上调基因GO注释Table 3 GO annotation of upregulated genes inDrosophila S2 cells afterListeriainnocua infection
2.5 果蝇S2细胞差异表达基因的富集分析
2.5.1 上调基因 KEGG 富集 KEGG 富集分析表明,显著上调的21个基因只注释到1个KEGG 通路,即Toll/Imd通路(P<0.001),包括4个果蝇抗菌肽基因DmDpt A、DmDef、DmCec A2(Cecropin A2)和DmCec B(Cecropin B)。
2.5.2 下调基因 KEGG 富集 KEGG 富集分析结果(表5)表明,下调的33个基因注释到23个KEGG 通路。
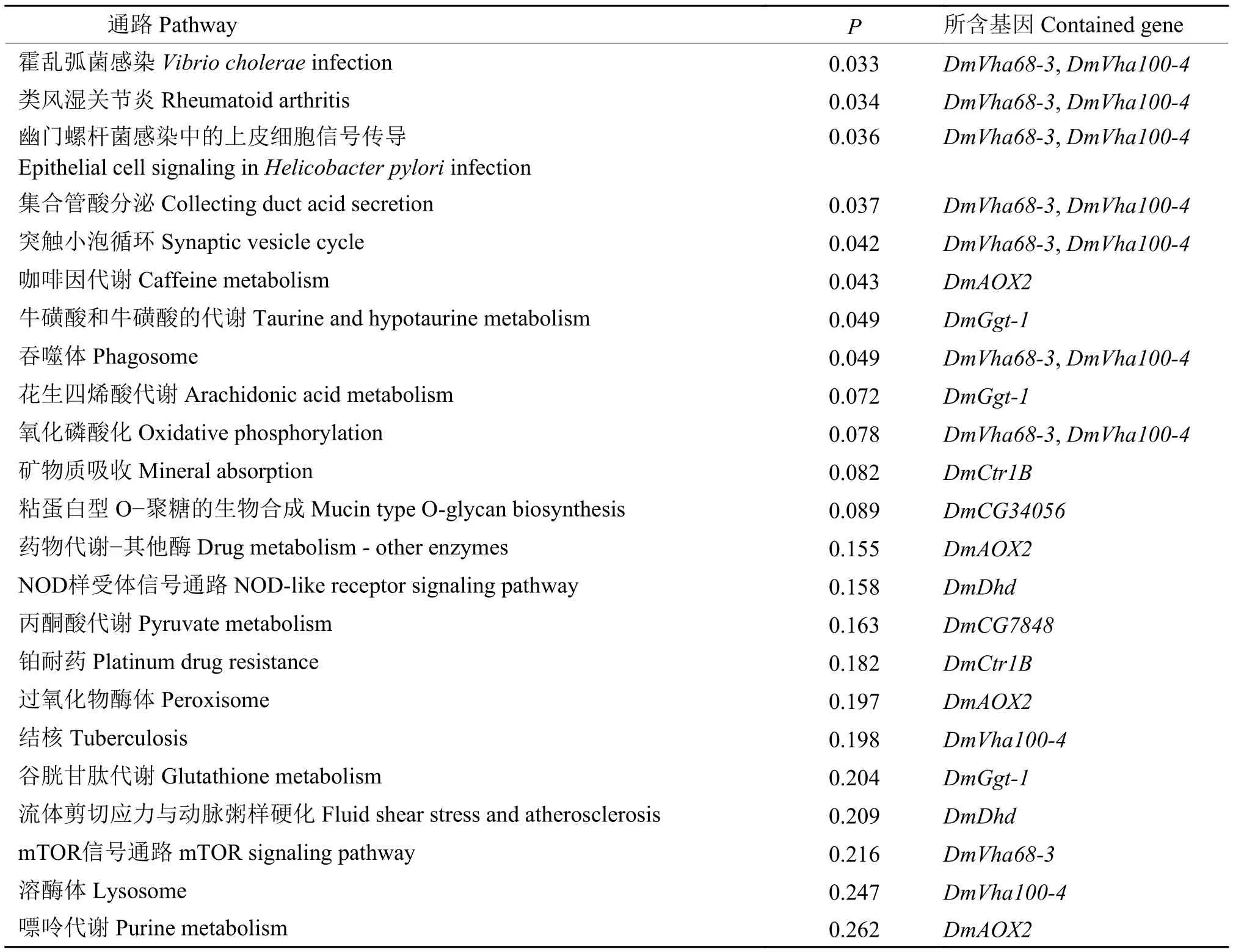
表5 英诺克李斯特菌侵染后果蝇S2细胞下调基因KEGG富集表Table 5 KEGG enrichment of downregulated genes inDrosophila S2 cells afterListeriainnocua infection
2.6 免疫相关通路中的基因分析
英诺克李斯特菌侵染果蝇S2细胞后的转录组测序数据经GO注释和KEGG富集分析显示,显著上调的基因主要与免疫相关。从24个KEGG通路中筛选出10个与免疫相关的KEGG 通路,分别是Toll/Imd通路、类风湿关节炎、吞噬体、霍乱弧菌感染、幽门螺杆菌感染中的上皮细胞信号传导、NOD样受体信号通路、铂耐药、结核、流体剪切应力与动脉粥样硬化、mTOR信号通路,共涉及到8个基因,其中上调幅度最大的是DmDef,上调了9.805倍,下调幅度最大的是DmDhd,下调了4.329倍。
2.7 果蝇S2细胞转录组中抗菌肽的qPCR验证
英诺克李斯特菌侵染果蝇S2细胞后,变化最为显著的基因类群为抗菌肽。转录组分析显示,英诺克李斯特菌侵染果蝇S2细胞3 h后共10个抗菌肽基因显著上调,包括DmDef、DmDro、DmDpt A、DmDpt B、DmCec A2、DmCec B、DmMtk(DmMetchnikowin)、DmAtt D(DmAttacin D)、DmAtt A(DmAttacin A)、DmAtt B(DmAttacin B),其中上调幅度最大的是DmDef(表2)。
我们选取9个抗菌肽基因,利用qPCR进行了验证,其中上调幅度最大的是DmMtk,上调8.180 倍,DmAtt A上调 7.533 倍,DmDro上调7.204 倍,DmDef上调 4.569 倍 (图 2),与转录组测序结果的趋势基本一致,说明英诺克李斯特菌侵染果蝇S2细胞后,抗菌肽基因受到显著的诱导表达。

图2 免疫相关基因表达的qPCR验证结果Fig.2 qPCR verification results for expression of immune related genes
3 讨论与结论
已知的果蝇免疫信号通路有3条,分别是Toll通路、Imd通路和JAK/STAT通路。果蝇虽然没有获得性免疫,但是依然能对不同病原菌的入侵做出不同的先天免疫反应,革兰阳性菌和真菌所引起的免疫反应主要由Toll通路介导,而革兰阴性菌和细胞壁含DAP型肽聚糖的阳性菌引起的免疫反应主要由Imd通路介导[28-29]。Toll通路或Imd通路被激活后可诱导下游抗菌肽的表达[30]。已知的果蝇抗菌肽主要有7种,分别是Attacin、Diptericin、Drosocin、Defensin、Cecropin、Metchnikowin 和Drosomycin。抗菌肽的表达由Toll和Imd通路调控,若Toll通路和Imd通路缺失,将不能诱导抗菌肽的表达[31-33]。
英诺克李斯特菌属于革兰阳性菌,其细胞壁肽聚糖成分主要为DAP型肽聚糖[34],DAP型肽聚糖可以激活果蝇的Imd通路。已有研究表明,果蝇的PGRP-SD作为胞外受体不参与Toll通路,而是参与Imd通路的激活[35]。本研究发现DmPGRPSD出现显著上调,提示英诺克李斯特菌侵染果蝇S2细胞后Imd通路可能被激活。抗菌肽Attacin、Cecropin和Diptericin的表达主要受Imd通路的调控[36-37],本研究结果显示果蝇的抗菌肽基因DmAtt A、DmAtt B、DmAtt D和DmCec A2和DmCec B均出现显著上调,显示了Imd通路的激活。而抗菌肽 Drosomycin、Defensin和Metchnikowin的表达主要受Toll通路调控[38],本研究结果中显示果蝇的抗菌肽基因DmDro、DmDef和DmMtk也出现了显著上调,提示英诺克李斯特菌可能同时引起了Imd和Toll通路的激活,但具体是Toll通路还是Imd通路起主要作用,则需要进一步的研究。抗菌肽被认为具有广谱性,但Hanson等[39]研究发现抗菌肽针对某些病原微生物具有特异性,Imd通路调控的抗菌肽对单增李斯特菌并不起作用[34]。Hanson等[39]研究还发现果蝇的spz基因缺失后对英诺克李斯特菌表现出极高的敏感性,提示在抵御英诺克李斯特菌的过程中,Toll通路调控的抗菌肽起重要作用。鉴于上述研究结果和单增李斯特菌与英诺克李斯特菌相近的亲缘关系,猜测宿主在抵御英诺克李斯特菌和单增李斯特菌侵染的过程中Toll通路调控的抗菌肽可能起到关键作用,但Toll通路的激活机制需要进一步深入研究。
英诺克李斯特菌作为一种胞内寄生菌,通过内吞作用侵入宿主细胞后会被包裹在吞噬体中,英诺克李斯特菌在宿主细胞中的增殖需要它从宿主的吞噬体中逃逸至细胞质中,我们注意到液泡型H+离子腺苷三磷酸酶 (Vacuolar H+-ATPase,VATPase)基因DmVha68-3和DmVha100-4均出现了显著下调,KEGG富集结果显示它们富集到吞噬体等通路中。DmVha68-3编码果蝇V-ATPase-A亚基,DmVha100-4编码V-ATPase-a亚基,为VATPase复合体形成的关键亚基[40],V-ATPase广泛存在于细胞器膜上,如内体、溶酶体及吞噬体膜,可以将H+泵入这些细胞器中以维持这些细胞器的相对酸性内环境,促进细胞器对内吞或是细胞自噬包裹的底物或是入侵的微生物进行降解[41-42]。单增李斯特菌的毒力因子LLO正常发挥作用时需要酸性环境,在pH 5.6时LLO的溶血活性最高,当pH超过7.0时LLO的活性基本丧失[43]。典型的英诺李斯特菌缺失毒力岛,而其侵染果蝇S2细胞后上述2个DmV-ATPase基因的下调是否跟毒力岛缺失有关目前尚不清楚,值得我们今后深入思考。此外,是否可以通过调控宿主细胞的V-ATPase活性从而抑制单增李斯特菌毒力因子LLO的活性对其进行防控,也是有益的思考。

