乌头对寒、热痹证大鼠痛觉敏感干预作用的药效学及作用机制研究
宋敬怡 张硕峰 马丹 程龙 程文豪 李颖慧
乌头自古是中医治疗痹证的经典用药,其性热、味苦、有大毒。《金匮要略》中明确指出乌头可祛除湿寒、温经通络。现代药理证明,乌头具有抗炎镇痛、保护心血管、抗癌等作用,临床试验表明乌头可使患者的疼痛指数降低,功能障碍改善明显[1-3]。
痹症的患病主要外因是机体受到风、寒、湿、热等外邪入侵,痹证常见的临床症状就是疼痛[4]。痹证引起的疼痛属于病理性疼痛,具体表现为痛觉敏感,其中神经元可塑性改变引起中枢敏化是慢性炎性疼痛产生的重要机制[5]。本实验在前期研究基础之上,利用风寒湿和风热湿两种致病因素叠加佐剂型关节炎复制寒痹证、热痹证模型,企图进一步扩大检测痛觉敏感的相关指标,发现痹证寒、热演变规律,同时了解温热药乌头对寒、热痹证的作用差异,这将对中医的证候研究、中药的药性理论研究具有广泛的示范意义。
1 材料与方法
1.1 实验动物
健康SD大鼠100只,SPF级,周龄:8周左右,雄性,体重200~250 g,(购于北京斯贝福实验动物技术有限公司,动物合格证号:11401500032878,11401500032657)。
1.2 实验药品
布洛芬缓释胶囊(中美天津史克制药有限公司),规格0.4 g/片,即0.8 g布洛芬/人/日(按药典内容计算),按成人体重75 kg计算,即0.01 g布洛芬/kg,大鼠受试剂量为临床人用量的6倍,即0.06 g/kg,按大鼠体重1 mL/100 g给药。
川乌头(生药材,由北京百诺威生物科技公司提供),临床用量为每人每天10 g生药(按药典内容计算),按成人体重75 kg计算,即0.13 g/kg,大鼠受试剂量分别为临床用量的12、6倍,即1.6 g/kg、0.8 g /kg。将乌头水提物稀释,浓度分别为 0.16 g /mL、0.08 g /mL。按大鼠体重1 mL/100 g给药。
1.3 实验仪器
冷热盘测痛仪(Cat. No:PE34, 美国IITC公司产品)。
1.4 分组与造模
大鼠100只,随机分为9组,组别如下:对照组,模型组,布洛芬组,热痹证组,寒痹证组,乌头热痹1.6 g、0.8 g/kg组,乌头寒痹1.6 g、0.8 g /kg组。
操作环境为无菌条件,在大鼠右后足跖部按0.1 mL/只注射完全弗氏佐剂建立大鼠佐剂型炎症模型。24 h后按寒热属性将需要造模的大鼠分别放入相应的恒温人工气候箱中,造模时长为4 h/日,造模周期为14天。热痹造模条件为:温度30℃,湿度60%,风速1.5 m/s;寒痹造模条件为:温度10℃,湿度70%,风速1.5 m/s。
1.5 指标检测
1.5.1 痛反应时间的检测 检测时间分别为第0天(基础值)、第3天、7天、10天、14天,观察部位为大鼠的右后肢足趾部。具体测量方法见相关文献[6],每只大鼠的测量次数总共为3次,每次测量距离上次测量的时间以超过10 min为宜, 痛反应时间则是3次测量数据的平均值。
1.5.2 Western Blot法测量相关蛋白 选取每组半数大鼠用于Western Blot法测量,于末次给药后禁食12 h,腹腔注射1.5 %戊巴比妥钠,待大鼠深度麻醉后,开胸使其心脏暴露,由主动脉灌入生理盐水约200 mL左右,直至流出液体变为淡粉色或无色为止,此时肝脏颜色呈现为土黄色。取出L4~6脊髓节段通过蛋白样品制备后得到蛋白样品,通过Western Blot法测量FKN、CX3CR1、NMDA受体表达,分析结果保存图片。
1.5.3 免疫组织化学法测量相关蛋白 选取每组半数大鼠用于免疫组织化学法测量,末次给药禁食12h后,深度麻醉取出被根神经节制作成石蜡切片,用免疫组织化学法检测相关因子的表达,观察图片结果。选取各组背根神经节标本数量为9张,每张选取3个视野,于显微镜400 倍的视野中观察,测量各组别背根神经节区域中阳性显色的平均光密度(average optical density,AOD)。
1.6 统计学处理
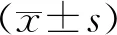
2 结果
2.1 乌头对寒、热痹证大鼠痛反应时间的影响
结果表明,模型组大鼠与对照组相比较, 各时间点的痛反应时间均明显缩短(P<0.05)。布洛芬有镇痛功效,给药后,与模型组相比较,布洛芬组大鼠的痛反应时间明显上调(P<0.05)。风寒湿因素引入后,与模型组相比较,前期可抑制寒痹证组大鼠患足对温度的敏感性,其中第3、7 天结果最为明显(P<0.05)。风热湿因素引入后,与模型组相比较,热痹证组大鼠的痛反应时间在第3天延长明显(P<0.05),其余时间点无显著性差异。
与热痹证组相比较,寒痹证组大鼠的痛反应时间延长明显,在第7、10天的结果尤为显著(P<0.05)。相比热痹证组,乌头热痹证各剂量组给药后痛反应时间均不同程度缩短,其中第3、7、10天乌头热痹证高剂量组作用最为明显(P<0.05)。相比寒痹证组,乌头寒痹证各剂量组给药后,表现为大鼠患足的痛反应时间得到不同程度的延长,其中乌头寒痹证高剂量组痛反应时间延长作用最明显(P<0.05),同剂量乌头寒、热痹证组相比较,在给药第7天, 乌头寒痹证组的痛反应时间显著性高于同剂量乌头热痹证组(P<0.05),见表1。
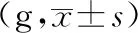
表1 乌头对寒、热痹证大鼠痛反应时间的影响
2.2 乌头对寒、热痹证大鼠脊髓中FKN、CX3CR1、NMDAR表达的影响
关于FKN结果显示,造模后,模型组大鼠脊髓中FKN的表达高于对照组,结果具有显著性差异(P<0.05),布洛芬组FKN的表达显著性低于模型大组(P<0.05)。与模型组相比较,寒、热痹证组大鼠脊髓中FKN蛋白表达显著性增加(P<0.05)。与寒痹证组相比较,乌头给药后,寒痹证组有明显抑制作用,FKN蛋白表达明显下降,高剂量效果最为明显(P<0.05)。热痹证组的结果正好相反,其中乌头热痹证高剂量组脊髓的FKN表达最高(P<0.05),同剂量组相比较,显著性高于同剂量寒痹证组(P<0.05),CX3CR1、NMDAR的结果与FKN的结果基本呈现一致性,见表2、图1、图2、图3。
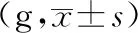
表2 乌头对寒、热痹证大鼠脊髓FKN、CX3CR1、NMDAR表达的影响

注:A-对照组,B-模型组,C-布洛芬组,D-热痹证组,E-寒痹证组,F-乌头热痹证0.8 g/kg剂量组,G-乌头热痹证1.6 g/kg剂量组,H-乌头寒痹证0.8 g/kg剂量组,I-乌头寒痹证1.6 g/kg剂量组。
图1 乌头对寒、热痹模型大鼠脊髓中FKN表达的影响
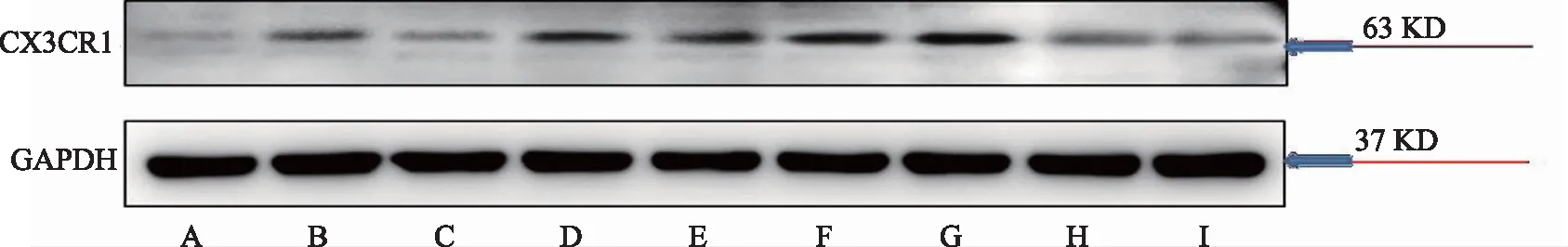
注:A-对照组,B-模型组,C-布洛芬组,D-热痹证组,E-寒痹证组,F-乌头热痹证0.8 g/kg剂量组,G-乌头热痹证1.6 g/kg剂量组,H-乌头寒痹证0.8 g/kg剂量组,I-乌头寒痹证1.6 g/kg剂量组。
图2 乌头对寒、热痹模型大鼠脊髓中CX3CR1表达的影响
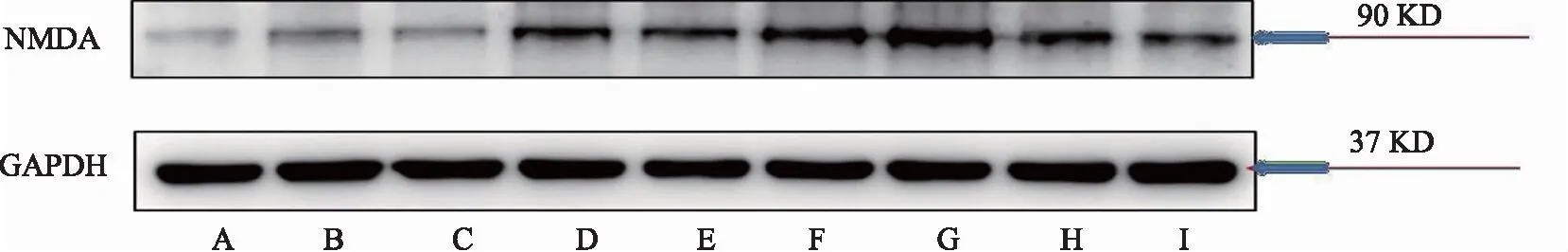
注:A-对照组,B-模型组,C-布洛芬组,D-热痹证组,E-寒痹证组,F-乌头热痹证0.8 g/kg剂量组,G-乌头热痹证1.6 g/kg剂量组,H-乌头寒痹证0.8 g/kg剂量组,I-乌头寒痹证1.6 g/kg剂量组。
图3 乌头对寒、热痹模型大鼠脊髓中NMDAR表达的影响
2.3 乌头对寒、热痹证模型大鼠患侧背根神经节中FKN、CX3CR1、CD11b/c、NMDAR表达的影响
结果表明,显微镜下,棕黄色颗粒即为FKN、CX3CR1、CD11b/c、NMDAR阳性表达部位,400倍物镜下拍照,之后用IPP6.0软件对图像进行分析。造模后,模型组大鼠背根神经节中FKN的表达上调,显著性高于对照组(P<0.05)。与模型组比较,布洛芬可明显抑制大鼠背根神经节中FKN的表达(P<0.05)。风寒湿、风热湿热因素的引入后,与模型组相比,寒痹证组、热痹证组背根神经节中FKN的表达均明显上升(P<0.05)。与寒痹证组比较,乌头给药2周后,发现各剂量可明显下调寒痹证组FKN的表达(P<0.05)。与热痹证组比较,乌头热痹证各剂量组的结果相反,FKN的表达程明显上升趋势,且剂量越大越明显(P<0.05),且显著性高于同剂量寒痹证组(P<0.05),CX3CR1、CD11b/c、NMDAR的表达结果与FKN的表达结果呈现出一致性,见表3、图4、图5、图6、图7。
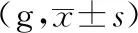
表3 乌头对寒、热痹模型大鼠患侧背根神经节FKN、CX3CR1表达的影响

注:A-对照组,B-布洛芬组,C-模型组,D-热痹证组,E-寒痹证组,F-乌头热痹证0.8 g/kg剂量组,G-乌头热痹证1.6 g/kg剂量组,H-乌头寒痹证0.8 g/kg剂量组,I-乌头寒痹证1.6 g/kg剂量组。
图4 乌头对寒、热痹证大鼠背根神经节FKN表达的影响(免疫组化法400×)
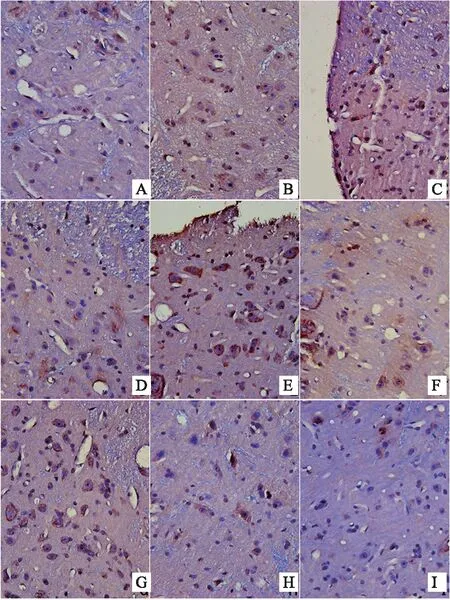
注:A-对照组,B-布洛芬组,C-模型组,D-热痹证组,E-寒痹证组,F-乌头热痹证0.8 g/kg剂量组,G-乌头热痹证1.6 g/kg剂量组,H-乌头寒痹证0.8 g/kg剂量组,I-乌头寒痹证1.6 g/kg剂量组
图5 乌头对寒、热痹证大鼠背根神经节CX3CR1表达的影响(免疫组化法400×)
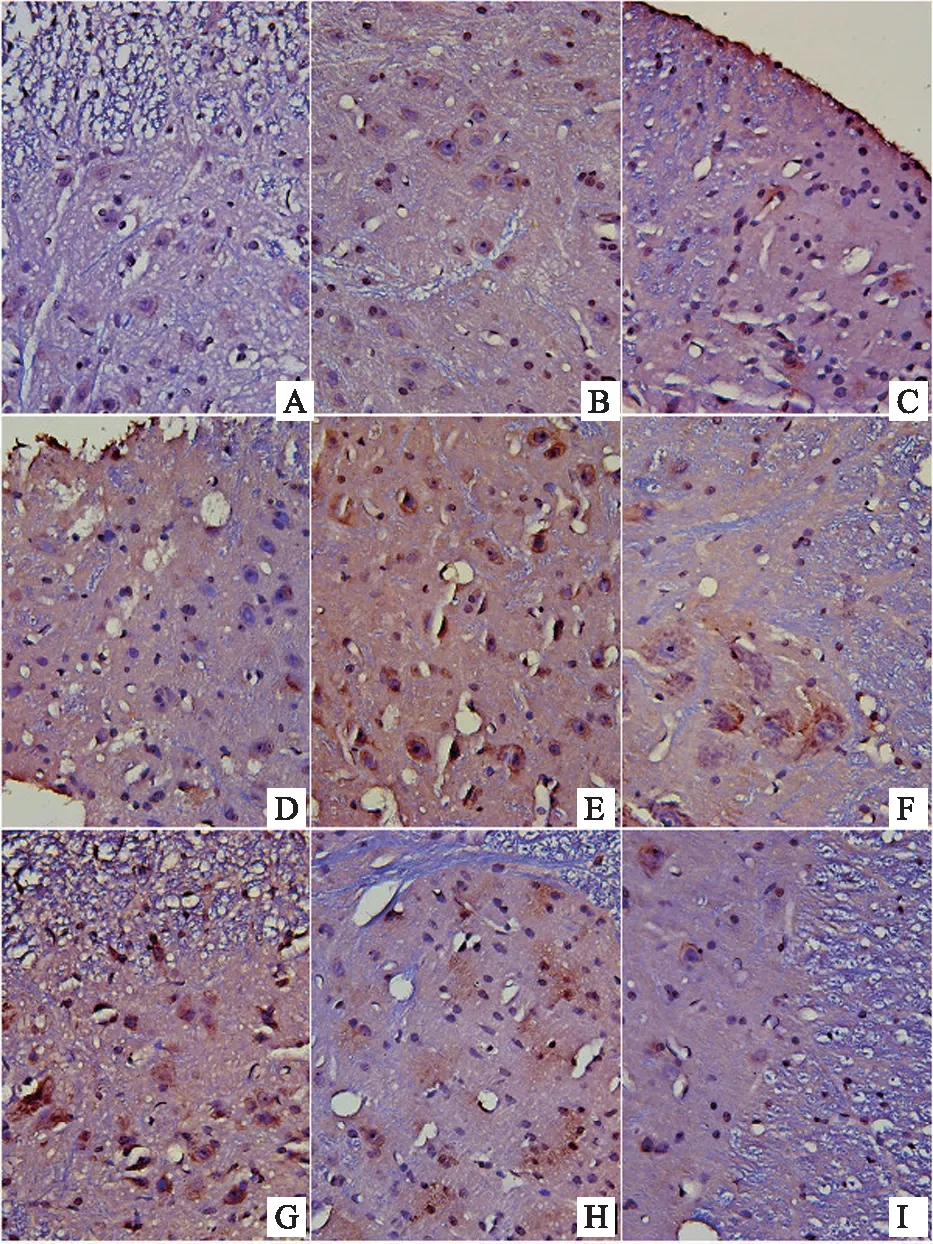
注:A-对照组,B-布洛芬组,C-模型组,D-热痹证组,E-寒痹证组,F-乌头热痹证0.8 g/kg剂量组,G-乌头热痹证1.6 g/kg剂量组,H-乌头寒痹证0.8 g/kg剂量组,I-乌头寒痹证1.6 g/kg剂量组。
图6 乌头对寒、热痹证大鼠背根神经节CD11b/c表达的影响(免疫组化法400×)
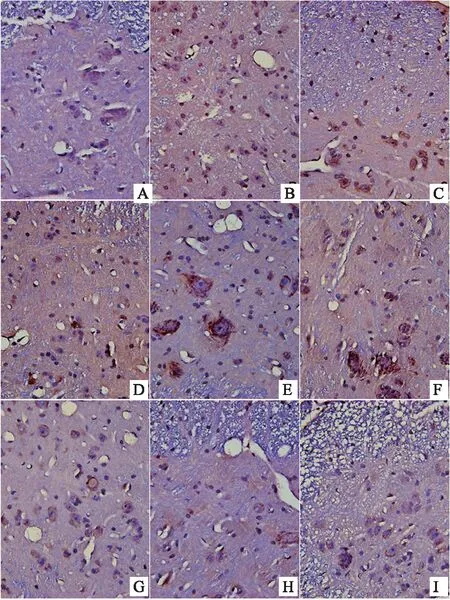
注:A-对照组,B-布洛芬组,C-模型组,D-热痹证组,E-寒痹证组,F-乌头热痹0.8 g/kg剂量组,G-乌头热痹证1.6 g/kg剂量组,H-乌头寒痹证0.8 g/kg剂量组,I-乌头寒痹证1.6 g/kg剂量组。
图7 乌头对寒、热痹证大鼠背根神经节NMDAR表达的影响(免疫组化法400×)
3 讨论
乌头属毛茛科植物,其药用资源十分丰富,主要产地为四川、陕西,据统计可入药的乌头种类多达70余种[7-8]。乌头的功效主要为祛风除湿和温经散寒,是治疗风寒湿痹的代表药,现在主要用于治疗类风湿关节炎、神经性疼痛、中风以及寒凉引起的脏腑之痛等[9]。中国使用乌头最早的记录为《金匮要略》中的乌头汤。现代医学研究证明,乌头最主要的抗炎、镇痛成分为二萜生物碱,是在19世纪80年代从乌头属植物中分离得到的,镇痛的主要部位为脊髓和背根神经节,可改善神经病理性疼痛引起的痛觉过敏[10-14]。
痹证引发的疼痛属于神经病理性疼痛,其主要发生机制则是中枢敏化。中枢敏化的产生会将疼痛信号放大,使机体对非伤害刺激或正常范围内的伤害刺激敏感化。大鼠佐剂型关节炎常被用作研究痹证的动物模型,其病理特征与中医痹证呈现高度的一致性,主要表现为关节肿胀、疼痛敏感。现代研究表明痹证所造成的长期炎症可造成关节损伤,但其寒热属性并不明显,因此对镇痛除痹的相关中药的药理作用研究存在局限性[15]。故在前期研究的基础之上,利用佐剂型关节炎大鼠模型,引入风寒湿和风热湿因素制作寒、热痹证模型,观察相关指标的变化。结果显示正常大鼠的右足跖部在注射完全弗氏佐剂后,第3天后模型组大鼠就表现出痛觉敏感,与对照组相比,痛反应时间明显缩短,此现象保持到实验结束(P<0.05)。风寒湿加入后,开始可抑制寒痹证组大鼠患足对温度刺激的敏感性,随著时间的推移,风寒湿可加剧寒痹模型组大鼠的痛觉敏感,而风热湿对热痹模型组的温度阈值影响反应小,具体表现为热痹证组的痛反应时间与模型组相比较,差异无统计学意义。
本研究对寒、热痹证模型大鼠均给予高、中剂量的乌头水提物,主要目的是区分热性中药对寒、热痹证大鼠痛觉敏感的干预作用的不同之处。结果显示,与寒痹证组相比,连续14天给予乌头水提物,寒痹证组大鼠的痛反应时间得到明显上调(P<0.05);而热痹证组给药后,均加重了热痹证组大鼠对温度刺激的敏感性,其中乌头热痹1.6 g/kg剂量组最为明显。由此说明乌头对寒痹证组大鼠的痛觉敏感有抑制作用,而对热痹证组大鼠的作用相反。提示:佐剂型关节炎模型大鼠叠加风寒湿、风热湿制作寒痹证组、热痹证组与中医寒、热痹证的证候特点一致。
前期研究证明,可初级传入谷氨酸的C纤维以及谷氨酸受体阳性神经元主要分布在脊髓背角浅层,其中在神经病理疼痛形成过程与N-甲基-D-天门冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)功能变化密不可分。原因是NMDAR可整合并传递相关疼痛信息,参与脊髓神经元的可塑性变化。正常情况下,NMDAR处于静息状态,Mg2+与内通道相应位点结合阻止Ca2+进入细胞内。当机体受到伤害时,兴奋性氨基酸(excitatory amino acids,EAA)在脊髓后角释放后导致NMDAR被磷酸化,此时NMDAR处于兴奋状态,解除了Mg2+与内通道对应位点的结合,Ca2+大量内流进入背角神经元细胞,诱导持续性放电,并可使兴奋不断循环,疼痛信号持续放大。由此可见神经病理性疼痛的产生与NMDAR的激活以及Ca2+内流关系密切,对脊髓背角神经元的可塑性有重要的意义,是中枢敏化产生的关键[16-19]。
大量研究证明神经病理性疼痛的刺激,可将脊髓水平的神经胶质细胞以及小胶质细胞激活,其中神经胶质细胞在痛觉敏感机制调节中发挥着至关重要的作用,可将通过神经元细胞传入的伤害性信息整合,释放对应的炎性因子。试验结果发现寒痹证组、热痹证组大鼠患侧脊髓和背根神经节的不规则趋化因子(Fractalkine,FKN)与CX3CR1受体表达上调。当机体出现痛觉敏感时,FKN在脊髓和背根神经节中的表达均上升, CX3CR1作为FKN的特异性受体,其表达结果与FKN有着高度的一致性,最终可导致细胞间的黏附性增加。炎症反应会使FKN/CX3CR1系统激活,此时与细胞膜结合的FKN脱离细胞膜,成为游离型FKN,与胶质细胞中的CX3CR1受体结合,此时胶质细胞呈现被激活的状态[20-21],中枢敏化因此产生。
结果显示,造模后,相比对照组,炎症反应导致模型组大鼠脊髓、背根神经节中NMDAR的表达上调(P<0.05)。风寒湿和湿热因素加入后,与模型组相比,加重了寒、热痹证组大鼠脊髓中NMDAR的表达(P<0.05),而寒痹证组与热痹证组相比,热痹证组更严重(P<0.05)。以上结果显示各模型组大鼠痛觉敏感均已经形成,且风寒湿和风热湿会加重寒、热痹证大鼠的痛觉敏感,其中NMDAR在脊髓和背根神经节中的表达上升趋势与热痹疼痛的关联更紧密。与寒痹证组相比,乌头水提物给药14天后, NMDAR在寒痹证组当中的表达下调(P<0.05),在热痹证组表达与之相反(与热痹证组相比,P<0.05)。综上所述,NMDAR在乌头各剂量组大鼠脊髓和背根神经节中表达与其乌头给药组大鼠痛反应时间的影响结果一致。
CD11b/c、FKN、CX3CR1的检测结果与NMDAR检测结果相似,上述结果显示,加入风寒湿和风热湿会加剧寒、热痹证大鼠痛觉敏感。温热药乌头对寒、热痹证的干预作用存在差异,首先乌头对寒痹证具有明显的镇痛作用,但可加重热痹证的疼痛程度。乌头的这种干预作用与其调节大鼠脊髓和背根神经节中FKN、CX3CR1、CD11b/c、NMDAR的表达有关。以上结论以期为痹证后续的相关研究提供相关的实验依据。

