3D-ASL与DSC-PWI在高级别脑胶质瘤术后复发和放射性脑坏死鉴别诊断中的应用
石慧娴,韩 雷,叶 靖,张洪英
1.大连医科大学研究生院,辽宁 大连 116044;
2.苏北人民医院影像科,江苏 扬州 225001
脑胶质瘤是中枢神经系统最常见的原发性恶性脑肿瘤,近年来发病率不断上升[1]。高级别脑胶质瘤(high-grade glioma,HGG)具有无限增殖和高度侵袭的特点,平均生存期短,易复发,临床治疗以最大范围切除病灶并辅以术后放化疗为主,但长期放疗可导致大脑组织受损。放射性脑损伤根据出现时间分为急性型、早迟发反应型、晚迟发反应型,晚迟发反应型可分为无病灶期、水肿期、坏死期和囊变期[2]。HGG术后复发和放射性脑坏死期的影像学表现极其相似,磁共振成像(magnetic resonance imaging,MRI)增强扫描均出现新增的异常强化灶[3-4],然而二者的治疗策略及预后截然不同。MRI增强扫描长期随访有助于鉴别肿瘤复发和放射性脑坏死,但缺乏时效性。随着MRI脑灌注技术的发展及临床应用,为鉴别两者提供了新的切入点。本研究旨在讨论三维动脉自旋标记(three-dimensional arterial spin labeling,3D-ASL)与动态磁敏感对比增强(dynamic susceptibility contrastenhanced,DSC)-灌注加权成像(perfusionweighted imaging,PWI)在诊断HGG术后放疗后新增强化灶性质的临床价值。
1 资料和方法
1.1 一般资料
回顾并收集2013年1月—2019年5月于苏北人民医院经HGG术后辅助放射治疗的63例患者的临床及影像学资料。纳入标准:① 均经外科手术切除,病理学诊断为Ⅲ~Ⅳ级脑胶质瘤;② 患者术后均经苏北人民医院放疗科放射治疗;③ 患者均于术后(2周内)及放化疗后每3个月定期行MRI检查,并在原术区出现异常强化灶。排除标准:① 术后2周内MRI增强扫描显示肿瘤有残留者;② 随访过程中第1次MRI增强显示强化范围减小,第2次及以上又增大者;③ 排除运动伪影较大者。最终40例患者纳入研究,男性22例,女性18例,年龄29~76岁,平均(55±11)岁,世界卫生组织(World Health Organization,WHO)分级为Ⅲ级13例、Ⅲ~Ⅳ级6例、Ⅳ级21例。
符合下述条件之一的诊断为HGG术后复发:① 第2次手术病理学检查证实有活性肿瘤细胞的;② 随访过程中连续两次以上MRI增强(大于6个月)显示强化范围进行性增大/增多或在手术野外出现新的强化病灶。符合下述条件之一的诊断为放射性脑坏死:① 第2次手术病理学检查结果未见有活性肿瘤细胞的;② 随访过程中连续两次以上MRI(大于6个月)显示强化范围逐渐减小或不变的。最终确诊复发20例,其中4例经病理学检查确诊,16例经MRI增强长期随访证实;确诊放射性脑坏死20例,其中2例经病理学检查确诊,18例经MRI增强长期随访证实。
本研究经苏北人民医院医学伦理委员会审核通过。
1.2 检查方法
采用美国GE公司的Discovery MR750 3.0T超导磁共振扫描仪,8通道相控阵头部线圈。对患者于放疗完成后每3个月进行1次MRI检查,扫描序列包括增强扫描(有或无平扫)、3D-ASL及DSC-PWI检查。常规MRI平扫参数:视野24 cm×24 cm,层厚5 mm,层间距1 mm。序列:横断位T1WI[重复时间(repetition time,TR)400 ms,回波时间(echo time,TE)10 ms]、T2WI、T2液体衰减反转恢复序列(T2 fluid attenuated inversion recovery,T2 FLAIR)及矢状位T2WI(TR 4 200 ms,TE 102 ms)、扩散加权成像(diffusion-weighted imaging,DWI;TR 4 500 ms,TE为最小值,b值=0、1 000 s/mm2)。再行3D-ASL扫描,横断面成像,扫描时间281 s,扫描参数为TR 4 844 ms,TE 10.5 ms,矩阵64×64,层厚4 mm,层间距0 mm,层数36层,视野24 cm×24 cm,激励次数3,标记后延迟时间(post labeling delay time,PLDT)2 025 ms。然后行DSC-PWI扫描,由高压注射器经肘前静脉团注钆喷酸葡胺(Gd-DTPA,0.1 mmol/kg),注射流率为3 mL/s,注药时机选择为扫描第5个时相,采用对比剂首过动态增强平面回波成像(echo planar imaging,EPI)序列,横断面成像,扫描50个时相,扫描时间75 s,扫描参数为TR 1 800 ms,TE 15.9 ms,矩阵128×128,层厚5 mm,层间距1 mm,视野24 cm×24 cm,激励次数1。最后行T1WI常规增强扫描。全部患者行3D-ASL,32例行DSC-PWI,其中HGG复发20例,放射性脑坏死12例。
1.3 图像处理及分析
将3D-ASL、DSC-PWI原始图像分别传送至美国GE公司AW4.6磁共振后处理工作站,采用Functool软件进行图像处理,获取各血流动力学参数的伪彩图,包括3D-ASL-脑血流量(3D-ASL-cerebral blood flow,ASL-CBF)、DSC-PWI-CBF(DSC-CBF)、DSC-脑血容量(DSC-cerebral blood volume,DSC-CBV)、DSC-平均通过时间(DSC-mean transit time,DSC-MTT)及DSC-达峰时间(DSC-time to peak,DSC-TTP)。由2名有丰富经验的影像科医师共同判定脑胶质瘤患者术后放疗后出现异常强化灶的范围,结合MRI增强图像,在病灶实性最大血流灌注区域、对侧镜像正常部位勾画出感兴趣区(region of interest,ROI),ROI选取病灶最大层面,大小为10~20 mm2,避开出血、血管、囊变坏死区域,测量3次取其平均值。测得相应灌注值后,为了消除个体差异的影响,将病灶灌注值标准化(病灶平均灌注值/对侧镜像正常部位),所得比值为病灶平均相对灌注比值,分别为ASL-rCBF、DSC-rCBF、DSC-rCBV、DSC-rMTT、DSC-rTTP。
1.4 统计学处理
采用SPSS 25.0软件进行统计分析,实验数据采用±s表示。对两组新增异常强化灶的血流动力学参数差异的比较采用两独立样本t检验,P<0.05为差异有统计学意义;应用受试者工作特征(receiver characteristic operating,ROC)曲线确定最佳临界值及其对应的灵敏度、特异度及曲线下面积。
2 结 果
2.1 常规MRI及3D-ASL、DSC-PWI灌注表现
HGG术后复发及放射性脑坏死在MRI上均表现为:T1WI呈稍低信号,T2WI呈高信号,周围伴水肿;增强后呈条絮状、花环样或不规则环形强化(图1~2)。全部HGG术后复发患者MRI增强扫描强化的区域ASL-CBF、DSCCBF、DSC-CBV灌注增高,伪彩图上为黄-红色(图1D~F);对于放射性脑坏死组,除了2例患者MRI增强扫描强化的区域在ASL-CBF、DSCCBF、DSC-CBV上呈高灌注外,其余患者病灶区在ASL-CBF、DSC-CBF、DSC-CBV上呈等-低灌注表现,伪彩图表现为蓝-黑色(图2D~F)。
2.2 3D-ASL、DSC-PWI灌注成像相关参数比较及ROC曲线分析
HGG术后复发组的血流动力学参数ASLrCBF、DSC-rCBF、DSC-rCBV明显高于放射性脑坏死组(P<0.01),以ASL-rCBF=2.32、DSC-rCBF=1.95、DSC-rCBV=2.24为临界值,诊断HGG术后复发的灵敏度分别为83.3%、83.3%、91.7%,特异度分别为90.0%、75.0%、70.0%,ROC曲线的曲线下面积分别为0.975、0.933、0.946,可见ASL-rCBF的诊断效能最高(表2,图3)。并且ASL-rCBF值普遍高于DSCrCBF值。而DSC-rMTT、DSC-rTTP在HGG术后复发组与放射性脑坏死组之间的差异无统计学意义(P=0.21、0.15,表2)。
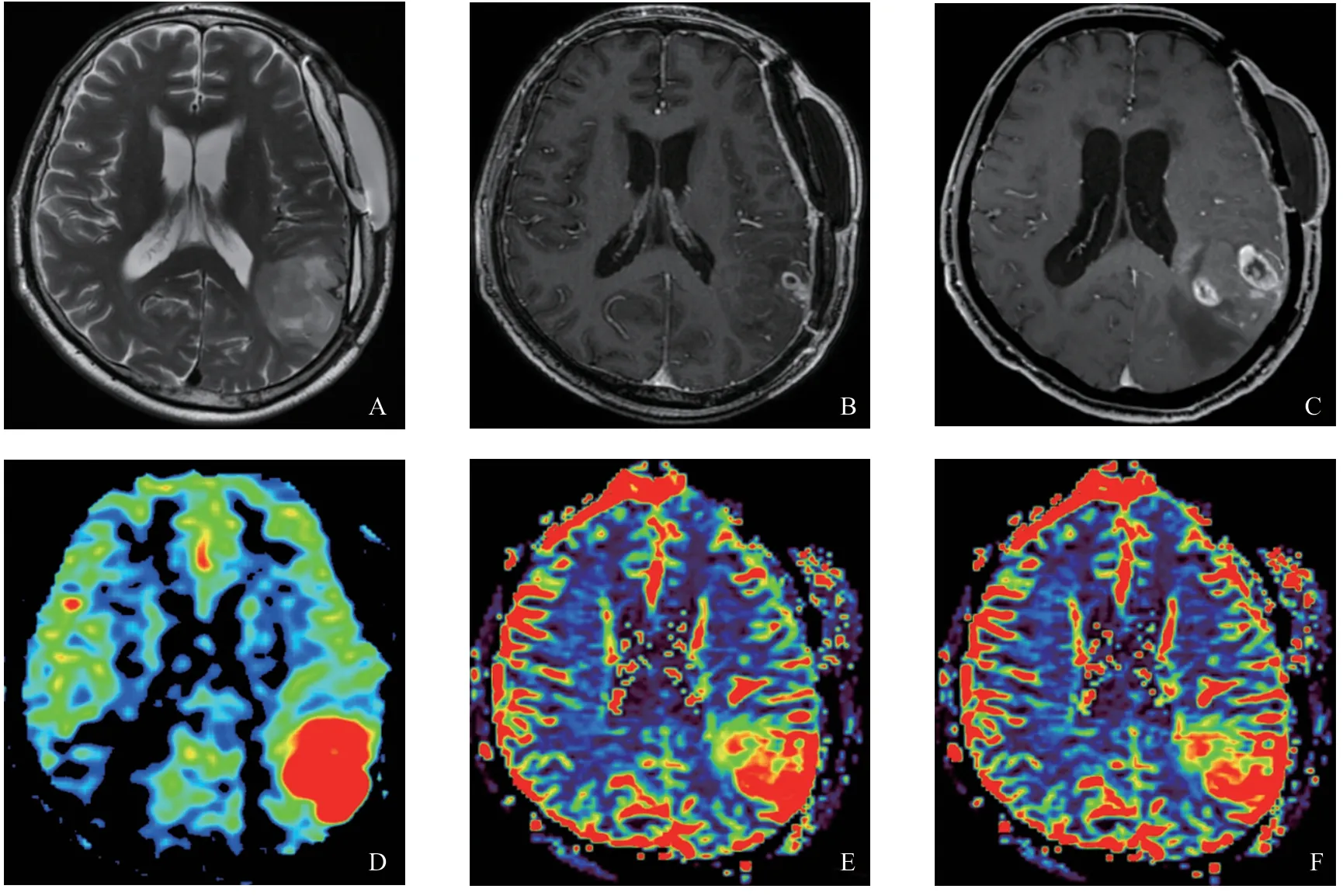
图1 HGG术后复发MRI图像
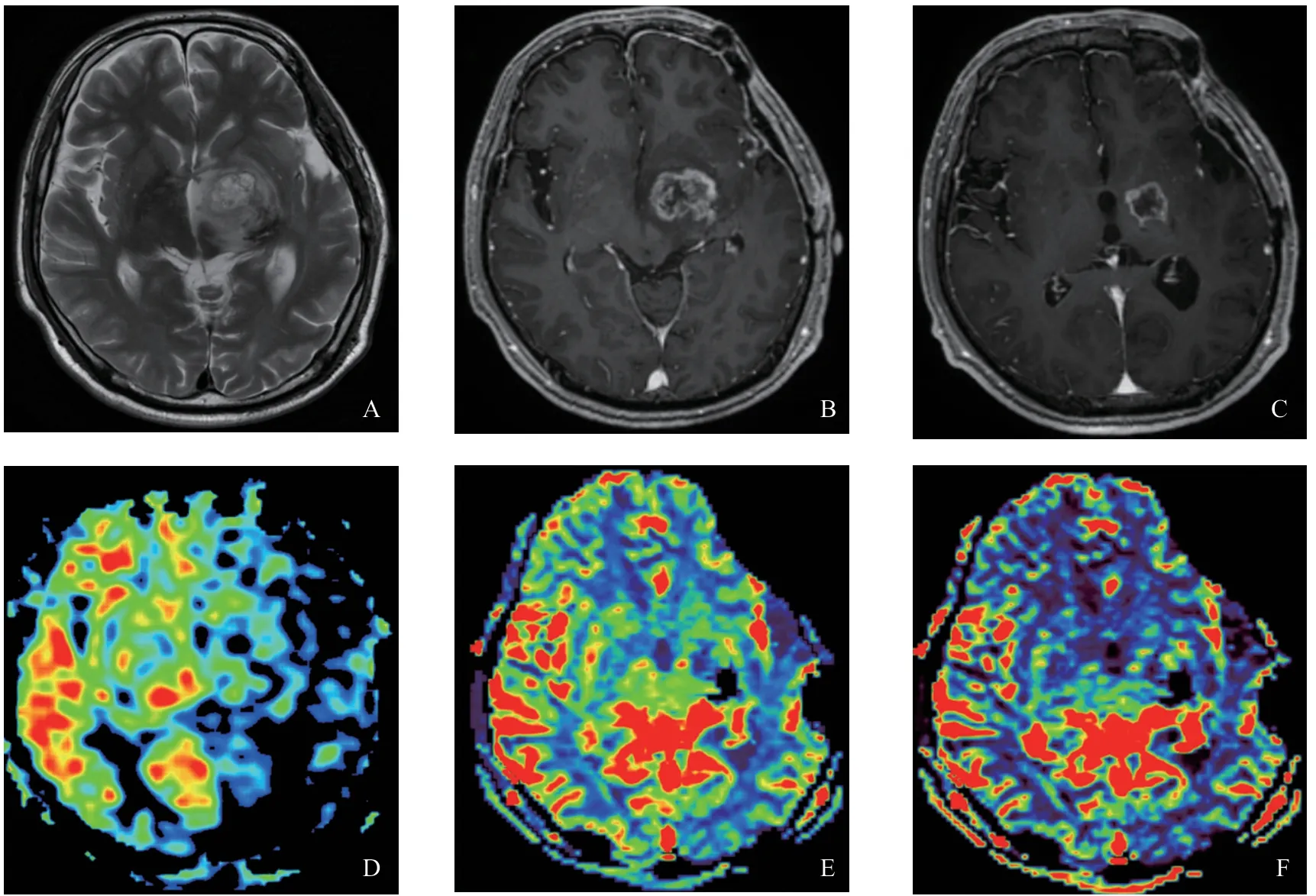
图2 HGG术后放疗后放射性脑坏死MRI图像
表2 HGG术后复发组(A组)与放射性脑坏死组(B组)3D-ASL、DSC-PWI相关血流动力学参数的比较 (±s)
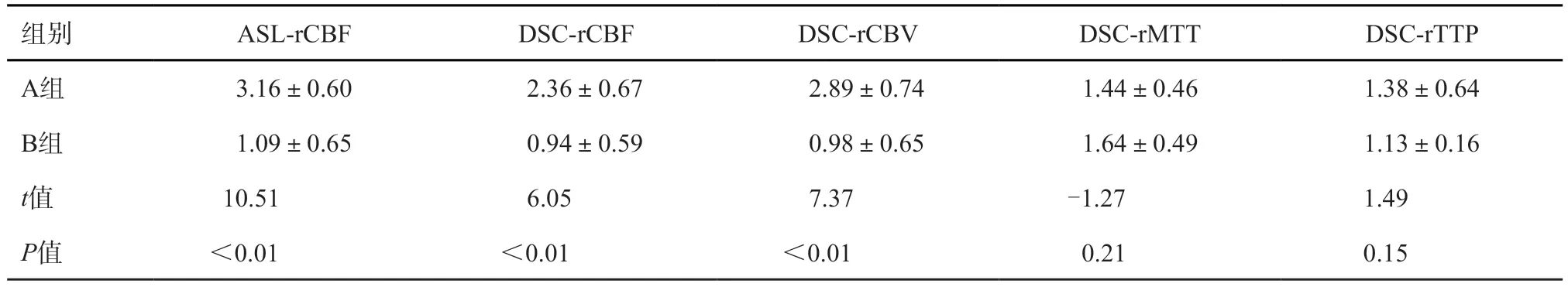
表2 HGG术后复发组(A组)与放射性脑坏死组(B组)3D-ASL、DSC-PWI相关血流动力学参数的比较 (±s)
组别 ASL-rCBF DSC-rCBF DSC-rCBV DSC-rMTT DSC-rTTP A组 3.16±0.60 2.36±0.67 2.89±0.74 1.44±0.46 1.38±0.64 B组 1.09±0.65 0.94±0.59 0.98±0.65 1.64±0.49 1.13±0.16 t值 10.51 6.05 7.37 -1.27 1.49 P值 <0.01 <0.01 <0.01 0.21 0.15

图3 ASL-rCBF、DSC-rCBF、DSC-rCBV鉴别HGG术后复发和放射性脑坏死的ROC曲线
3 讨 论
HGG术后复发和放射性脑坏死均可表现为不同程度的异常强化,两者鉴别困难,且处理原则及预后也不同,放射性坏死为不可逆性损伤,需要积极干预治疗,如糖皮质激素、脱水及脑保护治疗药物等对症处理[2],若误诊为肿瘤复发且采取手术治疗切除病灶将给患者带来二次伤害[5]。病理学上,HGG术后复发时肿瘤细胞迅速增生,同时生成大量新生血管,而新生血管内皮细胞连接不紧密,有较大空隙,致使血管的通透性明显增高,大分子对比剂可以通过[6-7]。而放射性脑坏死可能是治疗因素或肿瘤细胞自身的DNA破坏,血管内皮细胞出现损伤和坏死,同时部分发生炎性反应及血管增生,血管通透性仅轻度增高[8]。不同的病理学特征使两者表现出不同的灌注特点。
ASL通过射频(radio frequency,RF)脉冲对动脉血中水分子氢质子进行标记,水分子可以自由扩散通过血脑屏障(blood-brain barrier,BBB),所以能更切实反映组织灌注水平[9]。DSC-PWI是基于对比剂首过毛细血管床进行分析,它反映的是肿瘤内血流动力学改变程度和肿瘤内血管数目多少,而不是BBB的破坏程度[10]。潘锋等[11]的研究结果显示,脑胶质瘤术后复发和放射性脑损伤患者的ASL-CBFmax/对侧镜像区平均值分别为2.83±0.54、0.90±0.19,平均最大相对脑血流量(ASL-rCBFmax)两组患者之间存在明显差异(P<0.01)。Blasel等[12]的研究显示,DSC-rCBVmax可以有效鉴别脑胶质瘤术后复发和治疗后改变。
因为HGG术后复发区血管内皮生长因子表达增强及大量新血管生成,所以在3D-ASL与DSC-PWI上呈高灌注改变,而放射性脑坏死区由于血管内皮细胞死亡,所以在3D-ASL与DSCPWI上呈缺血低灌注改变,这是3D-ASL与DSCPWI灌注技术鉴别两者的重要基础[6-8]。本研究中,各项平均相对血流动力学参数中ASLrCBF、DSC-rCBF、DSC-rCBV值在复发组与坏死组之间的差异均有统计学意义,与既往研究结果[13-16]一致。但有2例放射性脑坏死患者病灶区ASL-CBF、DSC-CBF、DSC-CBV明显高于对侧镜像区,我们推测可能原因是肿瘤复发与放射性坏死同时存在,导致强化区各血流动力学参数比值存在不确定性。本研究发现DSC-rCBF值小于ASL-rCBF值,可能原因是DSC-PWI是基于理想的单室血流动力学模型,即在BBB没有被破坏的前提下得出,没有考虑到对比剂在感兴趣区的渗透问题,造成对DSC-rCBF、DSC-rCBV的低估。MTT、TTP值反映血流速率,因为血管灌注压、血管管径、侧支循环以及血管的形态、走形等因素都可影响MTT、TTP值[17],所以在HGG术后复发和放射性脑坏死的鉴别中价值有限。对于3D-ASL、DSC-PWI两种灌注方法而言,ASLrCBF诊断效能高于DSC-rCBF、DSC-rCBV,当ASL-rCBF为2.29时,诊断效能最高。
本研究也存在一定局限性:① 样本量较小,需要更大的群体进一步研究。② 只分析了增强最明显的区域,而部分水肿区域可能是肿瘤浸润的表现,或许有助于提高对肿瘤的评价。③ 在放疗后囊变较大而实性成分较少的患者中,勾画感兴趣区时不可避免的与囊性成分有重叠,从而导致各参数值的低估。
总之,HGG术后复发和放射性脑坏死的有效鉴别直接关系到患者治疗方式的选择及预后。3D-ASL、DSC-PWI均可鉴别HGG术后复发和放射性脑坏死。3D-ASL诊断效能更高,并且其安全无创、简单易行、可重复性强,可作为脑胶质瘤术后长期随访的理想方法,为进一步指导临床制定治疗方案提供可靠依据。

