木薯MeHSF7基因克隆及表达分析
曾坚 廖凤凤 吴春来 胡伟


摘要:【目的】克隆木薯熱激转录因子(HSF)基因MeHSF7并分析其在抗逆响应和采后生理性变质(PPD)过程中的表达情况,为研究MeHSF7基因在响应干旱胁迫及延缓生理性变质的调控机制提供理论参考。【方法】通过同源克隆从木薯叶片克隆MeHSF7基因,对其生物信息学和组织表达特性进行分析,并明确其在干旱和脱落酸(ABA)处理下及PPD过程中的表达模式。【结果】克隆获得的MeHSF7基因开放阅读框(ORF)为1206 bp,编码401个氨基酸残基,与参考序列(Manes.02G087400.1)仅存在2个碱基差异,位于第2染色体上,含有1个内含子和2个外显子。MeHSF7蛋白理论分子量46.1 kD,理论等电点(pI)5.95,为不稳定蛋白,定位于细胞核,无跨膜区域,含有HSF蛋白的保守结构域DBD(DNA结合功能域)、HR-A Core和HR-B Core,属于HSFA亚家族,与橡胶树和麻疯树HSF蛋白的氨基酸序列同源性最高,分别为79.20%和64.95%,在系统发育进化树上与橡胶树HSF蛋白聚在同一小分支,表明二者亲缘关系较近。MeHSF7基因在不同组织中的表达量均较低,但不同组织间存在明显差异,在松散性胚性愈伤组织、分化胚组织、须根和根顶端分生组织中的表达量相对较高,在叶柄中的表达水平最低。MeHSF7基因启动子区域含有ABA响应元件(ABRE)、干旱诱导元件(MBS)和光响应元件(ACE、Box 4)等。干旱处理下,MeHSF7基因表达量随处理时间的增加整体上呈升高趋势,在处理7 d后达峰值;在ABA处理下,处理5和7 d后MeHSF7基因表达量较处理0和3 d后明显上调,尤其在处理5 d后达峰值,表明MeHSF7基因表达受干旱和ABA处理的诱导。在木薯块根的PPD过程中,MeHSF7基因表达量随暗培养时间的增加而升高,处理6、12和48 h的表达量分别是处理0 h的2.1、2.2和3.2倍。【结论】MeHSF7基因可能在转录水平通过依赖于ABA信号通路的途径响应干旱胁迫及木薯块根的氧化胁迫,可作为候选基因用于研究其在木薯抗逆和采后储存中的调控功能。
关键词: 木薯;热激转录因子(HSF);MeHSF7基因;克隆;干旱胁迫;采后生理性变质(PPD);表达分析
Abstract:【Objective】In order to analyze the function of cassava heat shock transcription factor(HSF) gene MeHSF7 during drought stress and post-harvest physiological deterioration(PPD) process, MeHSF7 gene was cloned and analyzed the expression in stress response and PPD. 【Method】In this paper,MeHSF7 was cloned from cassava through homologous cloning method. The bioinformatic analysis and tissues expression pattern of MeHSF7 were conducted, the expression of MeHSF7 gene was also analyzed under drought and abscisic acid(ABA) treatments and in PPD. 【Result】The open reading frame(ORF) of MeHSF7 was 1206 bp, encoded 401 amino acid residues. MeHSF7 located on chromosome 2 and contained one intron and two exons, which had only two base differences from the reference sequence (Manes.02G087400.1). MeHSF7 protein theoretical molecular weight was 46.1 kD, theoretical isoelectric point(pI) was 5.95. It was an unstable protein and located in the nucleus with no transmembrane domains,which contained conserved domain with HSF protein, such as DNA binding domain (DBD), HR-A Core, HR-B Core, belonging to HSFA family. Multiple protein sequence alignment presented that MeHSF7 showed a high sequence similarity with HSF proteins in Hevea brasiliensis (79.20%) and Jatropha curcas (64.95%), and clustered in the same small branch with H. brasiliensis HSF,suggesting close genetic relationship. The expression of MeHSF7 was low in different tissues, but there were obvious differences among different tissues. The expression of MeHSF7 was relatively high in friable embryogenic calli, organized embryogenic structure, fibrous roots and root apical meristem, while the expression level was the lowest in petiole. Results of promoter element analysis revealed that MeHSF7 contained ABA responsive motif (ABRE), drought-induced motif (MBS), and several light-responsive motifs(ACE and Box 4). The expression of MeHSF7 was up-regulated accompanying with PEG treatment time increased and reached its peak at 7 d under drought treatment. The expression of MeHSF7 gene was also up-regulated 5 and 7 d after ABA treatment compared with that on day 0 and day 3, and reached its peak at 5 d. These results showed that MeHSF7 was induced by drought stress and ABA treatment. The expression of MeHSF7 was up-regulated as dark culture time expanded under cassava root PPD, and reached 2.1 times, 2.2 times and 3.2 times at 6,12 and 48 h of PPD process, respectively. 【Conclusion】MeHSF7 might responds to drought stress and cassava root oxidative stress relying on ABA signal path way at transcription level, and it can be regarded as a candidate gene for future function analysis in cassava stress tolerance and post-harvest storage.
Key words: cassava; heat shock transcription factor(HSF);MeHSF7 gene; cloning; drought stress; post-harvest physiological deterioration(PPD); expression analysis
0 引言
【研究意义】木薯(Manihot esculenta)作为三大薯类作物之一,在热带及亚热带地区广泛种植,具有较强的抗旱性和耐贫瘠性,是全世界约7亿人口的主食,同时是生产酒精等产品的重要工业原料(Oliveira et al.,2014;张鹏等,2014;Hu et al.,2016;韦祖生等,2017;胡广和梁大成,2019)。研究发现,植物为适应生长过程中的生物逆境胁迫和非生物逆境胁迫,已进化出许多抵御机制(Bartels and Sunkar,2005;Ohama et al.,2017),其中,热休克反应是植物体内非常重要的一种抵御机制,而作为调节热休克反应中的关键蛋白——热激转录因子(Heat shock transcription factor,HSF)通过转录水平调控不同抗逆基因表达,可提高植物在高温、干旱和氧化损伤等逆境中的适应能力(Guo et al.,2016;Jiang et al.,2017;Li et al.,2018;Zhou et al.,2018)。可见,HSF在植物应对非生物逆境胁迫中发挥重要作用。此外,由于木薯块根易氧化发生采后生理性变质(Post-harvest physiological deterioration,PPD),难以储藏,极大限制其加工利用(马秋香等,2009;Salcedo and Siritunga,2011;张振文和李开绵,2012)。因此,克隆木薯HSF基因并进行表达分析,对深入研究其在木薯PPD过程和抗非生物胁迫中的调控机制具有重要意义。【前人研究进展】HSF是植物中的重要转录因子,含有DNA结合功能域(DNA bingding domain,DBD)、寡聚化功能域(Oligomerization domain,OD)和核定位信号(Nuc-lear localization signal,NLS)等(Guo et al.,2016)。大量研究表明,HSF能显著提高植物应对非生物胁迫的能力(Guo et al.,2016;Ohama et al.,2017;Albihlal et al.,2018)。水稻过表达TaHSFA4a基因能提高植株在高浓度重金属环境中的耐受性(Shim et al.,2009);番茄过表达SlHsfA1基因能提高植株的耐热性(Scharf et al.,2012);拟南芥过表达不同HSF基因可提高植株对不同逆境的耐受性(Ohama et al.,2017;Albihlal et al.,2018),其中,过表达HSFA2基因可提高植株对高盐、渗透胁迫和高氧化环境的耐受性(Miller and Mittler,2006),而过表达HSFA6a和HSFA6b基因可提高植株对高盐和低温的耐受性(Banti et al.,2010);玉米过表达ZmHSF04基因可提高植株对高盐胁迫的耐受性(Jiang et al.,2017);在拟南芥中过表达百合HsfA3s基因可改变拟南芥植株中脯氨酸的代谢水平以提高植株对高盐胁迫的耐受性(Wu et al.,2018)。可见,HSF在不同植物中具有不同的抗逆能力,特别是参与干旱胁迫响应过程(Wei et al.,2018,Yu et al.,2019)。【本研究切入点】目前,有关木薯HSF基因克隆并探究其在植株干旱胁迫响应及块根PPD中的表达水平研究鲜见报道。【拟解决的关键问题】通过同源克隆方法从木薯叶片克隆HSF基因MeHSF7,对其生物信息学和组织表达特性进行分析,并明确其在干旱和脱落酸(ABA)处理下及PPD过程中的表达模式,为研究MeHSF7基因在响应非生物胁迫及PPD过程中的调控机制提供参考。
1 材料与方法
1. 1 试验材料
供试木薯品种为SC124,由中国热带农业科学院热带生物技术研究所提供。植物RNA提取试剂盒购自天根生化科技(北京)有限公司;反转录试剂盒购自Fermentas公司。PCR引物委托生工生物工程(上海)股份有限公司合成。
1. 2 试验方法
1. 2. 1 材料处理 将木薯茎秆切成长度约15 cm的小节(包含3~4个芽点),将其种植于蛭石和营养土比例为1∶1的基质中。待生长约60 d后,选取生长状况一致的木薯幼苗用于后续试验。干旱处理:采用20% PEG-6000对木薯幼苗进行干旱模拟处理,以正常浇灌水的植株为对照,分别在处理0、3、5和7 d后采集木薯叶片样品,经液氮速冻后置于超低温冰箱保存备用。ABA处理:用100 μmol/L ABA浇灌木薯幼苗,以正常浇灌水的植株为对照,分别在处理0、3、5和7 d后采集木薯叶片,经液氮速冻后置于超低温冰箱保存备用。PPD处理:取生育期10个月的木薯块根,将其中间部分切成5 mm左右的薄片,置于25 ℃、70%相对湿度的培养箱内进行暗培养,分别在0、6、12和48 h时取样,经液氮速冻后置于超低温冰箱保存备用。每个样品设3次生物学重复。
1. 2. 2 基因克隆 以水稻OsHSFA5基因(登录号Os02g29340)编码蛋白氨基酸序列为参考,在Phytozome数据库中进行BLASTp比对,搜索到木薯同源序列(Manes.02G087400.1);再以此为参考序列,使用Primer 5.0设计引物(F:5'-ATGGATGGTTCACAAG GTAGTAGT-3';R:5'-TCATACTCTTTCAGCCGGT GCAAGG-3')。使用RNA提取试剂盒提取木薯叶片RNA,利用反转录试剂盒反转录合成cDNA。以木薯叶片cDNA为模板进行PCR扩增。反应体系20.0 μL: 2×Taq MasterMix 10.0 μL,上、下游引物各1.0 μL,cDNA 1.0 μL,ddH2O補足至20.0 μL。扩增程序:94 ℃预变性5 min; 94 ℃ 30 s,58 ℃ 30 s,72 ℃ 90 s,共进行35个循环; 72 ℃延伸5 min。扩增产物连接至pMD18-T载体,转化大肠杆菌DH5α感受态细胞,并挑选阳性单克隆送至深圳华大基因科技有限公司测序。
1. 2. 3 生物信息学分析 在NCBI数据库中以MeHSF7蛋白氨基酸序列为参考序列进行BLASTp比对,搜索出其他物种同源序列。利用Plant-mPLoc对MeHSF7蛋白进行亚细胞定位;使用NCBI数据库CDD预测其保守结构域;运用ExPASy ProtParam预测其理化性质;采用TMPRED对其跨膜结构域进行预测;利用SWISS-MODEL对其三级结构进行预测。最后,利用DNAMAN对MeHSF7蛋白与其同源蛋白进行氨基酸序列多重比对,并以MEGA 7.0中的邻接法(Neighbor-joining,NJ)构建其系统发育进化树。
1. 2. 4 基因组织表达分析 为分析MeHSF7基因在木薯不同组织中的表达情况,从Bart Lab Cassava Atlas数据库(shiny.danforthcenter.org/cassava_atlas/)中下载得到未经任何处理下10个木薯组织的表达数据(Wilson et al.,2017),分别是叶(Leaf)、中脉(Midvein)、叶柄(Petiole)、茎(Stem)、侧芽(Lateral bud)、块根(Storage root,SR)、须根(Fibrous root,FR)、根顶端分生组织(Root apical meristem,RAM)、分化胚组织(Organized embryogenic structure,OES)和松散性胚性愈伤组织(Friable embryogenic calli,FEC)。基因表达量用FPKM(Fragments per kilobase per million mapped reads)表示。
1. 2. 5 基因表达分析 使用RNA提取试剂盒提取上述样品RNA,构建RNA文库,并送至上海美吉生物医药科技有限公司测序(测序平台为Illumina GAII)。然后,使用FASTX-toolkit和FastQC移除接头序列和低质量序列,利用Tophat 2.0将Clean reads与木薯基因组参考序列进行比对,比对结果使用Cu-fflinks进行组装从而获得转录组数据。基因表达量以FPKM表示。
2 结果与分析
2. 1 MeHSF7基因克隆结果
由图1-A可知,PCR扩增获得的基因片段约1200 bp,与预期结果相符。测序结果(图2)显示,克隆获得的基因片段开放阅读框(ORF)为1206 bp,编码401个氨基酸残基,与参考序列(Manes.02G087 400.1)仅存在2个碱基差异,其中一个为非同义突变,表明该片段即为目的基因MeHSF7。将MeHSF7基因与木薯基因组序列进行比对,结果发现MeHSF7基因位于第2染色体上,含有1个内含子和2个外显子(图1-B)。生物信息学分析结果显示,MeHSF7蛋白的分子式C2025H3134N566O635S15,理论分子量46.1 kD,理论等电点(pI)5.95,不稳定系数61.29,为不稳定蛋白,定位于细胞核,无跨膜区域(图3),含有HSF家族保守结构域(图4),进一步证明克隆得到的基因片段为MeHSF7基因。采用SWISS-MODEL对MeHSF7蛋白进行同源建模,其三级结构如图5所示。
2. 2 MeHSF7蛋白同源性比对及进化分析结果
在NCBI数据库中搜索获得的MeHSF7蛋白同源序列中,同源性最高的是橡胶树(XP_021678492.1)和麻疯树(XP_012070195.1)HSF蛋白,分别为79.20%和64.95%。从中挑选与MeHSF7蛋白同源性较高(47.31%~79.20%)的HSF蛋白序列进行多重序列比对分析,结果(图6)显示均含有HSF蛋白家族的保守结构域,且在N端第8~121位氨基酸残基位置含有高度保守的DBD,在N端第136~185位氨基酸残基位置含有HR-A Core、插入序列和HR-B Core,表明MeHSF7蛋白属于HSFA家族;在C端第204~224位氨基酸残基位置含有NLS。由图7可知,MeHSF7蛋白和橡胶树HSF蛋白聚在同一小分支,表明二者氨基酸序列差异较小,亲缘关系较近。
2. 3 MeHSF7基因组织表达分析结果
由图8可知,未经任何处理下,MeHSF7基因在木薯不同组织中的相对表达量存在明显差异,在松散性胚性愈伤组织、分化胚组织、须根和根顶端分生组织中的表达量相对较高,在叶柄中的相对表达量最低。可见,MeHSF7基因具有明显的组织表达特异性,推测MeHSF7基因在分化程度较低的组织中具有重要的调控功能。
2. 4 MeHSF7基因在不同条件下的表达分析
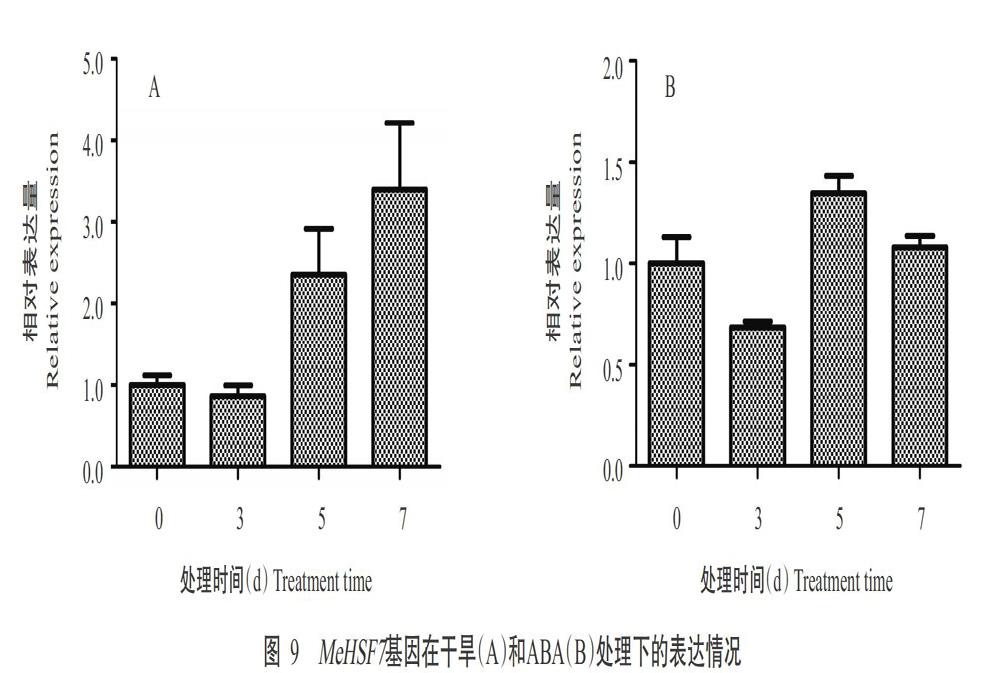
通过对MeHSF7基因启始密码子上游1500 bp的序列进行启动子元件分析,结果(表1)发现启动子区域含有干旱诱导元件(MBS)、ABA响应元件(ABRE)和光响应元件(ACE和Box 4)等。因此,对MeHSF7基因在ABA和干旱处理下的表达水平进行分析,结果显示,在干旱处理下,MeHSF7基因表达量随处理时间的增加整体上呈升高趋势,在处理7 d后达峰值(图9-A);在ABA处理下,处理5和7 d后的MeHSF7基因表达量较处理0和3 d后明显上调,尤其在处理5 d后达峰值(图9-B)。故推测木薯MeHSF7基因通过ABA信号通路响应干旱胁迫。
木薯块根采后1~3 d内易出现PPD现象,对木薯的存储利用产生严重影响。其中,活性氧(Reactive oxygen species,ROS)導致的氧化损伤是木薯采后生理性变质的主要因素之一,而HSF能调控植株响应氧化胁迫。因此,对MeHSF7基因在木薯块根的PPD过程中的表达水平进行分析,结果(图10)显示,MeHSF7基因表达量随暗培养时间增加而升高,处理6、12和48 h的表达量分别是0 h的2.1、2.2和3.2倍,推测MeHSF7基因通过转录水平调控延缓木薯块根的生理性变质。
3 讨论
HSF转录因子广泛存在于植物体内,在响应非生物胁迫过程中发挥重要调控作用,根据其结构特征可将HSF基因家族分为HSFA,HSFB和HSFC亚家族(Guo et al.,2016),且不同植物中的HSF家族成员种类和数量存在明显差异,如拟南芥有21个(Guo et al.,2008),水稻有25个(Mittal et al.,2009),玉米有25个(Lin et al.,2011),小麦有56个(Xue et al.,2014)。已有研究表明,HSF基因在不同物种不同组织中的表达水平均有所不同,如在拟南芥和向日葵中,HSF9基因在种子中特异性表达,而在水稻中HSF基因在所有组织均有表达(Almoguera et al.,2002;Scharf et al.,2012),HSFA2基因在番茄花粉中的表达水平比其他花组织高(Guo et al.,2016)。目前,有关木薯基因组中HSF基因家族成员数量及其克隆研究尚无报道。本研究克隆获得的MeHSF7基因cDNA全长为1206 bp,編码401个氨基酸残基,其编码蛋白序列含有HSF蛋白的保守结构域DBD、HR-A Core和HR-B Core,属于HSFA亚家族(Scharf et al.,2012)。MeHSF7基因在不同木薯组织中的表达水平存在明显差异,在分化程度较低的组织(松散性胚性愈伤组织和分化胚组织)和根相关组织(须根和根顶端分生组织)中表达量较高,在叶柄中的表达水平最低,故推测该基因在木薯块根中发挥作用,间接证实HSF基因的生物学功能具有多样性。
由于植物是固定生长在一个地方,不能像动物一样迁徙,所以其必须适应突然变化的环境。在此适应过程中,HSF是植物应对非生物胁迫重要的调节因子,低温、高盐、干旱及植物激素(ABA、水杨酸和乙烯)等均可调控HSF基因表达(Guo et al.,2016;Ohama et al.,2017)。在拟南芥中过表达AtHSFA2、AtHSFA8和AtHsfA9基因可分别提高植株应对高盐、渗透胁迫和干旱胁迫下的耐受性(Guo et al.,2008);水稻过表达OsHSF17和OsHSF29基因能提高植株对高盐和高渗透胁迫的耐受性(Jin et al.,2013)。此外,HSF可调控植物应对氧化胁迫的能力。如水稻中OsHsfC2a和OsHsfA5蛋白可感知ROS的存在及积累含量变化,当ROS增加时会诱导其基因表达(Miller et al.,2008;Mittal et al.,2009);拟南芥中过表达HsfA1b基因能直接提高植株中抗坏血酸过氧化物酶基因APX1和APX2的表达量(Albihlal et al.,2018);在烟草植株中过表达胡杨PeHSF基因可调节叶片中的ROS平衡(Shen et al.,2013)。本研究结果与上述的研究结果基本一致。本研究还发现,MeHSF7基因启动子序列含有干旱诱导元件(MBS)和ABA响应元件(ABRE)等,在干旱和ABA处理下,MeHSF7基因的表达水平整体上呈上升趋势,推测木薯MeHSF7基因通过ABA信号通路响应干旱胁迫,以提高植株的耐干旱能力,但具体是哪些基因参与MeHSF7介导的分子调控机制尚不清楚。此外,MeHSF7基因在木薯PPD过程中的表达量也明显升高,说明该基因响应木薯块根的生理性变质,但具体响应机制尚未明确。因此,今后应深入研究MeHSF7基因在木薯抗旱和延缓生理性变质中的调控机制。
4 结论
MeHSF7基因可能在转录水平通过依赖于ABA信号通路的途径来响应干旱胁迫及木薯块根的氧化胁迫,可作为候选基因用于研究其在木薯抗逆和采后储存中的调控功能。
参考文献:
马秋香,许佳,乔爱民,张鹏. 2009. 木薯储藏根采后生理性变质研究进展[J]. 热带亚热带植物学报,17(3):309-314. [Ma Q X,Xu J,Qiao A M,Zhang P. 2009. Current pro-gress in studies on post-harvest physiological deterioration of cassava storage roots[J]. Journal of Tropical and Subtropical Botany,17(3):309-314.]
胡广,梁大成. 2019. 木薯NOX基因家族成员的生物信息学及其表达分析[J]. 南方农业学报,50(10):2178-2187. [Hu G,Liang D C. 2019. Bioinformatics of cassava NOX gene family and its expression analysis[J]. Journal of Southern Agriculture,50(10):2178-2187.]
韦祖生,杨秀娟,付海天,田益农. 2017. 木薯种子体细胞胚诱导发生及植株再生体系建立[J]. 南方农业学报,48(12):2129-2135. [Wei Z S,Yang X J,Fu H T,Tian Y N. 2017. Induction of somatic embryogensis and plant regeneration system in cassava seed[J]. Journal of Sou-thern Agriculture,48(12):2129-2135.]
张鹏,杨俊,周文智,王红霞,马秋香. 2014. 能源木薯高淀粉抗逆分子育种研究进展与展望[J]. 生命科学,26(5):465-473. [Zhang P,Yang J,Zhou W Z,Wang H X,Ma Q X. 2014. Progress and perspective of cassava molecular breeding for bioenergy development[J]. Chinese Bu-lletin of Life Sciences,26(5):465-473.]
張振文,李开绵. 2012. 木薯块根采后腐烂及贮藏方法研究进展[J]. 热带作物学报,33(7):1326-1331. [Zhang Z W,Li K M. 2012. Review on postharvest deterioration and methods of storage for cassava tuberous root[J]. Chinese Journal of Tropical Crops,33(7):1326-1331.]
Albihlal W S,Irabonosi O,Blein T,Persad R,Chernukhin I,Crespi M,Bechtold U,Mullineaux P M. 2018. Arabidopsis heat shock transcription factor A1b regulates multiple developmental genes under benign and stress conditions[J]. Journal of Experimental Botany,69(11):2847-2862.
Almoguera C,Rojas A,Diaz-Martin J,Prieto-Dapena P,Carranco R,Jordano J. 2002. A seed-specific heat-shock transcription factor involved in developmental regulation du-ring embryogenesis in sunflower[J]. Journal of Biological Chemistry,277(46):43866-43872.
Banti V,Mafessoni F,Loreti E,Alpi A,Perata P. 2010. The heat-inducible transcription factor HsfA2 enhances anoxia tolerance in Arabidopsis[J]. Plant Physiology,152(3):1471-1483.
Bartels D,Sunkar R. 2005. Drought and salt tolerance in plants[J]. Critical Reviews in Plant Sciences,24(1):23-58.
Guo J K,Wu J,Ji Q,Wang C,Luo L,Yuan Y,Wang Y H,Wang J. 2008. Genome-wide analysis of heat shock transcription factor families in rice and Arabidopsis[J]. Journal of Genetics and Genomics,35(2):105-118.
Guo M,Liu J H,Ma X,Luo D X,Gong Z H,Lu M H. 2016. The plant heat stress transcription factors(HSFs):Structure,regulation,and function in response to abiotic stresses[J]. Frontiers in Plant Science,7:114.doi: 10.3389/fpls. 2016.00114.
Hu W,Kong H,Guo Y L,Zhang Y L,Ding Z H,Tie W W,Yan Y,Huang Q X,Peng M,Shi H T. 2016. Comparative physiological and transcriptomic analyses reveal the actions of melatonin in the delay of postharvest physiological deterioration of cassava[J]. Frontiers in Plant Science,7:736. https://doi.org/10.3389/fpls.2016.00736.
Jiang Y L,Zheng Q Q,Chen L,Liang Y,Wu J D. 2017. Ectopic overexpression of maize heat shock transcription factor gene ZmHsf04 confers increased thermo and salt-stress tolerance in transgenic Arabidopsis[J]. Acta Phy-siologiae Plantarum,40(1):1-12.
Jin G H,Gho H J,Jung K H. 2013. A systematic view of rice heat shock transcription factor family using phylogenomic analysis[J]. Journal of Plant Physiology,170(3):321-329.
Li F,Zhang H R,Zhao H S,Gao T W,Song A P,Jiang J F,Chen F,Chen S M. 2018. Chrysanthemum CmHSFA4 gene positively regulates salt stress tolerance in transgenic chrysanthemum[J]. Plant Biotechnology Journal,16(7):1311-1321.
Lin Y X,Jiang H Y,Chu Z X,Tang X L,Zhu S W,Cheng B J. 2011. Genome-wide identification,classification and analysis of heat shock transcription factor family in maize[J]. BMC Genomics. doi: 10.1186/1471-2164-12-76.
Miller G,Mittler R. 2006. Could heat shock transcription factors function as hydrogen peroxide sensors in plants? [J]. Annals of Botanty,98(2):279-288.
Miller G,Shulaev V,Mittler R. 2008. Reactive oxygen signa-ling and abiotic stress[J]. Physiologia Planarum,133(3):481-489.
Mittal D,Chakrabarti S,Sarkar A,Singh A,Grover A. 2009. Heat shock factor gene family in rice:Genomic organization and transcript expression profiling in response to high temperature,low temperature and oxidative stresses[J]. Plant Physiology and Biochemistry,47(9):785-795.
Ohama N,Sato H,Shinozaki K,Yamaguchi-Shinozaki K. 2017. Transcriptional regulatory network of plant heat stress response[J]. Trends in Plant Science,22(1):53-65.
Oliveira E J,Santana F A,Oliveira L A,Santos V S. 2014. Genetic parameters and prediction of genotypic values for root quality traits in cassava using REML/BLUP[J]. Genetics and Molecular Research,13(3):6683-6700.
Salcedo A,Siritunga D. 2011. Insights into the physiological,biochemical and molecular basis of postharvest deterioration in cassava(Manihot esculenta) roots[J]. American Journal of Experimental Agriculture,1(4):414-431.
Scharf K D,Berberich T,Ebersberger I,Nover L. 2012. The plant heat stress transcription factor (Hsf) family:Structure,function and evolution[J]. Biochimica Et Biophysica Acta-Gene Regulatory Mechanisms,1819(2):104-119.
Shen Z D,Ding M Q,Jian S,Deng S R,Zhao R,Wang M J,Ma X J,Wang F F,Zhang H L,Qian Z Y,Hu Y,Yu R,Shen X,Chen S L. 2013. Overexpression of PeHSF mediates leaf ROS homeostasis in transgenic tobacco lines grown under salt stress conditions[J]. Plant Cell Tissue & Organ Culture,115(3):299-308.
Shim D,Hwang J U,Lee J,Lee S,Choi Y,An G,Martinoia E,Lee Y. 2009. Orthologs of the class A4 heat shock transcription factor HsfA4a confer cadmium tolerance in wheat and rice[J]. The Plant Cell,21(12):4031-4043.
Wei Y X,Liu G Y,Chang Y L,He C Z,Shi H T. 2018. Heat shock transcription factor 3 regulates plant immune response through modulation of salicylic acid accumulation and signaling in cassava[J]. Molecular Plant Pathology,19(10):2209-2220.
Wilson M C,MutkaA M,Hummel A W,Berry J,Chauhan R D,Vijayaraghavan A,Taylor N J,Voytas D F,Chitwood D H,Bart R S. 2017. Gene expression atlas for the food security crop cassava[J]. New Phytologist,213(4):1632-1641.
Wu Z,Liang J H,Wang C P,Zhao X,Zhong X H,Cao X,Li G Q,He J N,Yi M F. 2018. Overexpression of two no-vel HsfA3s from Lily in Arabidopsis confer increased thermotolerance and salt sensitivity via alterations in proline catabolism[J]. Journal of Experimental Botany,69(8):2005-2021.
Xue G P,Sadat S,Drenth J,McIntyre C L. 2014. The heat shock factor family from Triticum aestivum in response to heat and other major abiotic stresses and their role in regulation of heat shock protein genes[J]. Journal of Experimental Botany,65(2):539-557.
Yu X Y,Yao Y,Hong Y H,Hou P Y,Li C X,Xia Z Q,Geng M T,Chen Y H. 2019. Differential expression of the Hsf family in cassava under biotic and abiotic stresses[J]. Genome,62(8):563-569.
Zhou J,Xu X C,Cao J J,Yin L L,Xia X J,Shi K,Zhou Y H,Yu J Q. 2018. HsfA1a is essential for Mi-1.2-mediated resistance to Meloidogyne incognita,and regulates Wfi1 transcription and H2O2 production[J]. Plant Physiology,176(3):2456-2471.
(責任编辑 陈 燕)

