茶多酚对脂多糖诱导的人脐静脉内皮细胞中MCP-1、IL-6表达水平的影响
高 丽,许 伟,李 萍,杨 琨,宋 琦
(1.遵义医科大学附属口腔医院 牙周科,贵州 遵义 563099;2.遵义医科大学附属口腔医院 病理科,贵州 遵义 563099)
牙周病原微生物可通过多种途径影响血管内皮细胞(Vascular endothelial cell,VEC)的功能,在牙周病与心血管疾病的相关性研究中占有核心地位。牙龈卟啉单胞菌(Porphyrom onas gingivalis,P.g)是红色复合体的重要成员之一,被认为是证据充分的高致病性牙周病原菌,在动脉粥样硬化(Atherosclerosis,AS)的发生发展过程中起着至关重要的作用[1]。
P.g可产生大量破坏宿主组织的毒力因子,对细菌的毒性起到了决定性作用,其中LPS是P.g众多毒力因子中最为重要的一种因子[2]。
P.g可以侵入各种类型的内皮细胞,包括HUVEC、人主动脉内皮细胞(Human aortic endothelial cells,HAEC)、心脏内皮细胞[3],导致细胞粘附分子表达的增加,并通过诱发宿主免疫反应促进炎症介质(IL-6、MCP-1)的产生[4],从而引起内皮细胞损伤及功能障碍,这可能是牙周炎与心血管疾病相关联系的机制之一。由于内皮细胞是动脉粥样硬化过程中受影响的主要细胞之一,因此它们已广泛用作体外模型系统,以鉴定牙龈卟啉单胞菌的潜在毒力机制。近年来,由于TP对癌症和其它多种疾病(糖尿病、心血管疾病、神经系统疾病等)具有多重保护作用而成为研究的重点[5]。TP与牙周疾病的相关研究认为,TP具有一定的抗菌特性,其可抑制中间普氏菌、P.g、伴放线放线杆菌及具核梭杆菌等多种牙周重要致病菌的生长[6]。
本研究通过不同浓度的TP干预牙龈卟啉单胞菌脂多糖(Pg-LPS)诱导的HUVEC炎症反应模型,讨论TP对Pg-LPS诱导的VEC中MCP-1、IL-6表达水平的影响,初步分析TP对VEC的调节和保护作用,以期为牙周病及心血管疾病的防治,开发新型抗心血管疾病药物提供新的思路和依据。
1 材料与方法
1.1 主要试剂和仪器 TP(纯度≥98%),中国陆圣康源公司;Pg-LPS(美国InvivoGen公司);胎牛血清(美国Hyclone公司);单道可调式移液器(德国Eppendorf公司);全波段酶标检测仪(1500,美国Thermo公司);倒置显微镜(TMS-1015,日本OLYMPUS公司);电泳仪(美国BIO-RAD公司);凝胶图像分析系统(美国BIO-RAD公司);荧光倒置显微镜(DP50,日本OLYMPUS公司);IL-6、MCP-1酶联免疫试剂盒(伊莱瑞特生物有限公司);IL-6、MCP-1单克隆抗体(Cell Signaling Technoiogy,英国);兔抗人VIII因子抗体(博士德,中国),蛋白marker(Thermo,立陶宛)。
1.2 方法
1.2.1 人脐静脉内皮细胞培养及鉴定 本研究获遵义医科大学附属医院伦理委员会批准,收集产科健康产妇正常足月剖宫产脐带组织(产妇均知情同意)。严格按照无菌操作技术,取长度约0.2 m的新生儿脐带,放入预冷至4℃的无菌冻存管中(含双抗的PBS buffer),迅速转移至实验室,进行HUVEC的分离培养;无菌盒内,用无菌PBS反复冲洗静脉至流出液清亮无色为止,分离脐静脉,酶消化法收集细胞,于37 ℃、5%CO2、饱和适度培养箱中培养细胞,待细胞铺满瓶底80%~90%后,加入37 ℃预热的0.25%胰蛋白酶1 mL,37 ℃、5% CO2、100%湿度培养箱中消化1~2 min,按1∶2进行传代。取3~4代对数生长期细胞用于实验。采用DAB法进行Ⅷ因子相关抗原免疫组化鉴定细胞来源。
1.2.2 HUVEC的分组与处理 选择生长状态良好的第四代HUVEC,用1mL浓度为0.25%的胰蛋白酶(Trypsin)消化20 min,制成2×105/mL浓度的细胞悬液,接种于6孔板中,每孔2 mL,置于37 ℃、体积分数为5% CO2及饱和湿度培养箱中培养。当细胞生长至铺满板底80%时,PBS洗3次,每次1 min,吸尽残留PBS;按阴性对照组(Control)、阳性对照组(LPS)、LPS+TP1组、LPS+TP2组分组,每组设3个复孔;LPS+TP1组加入5 mg/LTP培养液,LPS+TP2组加入40 mg/LTP培养液,其余组更换原培养液,放入37 ℃、体积分数为5% CO2及饱和湿度培养箱中孵育12 h后,去除培养液,用PBS缓冲液冲洗3遍,Control组更换原培养液,另外3组加入Pg-LPS培养液(10 mg/mL),孵育1d,建立实验模型。
1.2.3 TP对Pg-LPS诱导的HUVEC中炎症因子表达水平的影响
1.2.3.1 ELISA法检测L-6和MCP-1蛋白含量 ①将低温保存的各组细胞培养上清液(-80 ℃冰箱)及ELISA检测试剂盒(4 ℃冰箱)取出,静置0.5 h,平衡至室温。②建立标准孔:将标准品加入0.5 mL蒸馏水混均,配制成2 000 pg/mL 的溶液,采用倍比稀释法,使最终获得MCP-1的浓度分别为240、160、80、40、20 ng/L,IL-6的浓度分别为6、4、2、1、0.5 ng/L。③蛋白测定:每孔加入待测样品10 μL,将反应板充分混均,封板,37 ℃ 孵育120 min,洗板;加入100 μL 第一抗体工作液,混均,37 ℃孵育30 min,洗涤。加入50 μL 稀释好的酶标抗体,混均,37 ℃ 孵育30 min,洗涤。加入50 μL 新鲜配制的底物工作液;加入50 μL 反应终止液,混均。15 min之内用酶标仪在450 nm 波长处读取各孔光密度值(Optical density,OD)。
1.2.3.2 Western blot法检测IL-6 和MCP-1的蛋白表达水平 按1.2.2实验组分组,各实验组用细胞刮收集细胞,加入100 μL浆蛋白抽提试剂(PMSF终浓度为1 mM),转移至预冷的的离心管,涡旋混匀,冰浴15 min,12 000 g、4 ℃离心10 min,提取浆蛋白保存备用;将50~100 μL核蛋白抽提试剂(PMSF终浓度为1 mM)加入沉淀,涡旋混匀,冰浴15 min,12 000 g、4 ℃离心10 min,吸取核蛋白保存备用;所有蛋白样品分别经SDS-PAGE电泳、转膜、封闭后,分别加入羊抗兔IL-6 和MCP-1单克隆抗体,比例分别为1∶1 000和1∶800,4 ℃摇床孵育过夜;于摇床上先用TBST洗膜2次,每次10 min,滴加羊抗兔IgG二抗,比例为1∶20 000,37 ℃摇床孵育60 min;TBST洗膜,ECL试剂盒显影,晾干胶片,图片扫描,保存;运用AlphaEaseFC软件检测蛋白灰度值。
1.3 统计学处理 采用 SPSS16.0进行数据分析,符合正态分布的计量资料,两组数据比较采用Student's T-test检验,多个样本均数比较用One-Way ANOVA分析,组间两两比较则用LSD-t检验。以α=0.05 为检验水准。
2 结果
2.1 HUVEC的分离与鉴定 在倒置显微镜下观察以酶消化法分离培养的HUVEC,发现细胞接种后生长迅速,贴壁生长,3~5 d即可融合成片,表现为铺路石样镶嵌排列的单层生长(见图1)。细胞形态呈梭形或多角形,边界清楚,中间突起的部分,可见圆形或椭圆形细胞核,核仁1~2个。VEC的Ⅷ因子相关抗原抗体通过免疫荧光将细胞鉴定为HUVEC(见图2)。
图1 HUVEC光镜下形态(×100)
图2 Ⅷ因子相关抗原免疫荧光染色(×200)
2.2 HUVEC 培养液中的L-6、MCP-1含量 应用ELISA试剂盒进行检测发现,IL-6、MCP-1的蛋白含量水平在4组间的差异显著(P<0.05)。HUVEC 中IL-6、MCP-1的分泌明显受到LPS影响(P<0.05),TP预刺激后显著抑制了LPS刺激HUVEC分泌IL-6、MCP-1的表达水平(P<0.05),且高浓度TP预刺激组(LPS+TP2:40 mg/L)较低浓度预刺激组(LPS+TP1:5 mg/L)抑制效果更为显著(P<0.05,见表1)。

表1 酶联免疫吸附测定法检测IL-6、MCP-1的含量
2.3 HUVEC内IL-6、MCP-1的蛋白表达 IL-6、MCP-1的蛋白表达水平在组间比较均有明显差异(P<0.05)。LPS组、LPS+TP1组、LPS+TP2组的IL-6、MCP-1的蛋白表达量较阴性对照组高,差异具有统计学意义(P<0.05),而TP预刺激HUVEC 后,随着TP浓度的增加,LPS诱导的细胞IL-6、MCP-1蛋白表达水平降低,差异具有统计学意义(P<0.05,见表2,图3)。
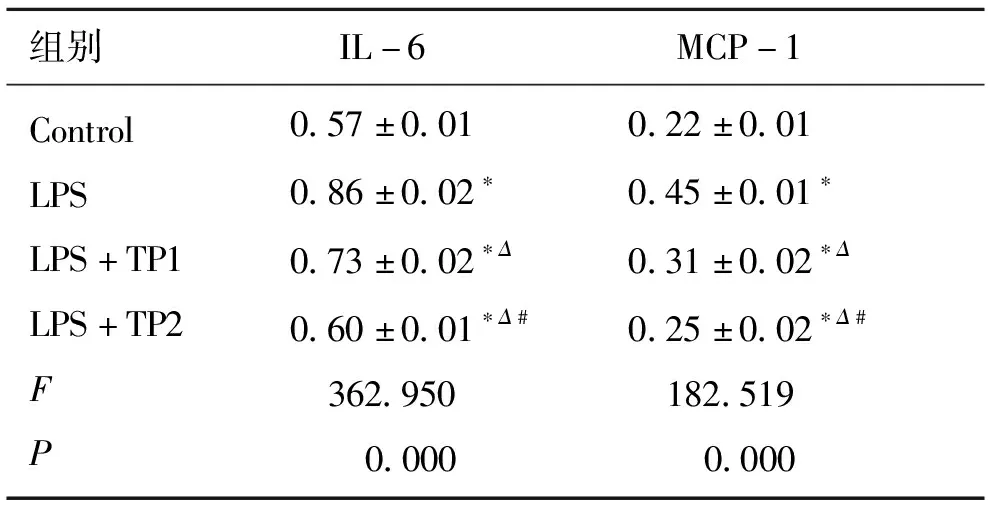
表2 蛋白质印迹法检测HUVEC 中IL-6、MCP-1蛋白表达水平(n=3)
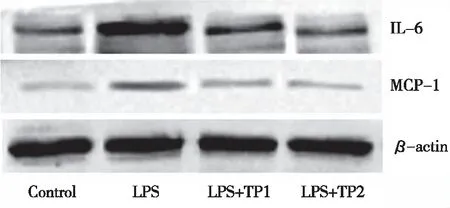
图3 人脐静脉内皮细胞IL-6、MCP-1蛋白表达水平
3 讨论
随着牙周医学的发展,牙周疾病与全身系统性疾病(癌症、心血管疾病、糖尿病等)的相关研究日益受到重视,而茶及其提取物TP通过研究认为可以减少罹患心血管疾病和癌症的风险,成为近年来研究的热点[9]。在治疗心血管疾病中,TP可通过调节各种信号传导途径表现出抗炎、抗氧化和抑制血管内皮细胞功能障碍的作用[10]。相比于抗心血管疾病药物,茶容易获取且价格便宜,被认为是控制和管理心血管疾病的有效方法。然而,TP具有多种生物学和药理学特性,其对心血管疾病的作用机制尚不完全明确。
大量临床研究发现,伴放线聚集杆菌和P.g等牙周主要致病菌可导致外周血中促炎细胞因子水平升高,其中包括与AS发病相关的IL-6、MCP-1等关键炎性标志物,炎性介质的高表达也增加了系统性炎症和感染的风险[11]。Li等研究表明,LPS通过p44/42和p38 MAPK信号通路介导增强VEC释放IL-6[12],并可刺激VEC分泌MCP-1(也称趋化因子配体2),增强单核细胞的迁移能力并黏附至血管内皮表面[13]。
Cai等[14]研究发现,体外实验用Pg-LPS刺激小鼠单核巨噬细胞白血病细胞(RAW 264.7),可提高IL-6及TNF-α的分泌水平,Pg-LPS刺激Apo E基因敲除(Apo E-/-)小鼠,可促进MCP-1、sICAM-1的表达增加。我们的实验结果显示:IL-6、MCP-1表达水平在阳性对照组(LPS)HUVEC内明显上调(P<0.05),且细胞外MCP-1、IL-6的变化趋势与之相同,蛋白含量水平也相应上调。这反映了VEC可受到Pg-LPS的影响,导致促炎介质的表达增加,诱发机体局部炎症反应和系统炎症反应,促进AS的进展。
研究表明,不同浓度的TP,随着剂量的增加,能依赖性地降低P.g诱导的口腔上皮细胞IL-6的表达水平[15]。TP中的活性物质EGCG可抑制P.g诱导的小鼠牙龈组织中TNF-α、IL-6、IL-17和IL-1β等细胞炎性因子的表达水平[16]。EGCG还可浓度依赖性的降低TNF-α诱导的MCP-1信使RNA及蛋白的表达水平,同时抑制单核细胞的黏附功能[17]。本实验结果显示:加入不同浓度TP(5、40 mg/L)预刺激HUVEC后,TP明显抑制 Pg-LPS诱导的HUVEC的MCP-1、IL-6释放及细胞内MCP-1、IL-6蛋白的表达水平。这些数据表明,TP能有效下调HUVEC炎性因子MCP-1、IL-6表达水平,降低细胞炎性损伤,对Pg-LPS诱导的内皮功能障碍具有保护作用。MCP-1及IL-6是引发心血管疾病的重要炎症标志物,TP展现出对其显著的抑制作用,使TP可能成为潜在的防治心血管疾病及牙周病的有效药物。
综上所述,本研究发现,TP可抑制Pg-LPS诱导的内皮细胞MCP-1、IL-6的表达水平,对VEC具有一定的保护作用,为今后TP的药理作用及心血管疾病和牙周病防治的研究提供了一定的参考。但遗憾的是,本实验研究是建立在体外细胞实验模型上,没有对体内生理状态下TP的作用进行分析,TP在机体内是否具有同样的功效还需要更多的研究阐明。

