急性盐度胁迫对细鳞幼鱼存活及摄饵的影响
吴 勇,施 钢,谢又兴,陈志光,潘传豪*
(1.广东海洋大学,广东 湛江 524088;2.湛江市合兴水产科技有限公司,广东 湛江 524000)
1 材料方法
1.1 材料
本实验在广东海洋大学东海岛海洋生物教学基地室内进行,实验用细鳞幼鱼捕自湛江市海区,平均体长为(2.48±0.23)cm,平均体质量(0.92±0.31)g。
高盐度调节用盐(徐闻县海龙海洋生物制剂厂制作的“海龙牌”海水晶),东海岛海区自然砂滤海水及曝气24 h以上的自来水,ATAGO-S20折射式盐度计。
以1 m3玻璃钢圆桶为自然砂滤海水储水桶,250 L的白色聚丙烯方形桶(长×宽×高=70 cm×50 cm×70 cm,以下简称方形桶)为实验用桶,实验前1 d以300 mg·L-1KMnO4消毒后用淡水洗净。
1.2 方法
1.2.1 各梯度海水的配制
分别设置0、5、10、20、30、40、50、55、60和65共10个盐度梯度,以盐度30的自然海水为对照组,高盐度海水通过砂滤海水+经过滤的海水晶配制成一份母液后,曝气2 h后再等分成3份,最后再分别分装入另外2个方形桶中而获得,以此确保3个重复盐度相一致;低盐度海水由自然砂滤海水+曝气24 h以上的自来水调配成一份母液后,曝气2 h后再等分成3份,最后再分别分装入另外2个方形桶中而获得;盐度为0的为曝气24 h以上的自来水。调配好后贴上标签注明盐度,每个方形桶盛水50 L。
1.2.2 盐度骤变实验
为初步确定最高浓度,预实验设置了盐度为65、75、80的高盐度海水梯度,每个处理组放10尾鱼,结果表明盐度75和80的细鳞幼鱼1 h内存活率为0%,盐度65的细鳞幼鱼2 h内存活率40%,初步确定盐度65为本次盐度胁迫实验最高盐度。
1.2.3 盐度恢复实验
1.2.4 吸水率和脱水率的计算
脱水率(The dehydration rate,%):DHR=(We-WO) ×100/ WO;
吸水率(The water absorption rate,%):WAR=(We-WO) ×100/ WO;
其中,We为实验终末体质量(g);WO为相应的初始体质量(g)。
1.2.5 数据处理
实验数据处理采用Microsoft Excel 2003和SPSS 19.0进行统计分析,用完全随机设计的单因素方差分析(One-way ANOVA)进行分析(成活率数据经反正弦变换后进行ANOVA处理),当其达到显著差异(P<0.05),进行Duncan多重比较检验组间差异,找出存活时间和成活率有统计差异的组别[12]。
2 结果
2.1 存活时间和存活率
表1 细鳞幼鱼盐度骤变实验中存活时间统计表
Tab.1 Surviving time span and surviving rates of Terapon jarbua in acute salinity stress experiment
盐度Salinity24h存活率/%Survivingratesin24h48h存活率/%Survivingratesin48h72h存活率/%Survivingratesin72h恢复实验存活率/%Survivingratesinrecoveryexperiment总存活率/%Totalsurvivingrates最短存活时间/hMinimalsurvivingtimespan最长存活时间/hMaximalsurvivingtimespan平均存活时间/hMeansurvivingtimespan650.0a0.0a0.0a-00.973.751.88A6030.0b23.3b23.3b23.323.31.18>72>72B5556.7c53.3c53.3c53.353.31.78>72>72B5093.3d93.3d93.3d93.393.33.83>72>72B40100.0d100.0d100.0d100.0100.0>72>72>72B30100.0d100.0d100.0d100.0100.0>72>72>72B20100.0d100.0d100.0d100.0100.0>72>72>72B10100.0d100.0d100.0d100.0100.0>72>72>72B5100.0d100.0d100.0d100.0100.0>72>72>72B090.0d90.0d90.0d90.081.09.8>72>72B
注:同一列数据相同字母者表示差异不显著(P>0.05),反之差异显著;“-”表示数据未测定或无。下同。
Notes:Labeling identical letters on data in the same column showed no significant differences(P>0.05),otherwise significant difference(P<0.05);“-”indicated the data was not measured or no.Similarly hereinafter.
方差齐性检验表明,各处理组存活时间方差不齐,使用Tamhane多重比较,结果表明盐度为65处理组的平均存活时间与其他处理组的平均存活时间有极显著差异,此处理组的平均存活时间ASTS65(1.88 h)<其他处理组的ASTS(>72 h),说明细鳞幼鱼在盐度为65、60、55的海水中的存活时间显著低于其他盐度组的存活时间。
对存活率作反正弦变换后进行单因素方差分析,结果表明,盐度65、60、55处理组存活率分别与其他处理组之间(The survival rate,以下简称TSR)存在显著差异,P<0.05(表1、图1)。
LSD多重比较表明,TSR65、TSR60、TSR50、TSR0的存活率显著低于其他处理组的存活率,其中TSR65与TSR60之间无统计学差异而与其他两组有显著差异,TSR50与TSR0之间无统计学差异而与其他两组有显著差异。
2.2 盐度胁迫下的细鳞行为表现
2.3 摄食情况
实验进行24 h后,全部梯度存活下来的鱼投喂沉性配合饲料后摄食强烈、快速抢食,与实验前暂养时的摄食情况基本相同,本实验的盐度胁迫对存活下来的细鳞幼鱼摄食情况无明显的差异。
2.4 吸水率和脱水率
方差分析结果表明,盐度为65和60的极高盐度处理组与盐度为5和0的极低盐度处理组对全鱼脱水率的影响具有显著差异(P<0.05),盐度5组与盐度0组具有显著性差异(P<0.05),盐度65组与盐度60组无显著性差异(P>0.05)(表2)。
表2 细鳞幼鱼盐度骤变实验中吸水率与脱水率变化统计表
Tab.2 The water absorption rate and the dehydration rate of Terapon jarbua in acute salinity stress experiment %
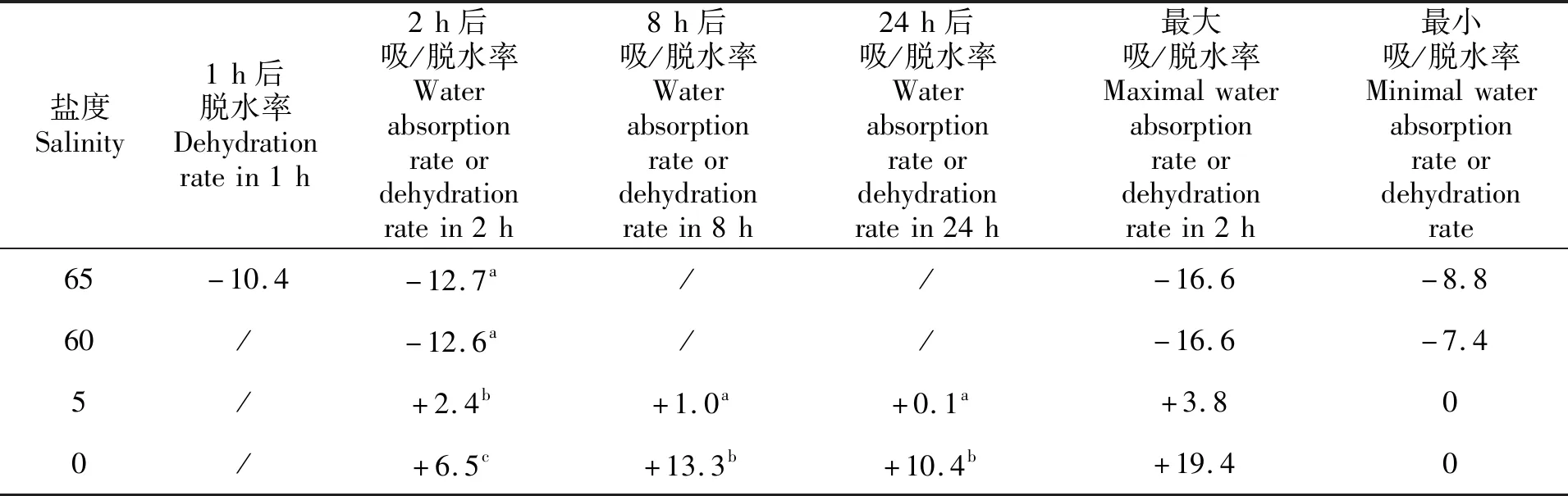
表2 细鳞幼鱼盐度骤变实验中吸水率与脱水率变化统计表
盐度Salinity1h后脱水率Dehydrationratein1h2h后吸/脱水率Waterabsorptionrateordehydrationratein2h8h后吸/脱水率Waterabsorptionrateordehydrationratein8h24h后吸/脱水率Waterabsorptionrateordehydrationratein24h最大吸/脱水率Maximalwaterabsorptionrateordehydrationratein2h最小吸/脱水率Minimalwaterabsorptionrateordehydrationrate65-10.4-12.7a//-16.6-8.860/-12.6a//-16.6-7.45/+2.4b+1.0a+0.1a+3.800/+6.5c+13.3b+10.4b+19.40
注: 数据前标“-”的表示脱水,数据前标“+”表示吸水,“/”表示数据未测定或无。
Notes:“-10.4”indicated dehydration rate 10.4%,“+2.4”indicated water absorption 2.4%,“/”indicated the data was not measured or no.
盐度实验2 h后高盐度组出现明显脱水,低盐度组出现明显吸水,24 h后盐度5组比仍然存活的0、60组更能自主调节吸水率或者脱水率使体质量回归正常值,可见在盐度5的低盐组,细鳞幼鱼渗透压调节适应能力高于60的高盐组,也强于盐度为0的低盐组。
3 讨论
3.1 细鳞的盐度急性盐度胁迫下的可能机制及其调节极限
鱼类生存环境中的盐度与鱼体内渗透压有密切关系,溶解于水中的各种盐类,通过渗透压对鱼体产生影响,鱼类对盐度变化的耐受性取决于其渗透压调节能力以及与提供能量支持有关的代谢重组[13]。鱼类生活水域的盐度差异甚大,各种鱼类能够在不同盐度的水域中正常生活,与其具有完善的生理调节机制有关,但这种调节作用只能局限于一定的盐度范围内,在不适宜的盐度范围内,鱼类即使能够生存,也不能正常生长。海水硬骨鱼类体液盐分浓度即渗透压一般比海水低,属于低渗性溶液,对渗透压的调节主要通过“饮海水,排盐分”的方式进行。海水硬骨鱼类主要依靠鳃对盐分进行渗透压调节[14],且主要是依靠鳃上皮细胞中为数不多的氯细胞[15]。首先,可从食物中获得少量水分,更多的是吞入大量海水,大量的NaCl由腮丝上的泌氯细胞排出;其次,退化的肾小球可阻止因排泄废物失水过多,而只排出Mg2+、SO42-、Ca2+及少量的水分[16]。细鳞属于广盐性硬骨鱼类,对外界渗透压的变化有一定的调节能力,但当盐度变化超过一定的范围时,在细鳞急性盐度胁迫中表现为低盐度为5以下、高盐度为50以上产生明显的吸水和脱水现象,此时已经超过此鱼类的内部调节能力,会有吸水、脱水甚至死亡等巨大的生理影响。
侯俊利等[17]的研究表明,鱼类通过改变鳃表皮细胞中的扁平细胞和泌氯细胞的数量和形态来适应生存环境中盐度的变化,在盐度为10的海水中驯养的施氏鲟(Acipenserschrenckii)幼鱼鳃小片上的泌氯细胞较在淡水中驯养的大。据王艳等[18]对不同盐度下鲈鱼(Lateolabraxjaponicus)稚鱼鳃显微结构的研究表明,盐度为15的稚鱼鳃丝和鳃小片较窄且短,其上的泌氯细胞数量较多,体积显著膨大;盐度为7.5稚鱼腮丝和鳃小片上的泌氯细胞数量、结构变化不明显;而盐度为0稚鱼鳃丝和鳃小片宽,间距小,其上的泌氯细胞数量较少,胞体较小,核较大,以此通过泌氯细胞的结构和数量变化来调节体内渗透压以适应生存环境的改变。马慧等[19]的研究表明多种内分泌激素如催乳素、生长激素、胰岛素样因子及皮质醇等通过刺激新的转运蛋白合成,影响氯细胞增值与分化,改变离子与水的运输能力。稍低或稍高的盐度(如盐度20~40)胁迫对鱼类组织的影响或损伤可能较小,鱼类能通过自身的调节机制或通过修复可逐步适应环境的改变。例如,在河口半咸水地区生活的鲻鱼(Mugilcephalus)和鱼(Planilizahaematocheila),若从海水立即投入淡水中则会很快死亡,而在其生活的水体中逐渐加入淡水,直至养殖水体完全或大部分淡化,这个过程仅仅需要一两个小时,它们便可以完全适应淡水生活[20]。而极端盐度(如盐度≥60或盐度≤5)胁迫可能会对鱼类的鳃部等组织结构造成不可逆的影响,带来严重且不可修复的损伤。本实验也表明,细鳞幼鱼在盐度为65的极端高盐度胁迫下,在3.75 h内全部死亡,最短死亡时间为0.97,平均死亡时间仅为1.88 h;在盐度为60下的幼鱼24 h死亡率也高达70%,最短死亡时间也仅为1.18 h。盐度为0的幼鱼24 h死亡率为10%,最短死亡时间为9.80 h,显著长于盐度为65和60的极端高盐度下的存活时间,但在盐度恢复实验24 h内死亡率增加到20%,这可能说明极高盐度对鱼鳃部组织的损伤程度大于极低盐度对鳃部组织的损伤程度,高盐度导致鳃小片上的扁平细胞变薄,且极高盐度还可能致使鳃上某些酶活力降低或失活,甚至直接导致某些运载蛋白的变性。
环境胁迫打破鱼类与环境之间的平衡与协调,引起鱼体内分泌等生理状态的紊乱[21]。当盐度胁迫可导致鱼类去甲肾上腺素分泌的增加,当这种胁迫加重或持续时间过长超出了鱼体的调节和免疫应答应对能力时,会造成鱼体体内各种生理生化指标的变化,出现行为异常甚至死亡[22]。Cannon应急反应学说(Emergency Reaction Hypothesis)认为,当机体遭受特殊紧急情况时,如盐度突变,会使交感-肾上腺髓质系统反应立即被调动起来,肾上腺素与去甲肾上腺素分泌大大增加,它们作用于中枢神经系统,提高兴奋性,使机体处于警觉状态[22],表现为反应灵敏、呼吸加强加快、心跳加快、糖原分解代谢加快等以利于应急时的氧气及能量供给,本实验的细鳞幼鱼呼吸频率达160次/min以上即是其中的外在生理反应。而童燕等[23]研究表明,急性盐度胁迫导致施氏鲟血浆皮质醇浓度显著升高,盐度15的皮质醇在5 h时达到峰值,而盐度为22的在0.5 h时达到峰值。皮质醇能刺激鱼类鳃上皮氯细胞密度增加,增强鳃内Na+/K+-ATPase活性,促使过多的盐分排出体外[24]。本实验的细鳞幼鱼生理和激素变化是否遵循此规律有待进一步研究。
一般海区海水盐度在35以下,而本实验设计了50~65的盐度处理组,超高盐度设计的目的是考虑以下两个可能的应用:1)用于推测自然界中细鳞幼鱼在海水极端盐度中能生存的最高盐度,与其现有的生态分布数据作比较、印证;2)用于将来养殖细鳞时,选择养殖盐度、低盐度或者高盐处理寄生虫或者其他对盐度敏感型的鱼类疾病,如小瓜虫,甚至是为推广到盐湖、盐田等高盐地区或者内陆虾池的混养模式中,作为养殖盐度参考资料。
3.2 细鳞幼鱼盐度胁迫适应能力与盐度梯度变化速率的关系
此外,如图2所示,在盐度为65和60的极高盐度胁迫下,细鳞幼鱼出现明显脱水现象,实验进行2 h后脱水率分别达到12.70%和12.62%并出现死亡,这可能说明细鳞幼鱼对极高盐度胁迫下的调节能力有限,无法应对极高盐度带来的组织损伤及渗透压改变等而最终导致死亡。在盐度为5和0的极端低盐度胁迫下,细鳞幼鱼出现明显吸水现象,实验进行2 h后吸水率分别为2.44%和6.46%,8 h后吸水率分别为1.03%和13.30%,24 h后吸水率分别为0.10%和10.40%(相对于8 h时的吸水率出现了止升下跌的趋势),细鳞幼鱼在盐度为5的胁迫下吸水率低于盐度为0环境下的吸水率,且经24 h的自身渗透压调节后,其含水量基本恢复至原状即渗透压恢复平衡,此外,盐度为0的幼鱼在实验进行9.8 h后开始出现死亡,24 h内死亡率为10%,并且在盐度恢复过程中亦出现死亡现象,盐度恢复后24 h内总死亡率升至19%,这可能表明幼鱼在盐度为5的海水下的调节能力强于盐度为0的淡水下的调节能力,细鳞幼鱼在盐度逐步降低的情况下才能完全适应淡水生活,并且需要一定的时间,通过逐步的适应过程使机体适应新的盐度环境。于娜等[26]对不同年龄的暗纹东方鲀(Takofuguobscurus)的研究认为,0龄组的幼鱼的渗透压调节能力较1龄鱼的要弱,可能是其渗透压调节的器官发育还不完善,不能完全行使其调节能力而导致死亡,细鳞幼鱼是否也是因渗透压调节的器官发育还不完善而导致死亡,还有待与成鱼的盐度实验进行进一步对比研究。

