SPE 柱法测定畜产品中29 种二英及其类似物
饶钦雄,张其才,刘 星,王献礼,李华玺,宋卫国,赵志辉
(上海市农业科学院农产品质量标准与检测技术研究所,上海201403)
饶钦雄,张其才,刘星,等.SPE 柱法测定畜产品中29 种二英及其类似物[J].上海农业学报,2020,36(4):103-107
1 材料与方法
1.1 试剂与仪器
Trace 1310 高分辨气相色谱(美国Thermo 公司);DFS 高分辨质谱仪(美国Thermo 公司);Dionex ASE300 加速溶剂萃取仪(美国戴安公司);冷冻干燥仪(北京博医康);氮气吹干仪(美国Organomation 公司);R-215 旋转蒸发仪(瑞士Buchi 公司)。
1.2 HRGC-HRMS 仪器条件
1.2.1 PCDD∕Fs 的色谱参考条件
色谱柱:BPX-DXN 柱,60 m×0.25 mm(内径) ×0.10 μm;进样口温度:270 ℃;进样方式:不分流模式;传输线温度:280 ℃;升温程序柱温:初始温度为140 ℃,保持1 min,以20 ℃∕min 的速度升到200 ℃,保持1 min,以5 ℃∕min 的速度升到220 ℃,保持16 min,以5 ℃∕min 的速度升到235 ℃,保持7 min,再以5 ℃∕min的速度升到310 ℃,并保持10 min;载气:高纯氦气( >99.999%);流速:1.0 mL∕min。
1.2.2 DL-PCBs 的色谱条件
色谱柱:BPX-DXN 柱,60 m×0.25 mm(内径) ×0.10 μm;进样口温度:290 ℃;进样方式:无分流模式;传输线温度:270 ℃;升温程序:初始温度为80 ℃,保持3 min,以15 ℃∕min 的速度升到150 ℃,保持2 min,以2.5 ℃∕min 的速度升到270 ℃,保持3 min,再在以15 ℃∕min 的速度升到330 ℃,并保持5 min;载气:高纯氦气( >99.999%);流速:1.0 mL∕min。
1.2.3 PCDD∕Fs 和DL-PCBs 的质谱条件
电离模式:电子轰击(EI+);电子能量:45 V;分辨率:≥10 000;源温:260 ℃;扫描模式:离子模式(SIM);质谱采集质量碎片类型:参考GB 5009.205—2013 标准附表。
1.3 样品前处理
1.3.1 样品预处理
将猪和牛等畜产品均质化,冷冻干燥,再将样品粉碎后存储于铝箔袋中,备用。
1.3.2 样品的提取
称取试样10.0 g,与10 g 无水硫酸钠或硅藻土混合均匀,转移至加速溶剂提取仪的不锈钢萃取池中,加入10 μL PCDD∕Fs 和DL-PCBs 的13C 标记定量内标,利用加速溶剂萃取仪进行提取。
提取条件如下,萃取溶剂:正己烷∶二氯甲烷=1∶1(v∕v);压力:10.3 MPa(1 500 psi);温度:120 ℃;加热时间:6 min;静态提取时间:8 min;吹扫时间2 min;循环3 次。 样品收集至250 mL 加速溶剂萃取仪接收瓶中。
1.3.3 脂重的测量
将样品提取液转移到平底烧瓶中,并用10 mL 正己烷对接收瓶进行洗涤,将洗涤液一并加入到平底烧瓶中,重复3 次;最后将提取液用旋转蒸发器浓缩至近干,用氮气吹至恒重,计算前后平底烧瓶重量差,计为脂重。
1.3.4 净化及浓缩
1.3.4.1 酸性硅胶净化除脂
使用100 mL 正己烷复溶后,加入50 g 高配比酸性硅胶(硅胶∶浓硫酸=56∶44,质量比),用旋转蒸发器在55 ℃下旋转浓缩20 min;静置8—10 min,将提取液转移到另一个平底烧瓶中;用50 mL 正己烷洗平底烧瓶中的硅胶,收集正己烷于第二个平底烧瓶中,重复3 次(如果酸性硅胶颜色较深,则应该重复上述过程,直至酸性硅胶为浅黄色)。 最后,将收集液旋转蒸发浓缩至3—5 mL,供下一步净化。
1.3.4.2 复合硅胶SPE 柱和活性炭SPE 柱净化
用30 ml 正己烷负压预淋洗复合硅胶SPE 柱,当液面降至无水硫酸钠层上方约2 mm 时,关闭负压,弃去淋洗液;复合硅胶SPE 柱流出端串联上活性炭SPE柱(图1),用10 ml 正己烷淋洗;当液面降至无水硫酸钠层上方约2 mm 时,关闭负压,弃去淋洗液;柱下放置梨形瓶准备上样接收。 此过程应检查净化柱,如果出现沟流、断层现象应更换新柱。
用70 mL 正己烷洗脱串联色谱柱DL-PCBs,洗脱液全收集;取下活性炭SPE 柱,在流入端串联上玻璃空SPE 柱,再用30 mL 甲苯洗脱串联色谱柱PCDD∕Fs,洗脱液全收集;将收集的洗脱液旋转蒸发浓缩至3—5 mL,供下一步浓缩用。
1.3.4.3 微量浓缩及溶剂置换
将上述浓缩液转移至球型浓缩器中,浓缩至0.2—0.3 mL,转移至带有衬管的棕色进样小瓶中,在氮气流下吹至约剩20 μL,加入20 μL 壬烷溶液,分别加入10 μL PCDD∕Fs 和DL-PCBs 回收率内标溶液,上HRGC∕HRMS 分析检测。
1.4 方法准确度和精密度验证
于猪肉和牛肉样品中,添加适量的PCDD∕Fs 和DL-PCBs 标准品,2378-TCDF 和2378-TCDD 添加水平为20 pg∕g,OCDF 和OCDD 添加水平为200 pg∕g,其他25 种二英类化合物添加水平为100 pg∕g,设置4个平行、1 个样品空白和1 个系统空白样品,按1.3 进行样品前处理,上HRGC-HRMS 仪器测定。
2 结果与分析
2.1 色谱柱的选择
选用Thermo TR-DIOXIN-5MS(60 m×0.25 mm ×0.25 μm)(简称TR 柱)和SGE BPX-DXN[60 m ×0.25 mm(thickness)](简称BPX 柱)两款毛细管柱进行PCDD∕Fs 和DL-PCBs 的分析。 在色谱分离上,2,3,3′,4,4′,5-HxPCB 和2,3,3′,4,4′,5′-HxPCB 两个化合物在TR 和BPX 这两款色谱柱上的分离度分别为1.89 和2.69。 在建立标准曲线时, TR 柱PCDD∕Fs 的RSD 在0.7%—18.7%,PCBs 的RSD 在1.3%—9.7%,BPX 柱PCDD∕Fs 的RSD 在2.8%—6.6%,PCBs 的RSD 在0.4%—9.4%。 综上,BPX 色谱柱在分析PCDD∕Fs 和DL-PCBs 时分离度以及定量准确性更高,更加适用于二英类化合物的测定。
2.2 SPE 净化柱洗脱条件的摸索
通过加标洗脱的方式确定SPE 净化柱的洗脱条件。 加入10 μL PCDD∕Fs 混标和10 μL DL-PCBs 混标,同时加入定量内标,过复合硅胶和活性炭SPE 柱,净化分离。 采用正己烷100 mL 洗脱DL-PCBs,每20 mL 收集1 次;采用30 mL 甲苯洗脱PCDD∕Fs,每10 mL 收集1 次。 结果表明,使用20—40 mL 正己烷,DL-PCBs 洗脱效率最高,使用60 mL 正己烷DL-PCBs 的洗脱率达到95.2%以上,为保证方法的稳定性,确定DL-PCBs 的正己烷洗脱体积为70 mL;20 mL 甲苯对PCDD∕Fs 洗脱率已经达到91.1%以上,为了充分洗脱出17 种PCDD∕Fs,最终确定PCDD∕Fs 的洗脱体积为30 mL。
2.3 方法准确度和精密度

表1 猪肉中添加回收结果(n=4)Table 1 The results of fortified recovery in pork(n=4)

表2 牛肉中添加回收结果(n=4) Table 2 The results of fortified recovery in beef(n=4)
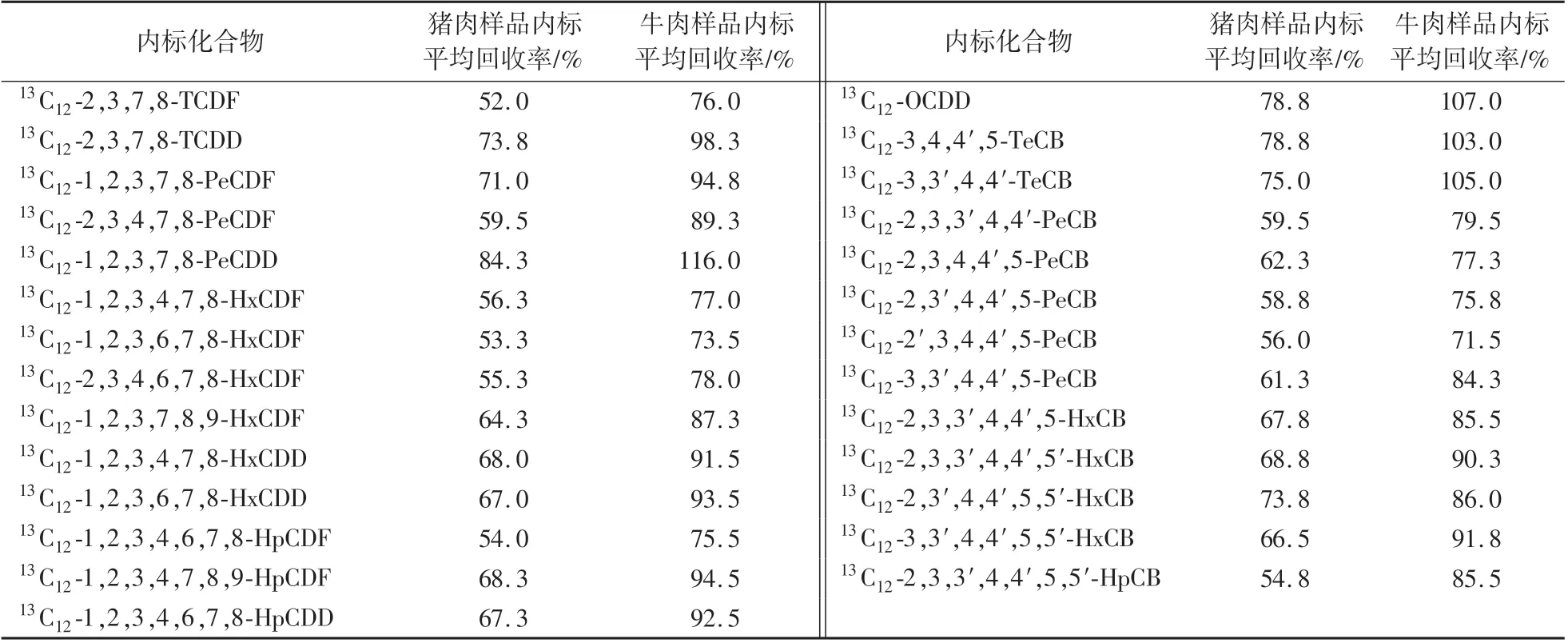
表3 同位素内标回收率(n=4)Table 3 The recovery of isotopic internal standard(n=4)
2.4 实际应用
3 结论与讨论
本文采用SPE 负压的模式进行样品的净化,相比于GB 5 009.205—2013[6]中的玻璃层析柱重力过柱的方法,效率较高,并可减少有机溶剂约40%;张莉娜等[8]采用浓硫酸除脂,多段混合硅胶柱和氧化铝柱净化植物油样品,其流程较为复杂,且多次操作浓硫酸较为危险;任曼等[9]经酸性硅胶床、多段混合硅胶柱和凝胶渗透色谱柱(GPC)净化后,再用硅藻土柱分离的方法,净化步骤较多。 本研究建立的二英类化合物检测技术,虽未在净化原理上有较大突破,但在提高效率并减少有机溶剂使用量等方面具有良好的实际应用价值,适用于我国畜产品中二英类化合物的检测。

