不同营养模式下固定化斜生栅藻和普通小球藻氨氮去除能力对比分析
刘 祥, 杨美娟, 散而复, 王凯军
清华大学环境学院,环境模拟与污染控制国家重点联合实验室,北京 100084
随着我国工农业的快速发展及城镇化水平的提高,用水量和污水产生量均呈逐年增长态势,水资源短缺和水污染问题也随之日益突出. 其中,氮和磷过度排放引起的水体富营养化是当前最典型的水环境问题[1-2],它不仅破坏了水生态系统的结构和功能,而且严重威胁了人类饮水安全. NH4+-N作为藻类优先利用的无机氮源,是导致水体富营养化的主要诱因[3]. 污水厂二级出水作为水体NH4+-N的重要输入,削减其排放量是水环境生态治理的关键.
活性污泥法和生物膜法作为生物脱氮的主流方法,具有技术成熟和出水稳定等优点,但其脱氮效率对碳源和能源的依赖性强[4-5]. 目前国内诸多污水处理厂通过外加碳源来满足总氮达标排放,但衍生出运行费用和污泥产量高等问题. 针对传统生物脱氮工艺的局限性,相关学者一直致力于新型脱氮技术的研发. 20世纪50年代末,Oswald等[6]提出了“微藻处理污水”的新概念,此后,该技术一直是新型污水处理技术的典型代表. 微藻是一类个体微小、形态多样且种类繁多的原核或真核生物,具有光合作用效率高、环境适应能力强、生长周期短和生物质产量高等特点[7-8]. 它以CO2为碳源,通过光合作用把污水中不同形态的氮、磷等营养物质缔结到碳骨架上合成有机物,如多不饱和脂肪酸、蛋白质和多糖等,这不仅可缓解温室效应,还可实现营养元素的资源化利用[9]. 近年来诸多研究[10-11]证实,微藻除了可自养生长外,还可利用有机物进行异养或混养生长. 迄今已筛选出许多可高效净化水质的藻种,其中尤以绿藻居多. 因此,微藻培养耦合污水处理是真正实现营养元素“减排”和“资源化”双重效应的绿色生物技术.
然而,藻水分离问题一直限制着微藻生物技术的进一步发展. 20世纪80年代中期,伴随着生物固定化技术的广泛研究,Chevalier等[12]首次提出藻类固定化技术并尝试将其用于污水处理领域,该技术既可以保持藻类长时间正常生长,又能阻止活性藻随水流失. 目前,藻类固定化的方法主要有吸附法和包埋法[13],但由于吸附法固定的藻细胞容易脱落,包埋法的应用更加广泛. 固定化载体材料多为PVA (聚乙烯醇)和SA (海藻酸钠),它们具有机械强度大、传质性能好和耐生物分解等特性[14]. 毛书端等[15]通过PVA和SA的对比研究,发现以PVA为包埋材料制成的固定化小球稳定性和机械强度要优于SA,但小球形状不规则且传质性能低于SA. 傅海燕等[16]研究了SA、PVA和SA+PVA复合载体,结果表明,以SA为载体制备的小球传质性能优于PVA,但PVA载体制备的小球脱氮效果优于SA但不及SA+PVA复合载体.
该研究分别以斜生栅藻和普通小球藻为研究对象,以SA为载体制备固定化藻球,以自由生长为参比,分析不同营养模式(自养、异养和混养)对固定化微藻NH4+-N去除潜力的影响,阐明不同碳源类型及浓度所引起的生长差异,以期为微藻污水深度处理模式及生物质生产提供基础资料.
1 材料与方法
1.1 藻种与培养
该研究以绿藻门中的斜生栅藻(Scenedesmusobliquus, FACHB-12)和普通小球藻(Chlorellavulgaris, FACHB-8)为试验藻种,购自中国科学院水生生物研究所淡水藻种库. 试验前先分别将2种藻种在无菌条件下接种到含100 mL BG11培养基的锥形瓶中,并置于光照培养箱(ZDX-350, 685 mm×595 mm×1 875 mm,宁波赛福试验仪器有限公司),在温度为(25±1)℃、光照强度为86.4 μmol/(m2·s)、光暗比为12 h∶12 h的条件下进行初步培养;然后根据微藻生长情况逐级扩大培养,获取生长速率较高的藻细胞. 培养期间每天分早、中、晚3次轻轻摇晃锥形瓶以混匀藻液,并随机移动锥形瓶位置以保证光照均匀.
1.2 试验污水配置
该试验所用污水为人工配置,其具体配方如下(1 L):NaAc 385 mg (300 mg CODCr);NH4Cl 115 mg (30 mg NH4+-N);KH2PO413 mg;FeSO4·7H2O 0.55 mg;CaCl26 mg;MgSO4·7H2O 66 mg;A5 (CuSO4·5H2O 0.08 g/L, MnCl2·4H2O 1.86 g/L, ZnSO4·7H2O 0.22 g/L, Na2MoO4·2H2O 0.39 g/L, Co(NO3)2·6H2O 0.05 g/L, H3BO32.86 g/L) 1 mL[17]. 其中,根据所称取NaAc的质量配置成不同ρ(CODCr)的污水,且用浓度为1 mol/L的NaOH或HCl溶液调节污水初始pH为7.0左右(便携式多参数分析仪,HQ40d,美国哈希公司),随后立即将其置于高压灭菌锅(AutoClave SN310C, 460 mm×590 mm×848 mm,日本YAMATO公司)中121 ℃下灭菌20 min,冷却后备用.
1.3 微藻固定化方法
首先将处于对数生长期的藻液置于高速冷冻离心机(himac CR22N, 最大离心力为 55 200×g,最高转速为 22 000 r/min,日本HITACHI公司)上,4 ℃、3 500 r/min下离心10 min,弃去上清液后用浓度为15 mg/L的NaHCO3溶液冲洗藻体并再次离心,重复操作2次,以去除吸附在细胞表面的营养物质. 然后用无菌水冲洗藻细胞后混匀离心,仍重复操作2次,再将其转移至无N培养基中饥饿培养3 d,以消耗细胞内的营养物质. 最后同样条件下离心分离藻细胞,并用无菌水反复冲洗3次后形成悬浮液. 通过测定悬浮藻液的OD(Optical Density, 光密度),结合定量曲线计算藻密度,根据藻球的初始包埋密度,计算藻液需求量.
取一定体积且密度已知的藻液与灭菌后的5% SA溶液以体积比为1∶1混合,并用玻璃棒搅拌形成均匀混合液(注意搅拌时不能产生气泡),再将其注入60 mL的注射器中,缓慢滴入已灭菌处理的2% CaCl2溶液中(保持注射器出口与液面之间的距离为20 cm左右),约5 min后即可形成直径为4 mm的藻球,结束后将其置于4 ℃冰箱中固定16 h,然后用无菌水反复冲洗藻球多次后置于冰箱保存备用[18-19]. 在该试验条件下,35 mL混合液即可形成 1 000 颗藻球.
1.4 试验设计
该试验包括3种不同营养模式(自养、异养和混养),分自由生长和固定化生长2种形式,共设28组试验. 每种藻包括14组,其中自养模式2组、异养模式6组和混养模式6组,且每组包括3个平行试验. 首先在已灭菌的250 mL广口玻璃锥形瓶中加入140 mL相应的试验污水,初始ρ(NH4+-N)均为30 mg/L左右,其中自养模式下的污水不含CODCr,仅以300 mL/min的流量通入5% CO2和95% N2的混合气作为碳源,而异养和混养模式下的污水成分一致,且分3个ρ(CODCr)梯度(100、200和300 mg/L)展开试验. 然后在固定化生长组的每个锥形瓶中投加400颗藻球(通过计算以保证每个锥形瓶中初始藻密度为1×106cells/mL,同时根据稀释法在自由生长组的每个锥形瓶中添加一定体积的藻液,使每个锥形瓶中的初始藻密度也为1×106cells/mL,以保证自由生长和固定化生长组之间的可比性. 自养模式仅以通入的CO2作为碳源,光照作为能源,混合模式可以同时以污水中的CODCr和空气中少量的CO2作为碳源,以光照作为能源,而异养模式则需用锡箔纸包裹以遮蔽光的照射,仅以污水中的CODCr同时作为碳源和能源,培养条件同前,周期为5 d. 试验周期内,每天用2 mL的注射器于各个锥形瓶中吸取1.5 mL的液体,并用滤头(PES,Φ13 mm, 0.45 μm)过滤用于测定污水中ρ(NH4+-N);其次于各自由生长组中每天取3 mL藻液用于测定藻液OD值,同时于各固定化生长组中取3颗藻球置于含有3 mL 1.5% 柠檬酸钠溶液的5 mL离心管中进行解固处理2 h后摇匀,同样条件下测定藻液OD值,再根据标准计数曲线确定各组藻密度. 试验中使用的所有玻璃器皿、枪头及培养基等均经过高压灭菌(温度为121 ℃、时间为20 min)处理.
1.5 分析方法
首先,分别取1 mL混合均匀的2种藻液置于15 mL离心管中,无菌水稀释10倍后摇匀,分别用滴管取适量藻液沿血球计数板(25格×16格)平台两侧的凹槽下边缘注入一滴,待藻液充满整个计数区后用吸水纸吸去多余悬液,静置片刻,使细胞沉降到计数板上,并在显微镜(CX41RF,日本OLYMPUS公司)下计数3次,若3次计数误差在10%以内,则以3次平均值为藻密度,否则重复计数直至符合误差要求[20]. 然后,分别取3 mL斜生栅藻和普通小球藻浓液置于玻璃比色皿中,利用紫外可见分光光度计(DR 6000,美国哈希公司)进行全波长扫描,确定最佳吸收峰,并将最佳吸收峰对应的波长(682 nm和681 nm)分别作为该2种藻的测定波长. 最后,分别取1 mL已知藻密度的藻浓液按照10倍梯度逐级稀释7个样品(每个样品的藻密度可计算获取),分别在相应的测定波长下测定OD值,并以OD值为横坐标,藻密度为纵坐标绘制标准计数曲线[20],得出斜生栅藻的标准计数曲线为y=196.33x(R2=0.999 9),普通小球藻的标准计数曲线为y=317.79x(R2=0.992 9). 自由藻样品测定OD值后直接根据标准计数曲线计算藻密度,而固定藻样品解固测定OD值后计算出藻密度,再根据每颗藻球的体积计算出每个藻球中的藻细胞个数,最终根据系统的总体积计算出藻密度. 微藻生长速率按照μ(d-1)=ln(Ct/C0)/(t-t0)计算;污水ρ(NH4+-N)采用HJ 535—2009《纳氏试剂分光光度法》测定.
2 结果与讨论
2.1 自养模式下NH4+-N去除能力分析
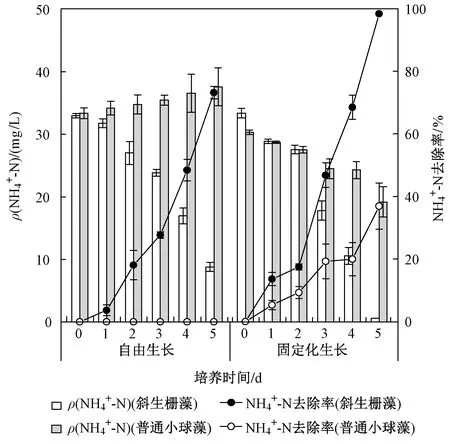
图1 自由生长/固定化生长的斜生栅藻和普通小球藻在自养模式下NH4+-N去除能力对比Fig.1 Comparison of NH4+-N removal capacity between free and immobilized S. obliquus and C. vulgaris under autotrophic mode
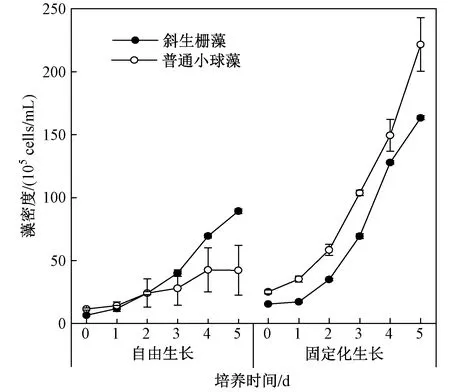
图2 自由生长/固定化生长的斜生栅藻和普通小球藻在自养模式下的藻密度变化Fig.2 Changes in cell densities of free and immobilized S. obliquus and C. vulgaris under autotrophic mode
斜生栅藻和普通小球藻在自养模式下对NH4+-N的去除能力如图1所示. 总体看来,当初始ρ(NH4+-N)为30 mg/L时,斜生栅藻对NH4+-N的去除能力高于普通小球藻,且固定化生长优于自由生长. 培养5 d后,固定化生长的斜生栅藻对NH4+-N的去除率达98%,自由生长的斜生栅藻对NH4+-N的去除率为73%;而固定化生长的普通小球藻对NH4+-N的去除率仅为37%,自由生长的普通小球藻不但没有去除NH4+-N,ρ(NH4+-N)反而略有增加. 这些结果一方面证实了固定化可以有效提高微藻在自养模式下的NH4+-N去除能力;另一方面说明了微藻固定化生长的性能提升效果也因藻种不同而异. 这种固定化优势可能是由于藻细胞被包埋载体固定在较小的空间内,不仅增加了单位体内的细胞数,而且由于团聚效应增强了藻细胞之间的相互作用[21]. 其次,藻细胞被包埋载体覆盖,从某种意义上来说,包埋体对藻细胞起到一定的保护作用,可抵抗代谢中产生的不利因子的负面影响[22]. 藻生物量的大小是决定其NH4+-N去除的根本原因,如图2所示,培养5 d后,固定化生长的斜生栅藻的藻密度为1.6×107cells/mL,生长速率(μ)为0.48 d-1,显著高于自由生长时的0.9×107cells/mL;固定化生长的普通小球藻的藻密度更是达2.2×107cells/mL,但生长速率(μ)不及斜生栅藻,为0.44 d-1. 这从生长特性的角度说明,在自养模式下,固定化不仅没有束缚藻细胞的生长,反而发挥了积极作用,并且这种促进作用对普通小球藻表现的更为突出. 固定化载体具有保护藻细胞的作用,对于自由生长的普通小球藻,不仅生长缓慢甚至在培养后期出现生长停滞,这可能是因通气造成培养液“酸化”,生成过量的H+破坏了光合作用的PSⅡ(光系统Ⅱ)过程,抑制了藻细胞CO2浓缩(CCM)机制的活性[23-24],进而影响了藻细胞生长. 培养4 d后,系统内的pH在4.4左右,并保持稳定直到培养结束;而固定化生长末期的pH基本维持在中性水平,这可能跟藻密度生长缓慢甚至衰亡有关. LI等[25]将铜绿微囊藻(Microcystisaeruginosa)培养在浓度约为3.5 mg/L的NH4+-N中,7 d后系统内也出现藻密度降低和ρ(NH4+-N)增加的现象. 因此,在同等条件下自养培养,斜生栅藻单个细胞的NH4+-N去除能力要显著高于普通小球藻单个细胞,且斜生栅藻表现出的适应性更强.
2.2 异养模式下NH4+-N去除能力分析
如图3所示,在异养模式下,无论哪种存在形式,斜生栅藻和普通小球藻对NH4+-N的去除率整体较低,相比于自养模式,斜生栅藻的NH4+-N去除能力显著削弱. 从图3可以看出,培养5 d后,自由生长的斜生栅藻和普通小球藻对NH4+-N的去除能力均在40%以下,整体效果劣于固定化生长,且对ρ(CODCr)无显著依赖性. 固定化生长的斜生栅藻对NH4+-N的去除能力有显著提升,最大去除率为53%,且仍未呈现ρ(CODCr)依赖性;而固定化生长的普通小球藻性能的提升则较为微弱,不同ρ(CODCr)条件下,NH4+-N去除率仅约为30%. 这说明营养模式变更会显著降低固定化处理的优势,且该优势会因藻种的不同而不同. 其次,从NH4+-N去除和生物质富集的角度来看,这两种藻异养培养的适应性较弱. 微藻能否在异养模式下培养,最主要是取决于藻种是否具备完善的有机碳和有机氮利用机制[26]. 周文俊等[27]研究指出,一株微藻细胞的有机物浓缩能力大小、酶工作效率和呼吸作用强度等因素直接决定了藻株的异养效率. De-Swaaf等[28]以葡萄糖为基质,成功异养培养了寇氏隐甲藻(Crypthecodiniumcohnii),生物量高达83 g/L. 由此推断,该试验中异养效率低的另一个原因可能与碳源种类有关.
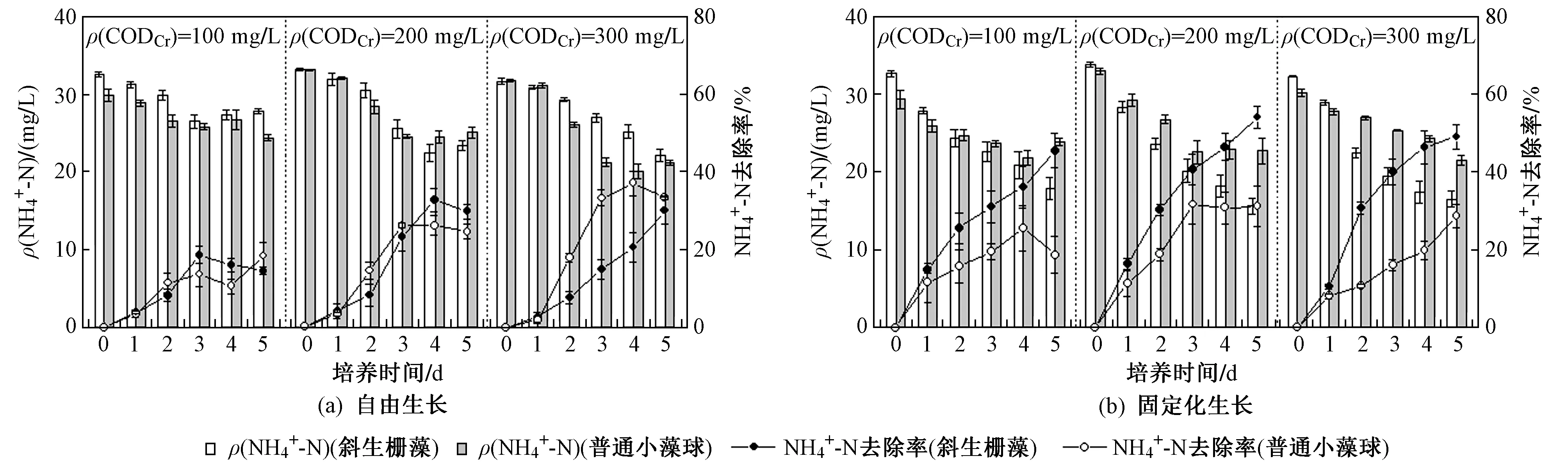
图3 自由生长/固定化生长的斜生栅藻和普通小球藻在异养模式下NH4+-N去除能力对比Fig.3 Comparison of NH4+-N removal capacity between free and immobilized S. obliquus and C. vulgaris under heterotrophic mode
由图4可见:自由生长下,斜生栅藻和普通小球藻在C/N比为10时的最大藻密度分别为0.4×107、0.7×107cells/mL,生长速率分别为0.29、0.35 d-1;固定化生长下,斜生栅藻和普通小球藻在C/N为10时的最大藻密度均变小,分别为0.2×107、0.6×107cells/mL,生长速率分别为0.07、0.17 d-1. 这说明固定化处理对微藻有机物浓缩通道形成了屏障效应,微藻不能快速获取能量生长,微藻生长慢间接降低了有机物利用率,不良循环效应也是降低其效率的原因之一. 其次,异养培养时,有机碳源类型及C/N更是影响其生长的关键因素. 因此,在该试验条件下,固定化生长的斜生栅藻和普通小球藻对异养模式的适应性均较弱,并不能实现NH4+-N去除和生物质富集的双重效应.
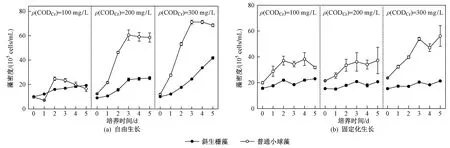
图4 异养模式下自由生长和固定化生长的斜生栅藻和普通小球藻的藻密度变化Fig.4 Changes in cell densities of free and immobilized S. obliquus and C. vulgaris under heterotrophic mode
2.3 混养模式下NH4+-N去除能力分析
如图5所示,在混养模式下,斜生栅藻和普通小球藻对NH4+-N的去除潜力优势明显,显著优于异养模式. 总体看来,当初始ρ(NH4+-N)一定时,两种微藻对CODCr均表现出浓度依赖性. LU等[29]的研究也得出了类似的结论,即有机碳在微藻同化吸收NH4+-N的通路中发挥着重要作用,有机碳代谢过程中可以同时生成ATP(三磷酸腺苷)和NADH(烟酰胺腺嘌呤二核苷酸)供微藻进行N代谢. 当污水ρ(CODCr)约为300 mg/L时、C/N为10时,培养5 d后,自由生长的斜生栅藻和普通小球藻在培养末期均呈现较强的NH4+-N去除能力,NH4+-N几乎全部被去除,这主要归因于有机物可以生成充足的ATP和NADH用于NH4+-N同化作用;当ρ(CODCr)降至200 mg/L时、C/N为6.7时,自由生长的普通小球藻对NH4+-N的去除率仍达94%,显著高于斜生栅藻(69%);而随ρ(CODCr)低至100 mg/L左右、C/N为3.3时,自由生长的普通小球藻对NH4+-N的去除能力虽仍然优于斜生栅藻,但去除率已降至57%. 可见,C/N是微藻去除NH4+-N效率高低的重要因子,Barros等[30]指出,藻细胞内C和N代谢密切相关,相互依赖,NH4+-N只有缔结到C代谢形成的碳骨架上才能合成生物质. 此外,WU等[11]研究指出,普通小球藻在C/N为10时,其N去除能力最佳,与该研究的结果一致. 对比固定化生长的结果,微藻对NH4+-N的去除能力并未得到改善,尤其对普通小球藻的负效应更为明显,且该效应与ρ(CODCr)呈正相关. 当ρ(CODCr)为300 mg/L时,普通小球藻对NH4+-N的去除率由100%降至65%;当ρ(CODCr)为200 mg/L时,普通小球藻对NH4+-N的去除率由94%降至69%;当ρ(CODCr)为100 mg/L时,普通小球藻对NH4+-N的去除率由57%降至44%. 而对于斜生栅藻来说,这种负效应较小,当ρ(CODCr)为300 mg/L时,NH4+-N去除率从98%降至86%. 在混养模式下,固定化处理产生的正效应不如自养模式明显,这主要是由于C源类型不同所引起的C代谢差异引起,CO2可直接通过三羧酸循环生成ATP供N代谢使用,而有机碳则需要先转化为磷酸丙糖,再转化为乙酰辅酶A进行TCA循环生成ATP和NADH用于谷氨酸代谢[31].
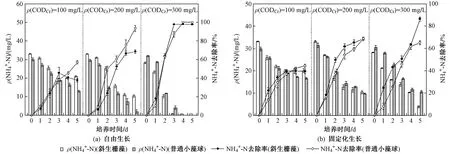
图5 自由生长/固定化生长的斜生栅藻和普通小球藻在混养模式下NH4+-N去除能力对比Fig.5 Comparison of NH4+-N removal capacity between free/immobilized S. obliquus and C. vulgaris under mixotrophic mode
从藻密度变化结果(见图6)可以看出,混养模式下微藻生长也呈现ρ(CODCr)依赖,培养5 d后,系统内的藻密度均呈现自由生长大于固定化生长、普通小球藻大于斜生栅藻的变化趋势. 自由生长下,斜生栅藻和普通小球藻的最大藻密度分别为1.3×107和3.3×107cells/mL,生长速率分别为0.49和0.64 d-1;固定化生长下,因受生长空间的限制,藻密度均有所降低,分别为0.9×107和2.0×107cells/mL,生长速率分别为0.32和0.43 d-1. 这表明,除在自养和异养模式下生长外,在混养模式下单个普通小球藻细胞对NH4+-N的去除能力仍低于单个斜生栅藻细胞.
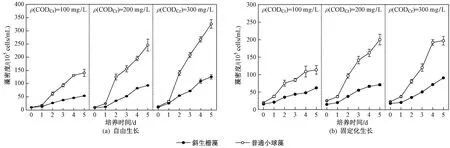
图6 混养模式下自由生长和固定化生长的斜生栅藻和普通小球藻的藻密度变化Fig.6 Changes in cell densities of free and immobilized S. obliquus and C. vulgaris under mixotrophic mode
3 结论
a) 固定化生长的微藻对NH4+-N去除能力的提升并不是绝对的,取决于营养模式和藻种的不同. 在自养模式下,斜生栅藻和普通小球藻固定化生长对NH4+-N的去除率分别升高了25%和37%;在异养模式下,固定化生长仅对斜生栅藻NH4+-N去除能力有提升;而在混养模式下,固定化生长的贡献整体呈负效应.
b) 微藻在不同营养模式下对NH4+-N的去除能力差异较大. 当初始ρ(NH4+-N)为30 mg/L时,斜生栅藻和普通小球藻在混养模式下对NH4+-N的去除效果最优;当ρ(CODCr)为300 mg/L时,NH4+-N几乎可完全去除,自养模式次之,而异养模式最不理想.
c) 固定化生长的微藻在不同营养模式下呈现正负双重影响. 固定化可显著提升斜生栅藻和普通小球藻在自养模式下的生长速率,而在异养和混养模式下则呈现相反趋势. 总体上普通小球藻的生长速率大于斜生栅藻,但普通小球藻单个细胞对NH4+-N的去除能力显著低于斜生栅藻单个细胞.

