基于高通量测序的贮藏白牡丹表面细菌多样性分析
陈佳佳,胡雲飞,沈诗钰,王志华,周喆,唐琴,孙威江1,*
基于高通量测序的贮藏白牡丹表面细菌多样性分析
陈佳佳1,2,4,胡雲飞2,3,4,沈诗钰1,2,4,王志华1,2,4,周喆1,2,4,唐琴1,2,4,孙威江1,2,3,4*
1. 福建农林大学园艺学院,福建 福州 352000;2. 福建省行业技术开发基地,福建 福州 350002;3. 福建农林大学安溪茶学院,福建 泉州 362400;4. 福建省茶产业工程技术研究中心,福建 福州 350002
为分析贮藏白牡丹细菌多样性,利用高通量测序对11个不同贮藏年份白牡丹细菌进行16 S rDNA检测。结果表明,贮藏茶样的优势菌门为变形菌门()、拟杆菌门()、厚壁菌门(等,优势菌纲为-变形菌纲()、-变形菌纲()、鞘脂杆菌纲()等,优势菌属为鞘氨醇单胞菌属()、甲基杆菌属()、土地杆菌属()等。不同贮藏年份白牡丹细菌组成结构相似,丰度存在差异;贮藏年份对白牡丹表面细菌组成未有显著影响,而贮藏环境影响细菌多样性。
高通量测序;白牡丹;细菌;多样性
白茶是一种轻发酵茶类,制作简单,只有萎凋及干燥工序[1]。贮藏白茶是在适当条件下仓储若干时间的陈年白茶。贮藏黑茶较为常见,黑茶中已发现存在大量微生物,如冠突散囊菌()、曲霉属()、假单胞菌属()等[2-3]。微生物在黑茶加工过程中具有重要作用,关于黑茶中微生物的研究已经大量开展。研究证明,贮藏年份[4]、加工过程[5]、原料[3]、产地[6]均会对茶叶微生物群落组成产生影响。杨雅焯等[7]研究发现,广西六堡茶的优势菌为鞘脂单胞菌属()、、乳酸菌属()等,而重庆沱茶无明显优势菌。在下关沱茶发酵过程,发酵前期霉菌为优势菌属,发酵后期酵母则占主导[8]。对不同年份普洱茶微生物群落的研究发现,芽孢杆菌属()为其主要优势菌,其次为赖氏杆菌属()[4]。茶叶中微生物来源丰富,黑茶中微生物可能来自于茶树内生菌、茶树生长环境和加工环境等。路伟尧[8]发现普洱茶渥堆过程中的部分优势菌与生长环境中空气微生物、茶树内生菌、车间环境(空气、地面、发酵用水)微生物一致,推测普洱茶渥堆发酵过程中的微生物部分来自于茶树的生长环境、茶叶内生菌以及发酵车间。陈丽莹等[9]检测到茶树大量内生菌在土壤中存在,推测土壤是内生菌的可能来源。因此,白茶在贮藏过程中的微生物也可能存在多种来源。
在黑茶、烟草的贮藏过程中,均发现微生物多样性变化对其品质产生影响[10-12]。目前,国内大部分的研究仍是基于黑茶,对于白茶微生物研究较少,且贮藏白茶细菌多样性还尚未见报道,在白茶后期贮藏过程中,细菌多样性的变化值得探讨。因此,本试验选取了11个不同贮藏年份的白牡丹样品,通过对其表面细菌多样性进行分析,揭示贮藏过程中细菌群落结构变化,以期为探究白茶贮藏条件提供参考。
1 材料与方法
1.1 试验材料
试验样品为福建品品香茶业有限公司、福建省裕荣香茶业有限公司、福建省天湖茶业有限公司、福鼎市张元记茶业有限公司和福建鼎白茶业有限公司的不同贮藏年份白牡丹茶样。贮藏地点均为福建省福鼎市,同一企业茶样贮藏环境一致,样品收集完毕后于实验室常温密封保存,湿度小于50%。取样过程的自封袋、锡箔纸、手套等均经过无菌处理。具体样品信息如表1所示,以2017年生产的白牡丹为对照样品(CK)。
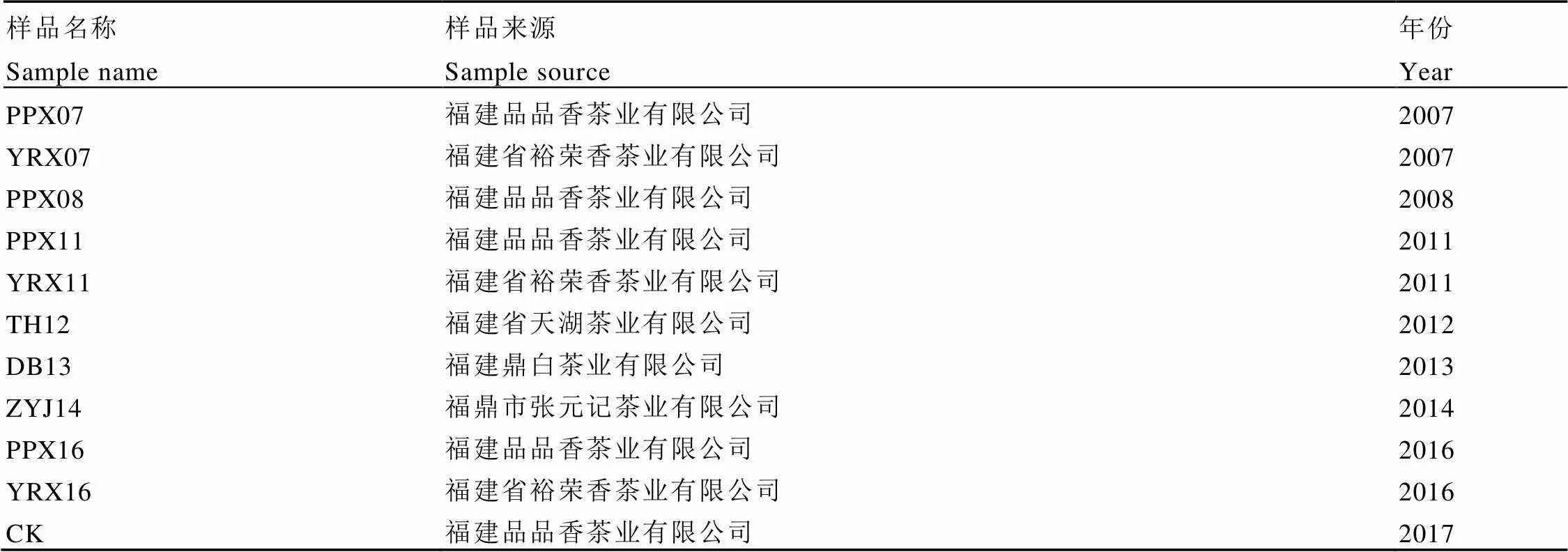
表1 不同贮藏年份白牡丹样品表
1.2 试验试剂
DNA Marker,日本Takara公司;E.Z.N.A.®Soil DNA Kitomega试剂盒,美国Omega公司;NaCl、Na2HPO4∙12H2O、KH2PO4、50×TAE缓冲液,北京索莱宝科技有限公司;琼脂糖,南京生兴生物技术有限公司;rTaq DNA聚合酶试剂盒,北京全式金生物技术有限公司;AxyPrep DNA Gel Extraction Kit,美国Axygen公司。
PBS缓冲液配制:称取NaCl 8 g,KCl 0.2 g,Na2HPO4∙12H2O 3.62 g,KH2PO40.24 g,溶解于800 mL蒸馏水中,用盐酸调节pH为7.4,然后加水定容至1 000 mL。
1.3 试验方法
1.3.1 不同年份白牡丹表面细菌富集及DNA提取
称取5 g混合好的样品于无菌容器中,加入50 mL PBS缓冲液,置于摇床上振荡培养30 min(180 r·min-1,37℃),然后超声提取15 min,取出摇晃15 s,再次超声15 min,置于摇床上振荡培养30 min(180 r·min-1,37℃),过滤后将滤液转移至新的无菌管,常温状态12 000 r·min-1离心10 min,弃上清液,将下层液体转移到2.0 mL无菌离心管中,12 000 r·min-1离心10 min,弃上清液,沉淀进行DNA提取。根据E.Z.N.A.®Soil DNA Kit试剂盒说明书进行总DNA抽提。
1.3.2 测序建库
提取样品DNA后,根据V3和V4保守区设计得到引物(分别为338F和806R,338F:5'-ACTCCTACGGGAGGCAGCA-3',806R:5'-GGACTACHVGGGTWTCTAAT-3'),进行PCR扩增。PCR扩增程序为:95℃预变性5 min;95℃变性30 s,50℃退火30 s,72℃延伸30 s,30个循环;72℃稳定延伸7 min;4℃保存。PCR产物使用2%凝胶回收,根据AxyPrep DNA Gel Extraction Kit说明书纯化产物,检测定量,使用NEXTFLEX Rapid DNA-Seq Kit进行建库,委托北京百迈克生物公司进行测序。
1.3.3 数据分析
使用FLASH v1.2.7软件,通过overlap对每个样品的双端reads(PE reads)进行拼接,得到原始序列(Raw tags)。使用Trimmomatic v0.33软件,对原始序列进行过滤,得到优化序列(Clean tags)。使用UCHIME v4.2软件,鉴定并去除嵌合体序列,得到最终有效序列(Effective tags)。分别计算有效率(Effective,有效序列占原始序列的比例)、GC含量(G和C类型的碱基占总碱基的百分比)、Q20(质量值大于等于20的碱基占总碱基数的百分比)和Q30(质量值大于等于30的碱基占总碱基数的百分比)。使用QIIME(version 1.8.0)软件中的UCLUST对Tags在97%的相似度水平下进行聚类、获得OTU(Operational taxonomic unit),并基于Silva(细菌)分类学数据库对OTU进行分类学注释。使用Mothur v.1.30软件进行Alpha多样性指数分析,作稀释性曲线(Rarefaction Curve)[13],进行Chao1、Ace、Shannon、Simpson指标计算[14]。通过Graph Prism 8.0、R软件作图。
2 结果与分析
2.1 测序质量分析
由表2可知,11个样品测序共获得784 599对序列,703 966条优化序列,每个样品至少产生39 027条优化序列;有效率均>85%,有效序列占原始序列比值大;样品GC含量范围为51.75%~55.20%,不存在明显的GC偏好性;Q20值均≥96.24%,Q30值均≥92.71%。综上所述,测序质量较好,可以用于后续试验分析。
2.2 OTU分析
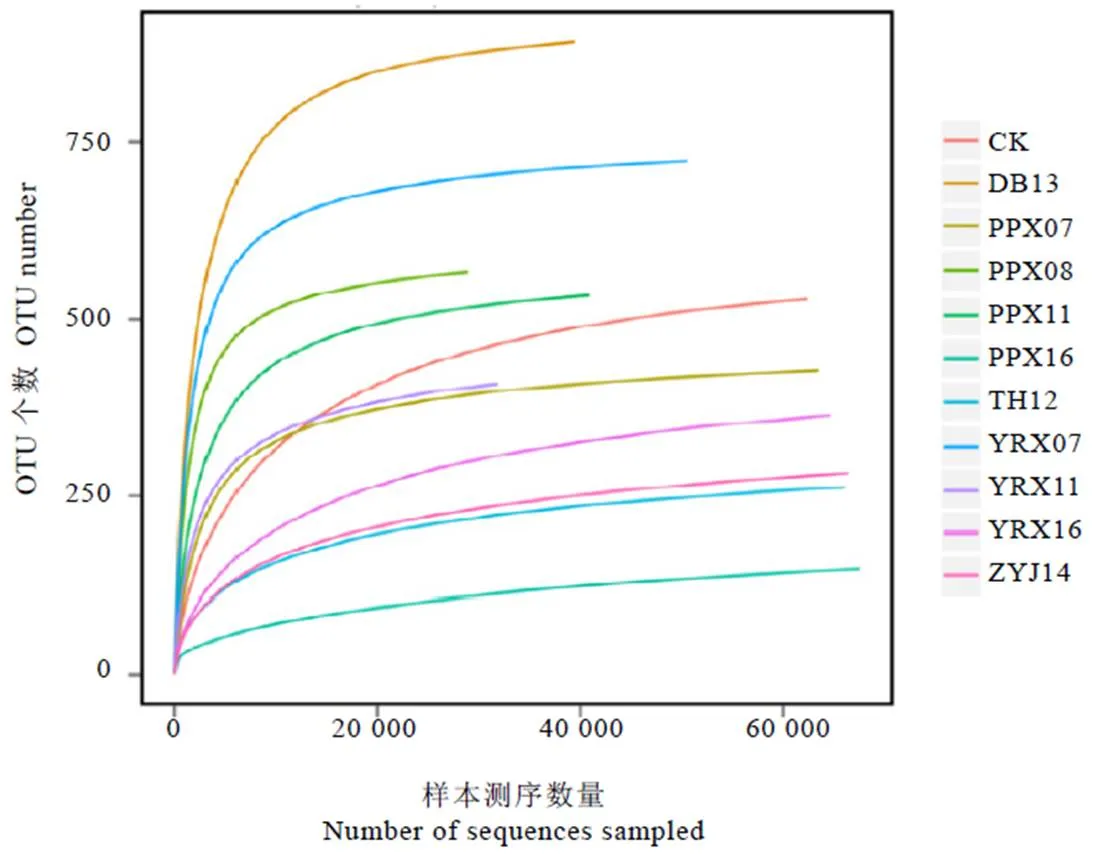
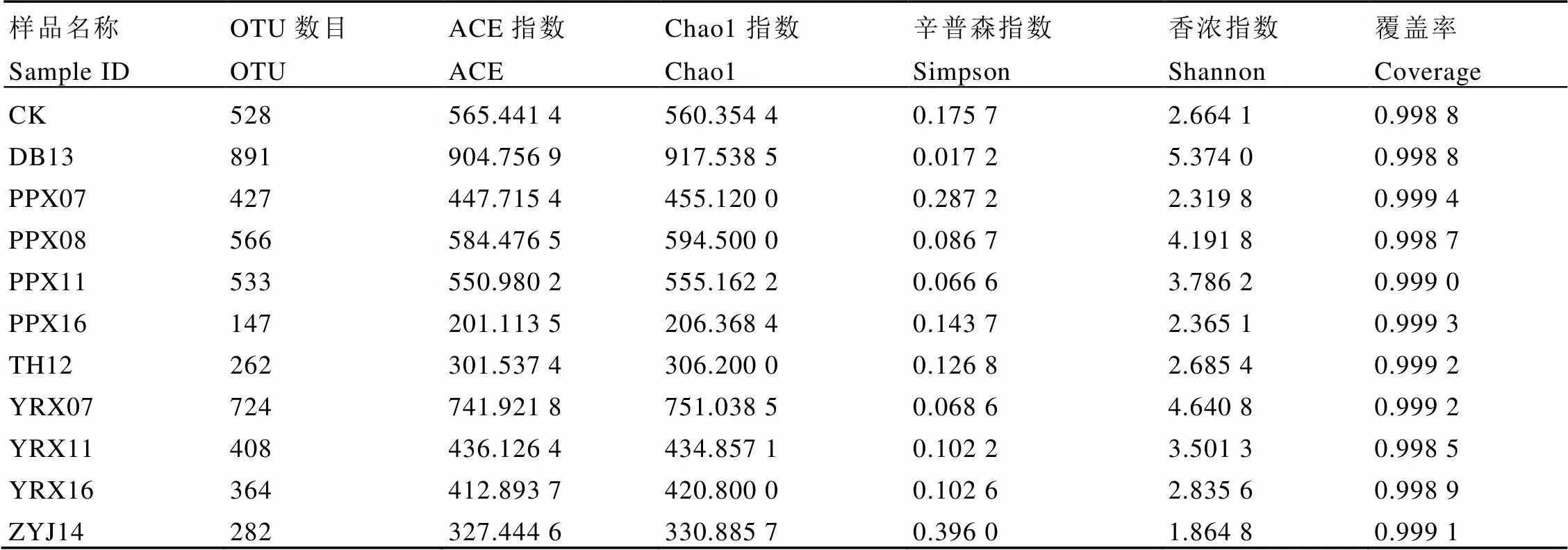
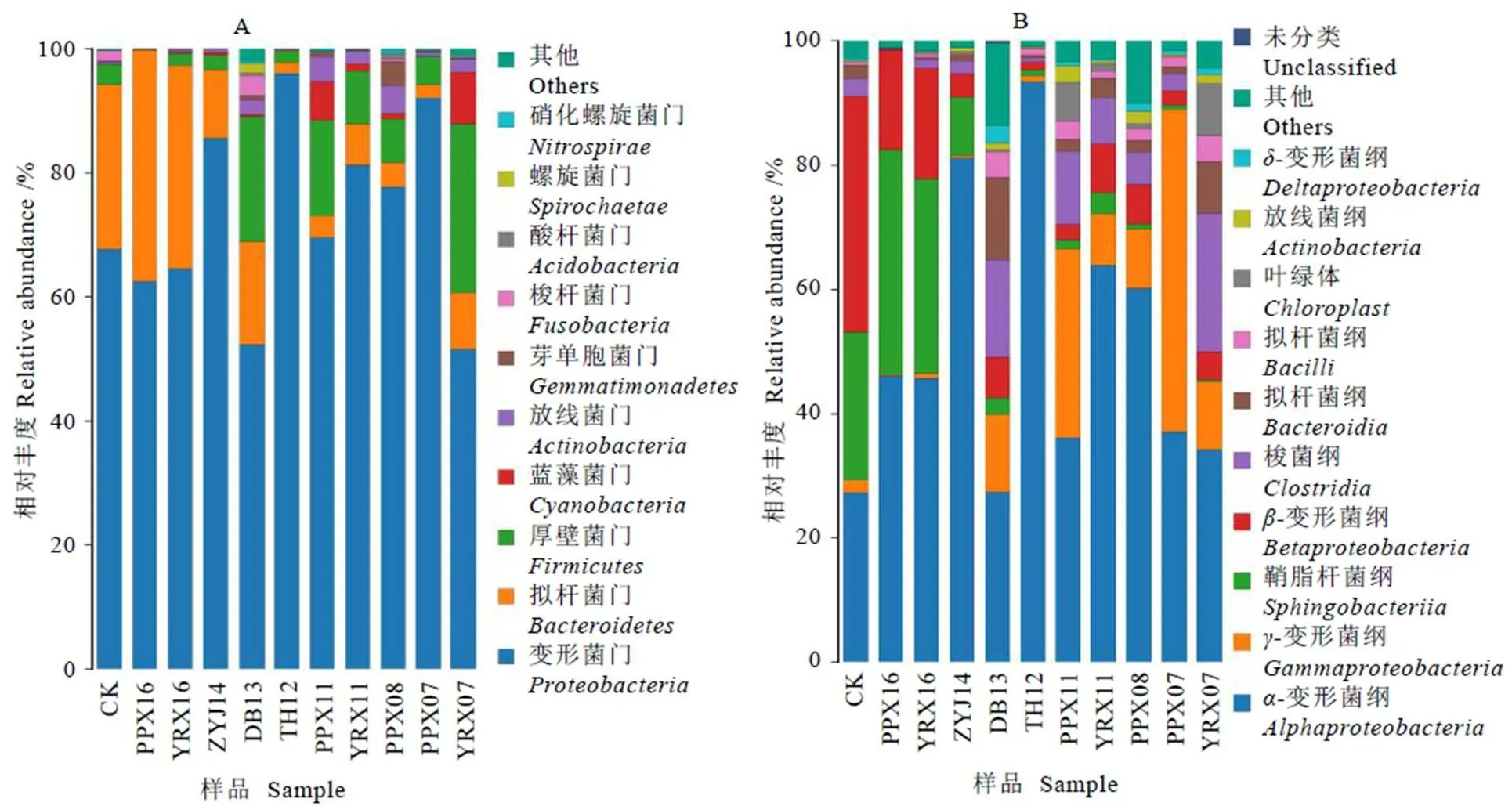
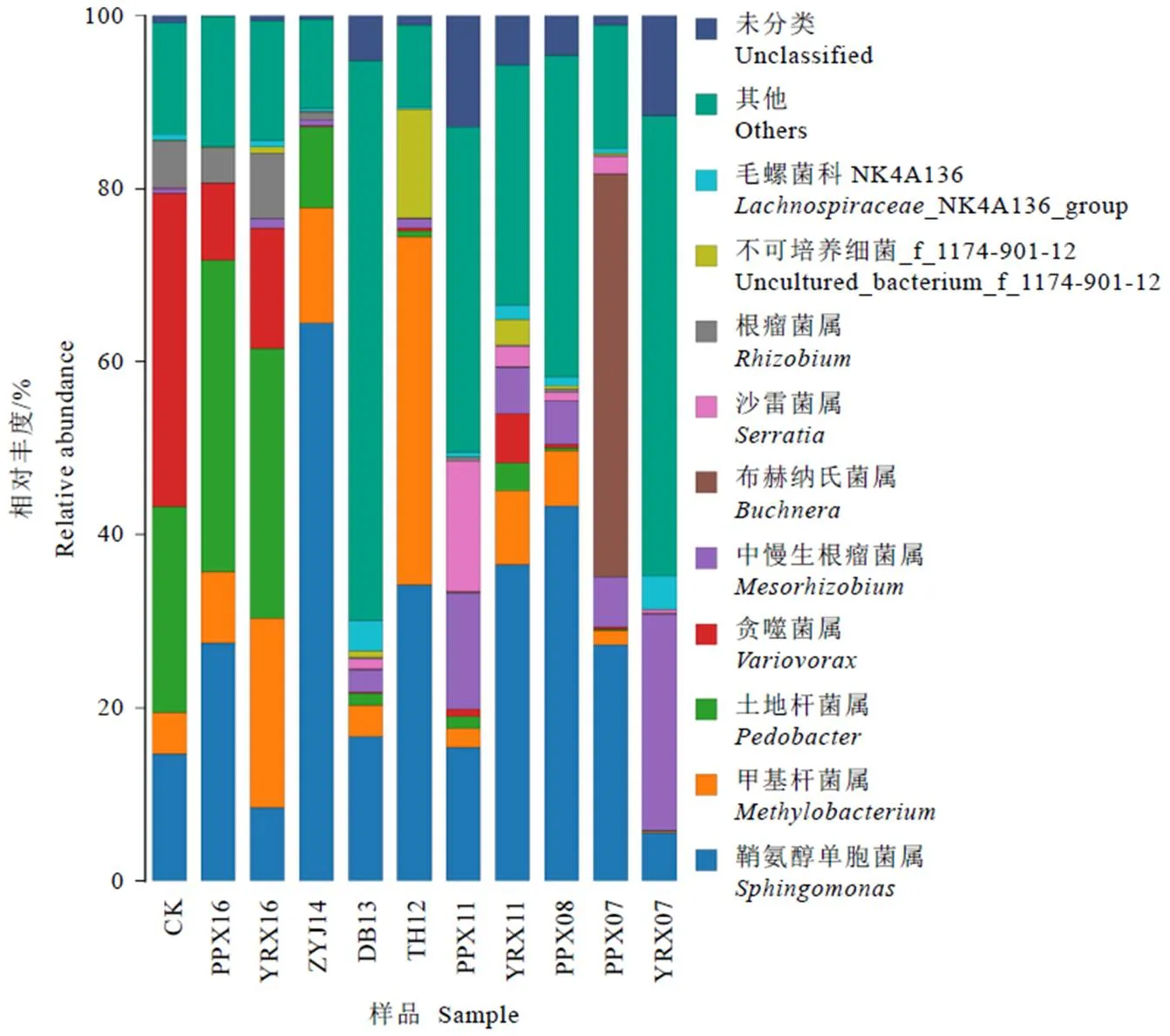
对OTU分析,共获得1 366个OTUs,各样品OTU数在147~891之间,样品间OTU数存在差异(图1)。对同一企业的白牡丹样品进行比较,来自裕荣香的白牡丹样OTU数呈现为:YRX16 表2 样品测序数据处理结果统计 图1 11个样品OTU个数分布图 2.3.1 稀释性曲线 稀释性曲线(Rarefaction curve)可验证测序数据量是否足以反映样品中的物种多样性,反映样品中物种的丰富程度与持续抽样下新物种出现的速率。如图2所示,样本测序数量小于1 000时,随测序数量增加,PPX07、YRX07、PPX08、PPX11、YRX11、DB13的OTU个数急速上升,表示群落中鉴定到大量物种,测序数量大于1 000时,OTU增加趋于平缓,环境中物种不会随测序数量增加而显著增加,测序序列充分;样本测序数量小于4 000时,TH12、ZYJ14、PPX16、YRX16、CK的OTU个数急速上升,大于4 000后,OTU增加趋于平缓,该5个样本测序数据量大于上述6个样本。综上所述,11个样本序列充分,可以用于数据分析。 2.3.2 样品间Alpha多样性分析 Chao1和Ace指数用于衡量物种丰度,Shannon和Simpson指数用于衡量物种多样性。如表3所示,11个样品中DB13的Chao1和Ace指数最高,分别为917.538 5和904.756 9,表明DB13的物种丰度最高;其Shannon指数在11个样品中最高,Simpson指数最低,分别为5.374 0和0.017 2,说明DB13物种多样性最高。PPX16的Chao1和Ace指数最低,分别为206.368 4和201.113 5,表明其物种丰度最低。物种多样性最低的是ZYJ14,其Shannon指数最低,Simpson指数最高。整体上,各样品的Chao1、Ace、Shannon指数均较高,Simpson指数较低,说明物种丰富度及多样性高,表明不同年份白牡丹中均存在着物种丰富的细菌群落。OTU覆盖率反映样本中微生物的真实情况,数值越高,则样本中物种被测出的概率越高。各样品的覆盖率均大于0.998 7,说明绝大部分物种可以被检测出,证实测序质量良好,可以满足后续分析要求。 图2 11个样品稀释性曲线图 表3 贮藏白牡丹Alpha多样性指数 2.4.1 细菌群落分析 11个白牡丹茶样的高通量测序结果共鉴定出266种细菌,涉及2个界,24个门,54个纲,102个目,194个科,373个属。由图3-A可知,在门水平上,优势菌门为变形菌门()、拟杆菌门()、厚壁菌门()等,其中变形菌门是最主要的优势菌门,在所有样品中占比均大于40%,在TH12、PPX07中的占比大于90%。由图3-B可知,在纲水平上,贮藏茶样中的优势菌纲为-变形菌纲()、-变形菌纲()、鞘脂杆菌纲()、-变形菌纲()、梭菌纲()、拟杆菌纲()、芽孢杆菌纲(),其余一些不可识别以及不可培养细菌的占比极小。对上述结果分析发现,在门及纲水平上,相同贮藏年份的白牡丹样品物种组成相似,丰度上存在显著差异,表明物种丰度和年份之间无显著相关性,推测白牡丹表面的细菌可能来自于环境,主要受环境因素的影响。 注:A为细菌门分类;B为细菌纲分类 2.4.2 属水平群落分析 选取属水平上丰度大于5%的物种进行分析发现(图4),不同贮藏年份的白牡丹茶样细菌群落组成相似,丰度较高的菌属均为鞘氨醇单胞菌属()、甲基杆菌属()、土地杆菌属()、贪噬菌属()、中慢生根瘤菌属()、布赫纳氏菌属()、沙雷菌属()、根瘤菌属(),以及毛螺菌科()中未分类的一些菌属。但是在细菌丰度、优势菌属上存在差异,CK中的优势菌属为贪噬菌属()、鞘氨醇单胞菌属()、土地杆菌属()、甲基杆菌属(),而YRX07中的优势菌属为中慢生根瘤菌属()、鞘氨醇单胞菌属()以及毛螺菌科下未分类菌属。属水平下,不同贮藏年份中的细菌群落结构组成相似,物种丰度上存在差异,无明显规律,说明贮藏年份对细菌菌落多样性及结构影响不显著,其年份并非影响菌落多样性的关键因素,与上述在门和纲水平上的分析结果一致。 图4 不同贮藏年份白牡丹细菌属水平的相对丰度统计分析 贮藏白牡丹细菌群落多样性高,丰度大;细菌群落结构相似,物种丰度存在差异。高通量测序结果表明,贮藏茶样中优势菌门主要为变形菌门()、拟杆菌门()、厚壁菌门()等;优势菌纲为-变形菌纲()、-变形菌纲()、鞘脂杆菌纲()、-变形菌纲();优势菌属为鞘氨醇单胞菌属()、甲基杆菌属()。不同贮藏年份白牡丹样品的细菌分析结果表明,群落结构未有规律性变化,菌属种类与贮藏年份无显著相关性,推测白茶表面的细菌主要来源于贮藏环境,而非加工过程,烟草的研究中也存在相似结果[12]。而黑茶后期贮藏中的优势菌与渥堆过程中微生物有直接相关性,渥堆促进部分微生物大量繁殖成为优势菌属,这些优势菌属在后续干燥等加工过程中依然可以存活,随后在后期贮藏过程中这些优势微生物再次繁殖,成为优势菌,使得后期贮藏与渥堆过程中黑茶表面呈现的微生物群落结构相似。研究发现芽孢杆菌属()是普洱茶渥堆发酵及后期贮藏过程中的优势菌属,可证实黑茶后期贮藏过程中的微生物主要来源于加工过程[10,15]。已有研究显示,这些微生物可促进黑茶品质的形成,改善后期加工及贮藏中黑茶的滋味[16]。因此,在白茶贮藏过程中,尤其是一些粗老的白茶,可利用微生物进一步提升其品质,改善其苦涩的口感,增强甜醇的滋味。 不同贮藏条件对微生物群落及动态变化有显著影响,不同贮藏环境下的烟草在细菌群落上存在明显差异[17]。研究表明,适宜的温度、水活度、氧气、pH和充足的养分会促进微生物的生长[18-19]。大部分细菌最适培养温度为25℃~37℃,水活度为0.94以上[20],本试验中所有白牡丹贮藏环境均为常温密封保存,湿度小于50%(水活度小于0.5),该贮藏环境不利于微生物的生长;微生物生长还需要丰富的营养基质,茶叶中(碳水化合物、蛋白质等)营养基质贫乏,同时白茶在加工过程中经过干燥后,水分含量低,不适合微生物的繁殖,并且多酚等物质具有显著抑菌作用[21],抑制微生物的生长。综上所述,白牡丹贮藏时微生物不易大量繁殖,未形成优势菌属。本研究发现,贮藏白牡丹表面细菌中丰度较高的是一种广泛存在于环境中的细菌——鞘氨醇单胞菌属(),除此之外未检测到其他在贮藏白茶中大量富集的细菌群落,证实在该白茶贮藏环境中细菌的群落相对稳定。贮藏条件的改变均有可能引起细菌多样性及丰度变化。近年来,已有大量研究对贮藏条件进行探究,旨在通过调控贮藏条件改善茶叶品质,研究结果显示适当温、湿度可以加快贮藏白茶品质的转变[22],但是白茶贮藏转化需要适度环境,要兼顾微生物安全。因为环境条件会影响细菌生长,因此在白茶贮藏过程中要严格把控环境因子,尤其是温度、湿度与氧气,加强安全监管,减少有害细菌富集。 [1] 刘谊健, 郭玉琼, 詹梓金. 白茶制作过程主要化学成分转化与品质形成探讨[J]. 福建茶叶, 2003(4): 13-14. Liu Y J, Guo Y Q, Zang Z J. Analysis of the transformation of main chemical components and quality formation of white tea [J]. Tea in Fujian, 2003(4): 13-14. [2] 皇甫瑞娟. 茯砖茶中冠突散囊菌的分离鉴定[J]. 现代食品, 2019(23): 183-185.Huangfu R J. Isolation and identification offrom Fuzhuan tea [J]. Modern Food, 2019(23): 183-185. [3] 曾桥, 吕生华, 李祥, 等. 不同原料茯砖茶活性成分及微生物多样性分析[J/OL]. 食品科学, 2020: 1-12. http://kns.cnki.net/kcms/detail/11.2206.TS.20191219.1855.018.html.Zeng Q, Lv S H, Li X, et al. Active ingredients and microbial diversity of Fu brick tea produced by different raw materials [J/OL]. Food Science, 2020: 1-12. http://kns.cnki.net/kcms/detail/11.2206.TS.20191219.1855.018.html. [4] 葛慈斌,刘波,陈梅春, 等. 不同年份陈年普洱茶中芽胞杆菌的多样性[J]. 农业生物技术学报, 2017, 25(8): 1336-1348. Ge C B, Liu B, Chen M C, et al. Diversity of the bacillus-like species in the different year-old fermented Pu-erh tea [J]. Journal of Agricultural Biotechnology, 2017, 25(8): 1336-1348. [5] 方欣, 骆爱国, 涂青, 等. 普洱茶(熟茶)发酵过程各层间真菌群落的动态变化[J]. 食品科技, 2019, 44(5): 37-42.Fang X, Luo A G, Tu Q, et al. Fungal community dynamic change in different layers of solid-state fermentation of Pu-erh ripe tea [J]. Food Science and Technology, 2019, 44(5): 37-42. [6] 杨吉霞, 曾祥平, 蒲慧敏, 等. 陕西茯砖茶微生物多样性和群落结构的研究[J]. 食品与发酵工业, 2020, 46(3): 50-57. Yang J X, Zeng X P, Pu H M, et al. An investigation of the microbial diversity and community structure in Shaanxi Fu brick tea [J]. Food and Fermentation Industries, 2020, 46(3): 50-57. [7] 杨雅焯, 汪迎, 李辉, 等. 广西六堡茶和重庆沱茶的微生物多样性分析[J]. 茶叶学报, 2019(3): 93-98. Yang Y Z, Wang Y, Li H, et al. Microbial diversity of Guangxi Liubao and Chongqing Bowl teas [J]. Acta Tea Sinica, 2019(3): 93-98. [8] 路伟尧. 普洱茶发酵微生物的溯源分析[D]. 北京: 北京化工大学, 2013. Lu W Y. Analysis of microbial tracking in Pu’er tea fermentation [D]. Beijing: Beijing University of Chemical Technology, 2013. [9] 陈丽莹, 张玉满, 陈晓英, 等. 茶树叶际选择性富集的内生细菌的鉴定[J]. 微生物学报, 2018, 58(10): 1776-1785. Chen L Y, Zhang Y M, Chen X Y, et al. Identification of endophytic bacteria selectively enriched inleaf [J]. Microbiology China, 2018, 58(10): 1776-1785. [10] 林长欣. 普洱茶中的风味成分及微生物在贮藏过程中的变化[D]. 广州: 暨南大学, 2010. Lin C X. Flavor compounds and microorganisms in Pu'er tea at different storage period [D]. Guangzhou: Jinan University, 2010. [11] 龚俊. 烤后片烟储存过程中微生物多样性及变化动态[D]. 上海: 华东师范大学, 2015. Gong J. The diversity and dynamic of microorganism on fluecured tobacco leaves during different aged phases [D]. Shanghai: East China Normal University, 2015. [12] 周家喜. 不同仓储环境微生物群落对烟叶陈化品质的影响[D]. 贵阳: 贵州大学, 2017. Zhou J X. Effects of microbial communities on quality of tobacco leaves in different storage environments [D]. Guiyang: Guizhou University, 2017. [13] Wang Y, Sheng H F, He Y, et al. Comparison of the levels of bacterial diversity in freshwater, intertidal wetland, and marine sediments by using Millions of Illumina Tags [J]. Applied and Environmental Microbiology, 2012, 78(23): 8264-8271. [14] Kong H, Conlan S, Grice E A, et al. Topographical and temporal diversity of the human skin microbiome [J]. Science, 2009, 324(5931): 1190-1192. [15] 姚静, 陈迪, 郑晓燕, 等. 普洱茶渥堆发酵过程中细菌种群的分离与分子鉴定[J]. 安徽农业科学, 2013, 41(6): 2667-2671. Yao J, Chen D, Zheng X Y, et al. Isolation and molecular identification of bacterial colonization during the pile fermentation process of Pu-er tea [J]. Journal of Anhui Agricultural Sciences, 2013, 41(6): 2667-2671. [16] 徐正刚, 吴良, 刘石泉, 等. 黑茶发酵过程中微生物多样性研究进展[J]. 生物学杂志, 2019, 36(3): 92-95.Xu Z G, Wu L, Liu S Q, et al. Review for development of microbial diversity during dark tea fermentation period [J]. Journal of Biology, 2019, 36(3): 92-95. [17] Jessica C, Suhana C, Prachi K, et al. Temporal variations in cigarette tobacco bacterial community composition and tobacco-specific nitrosamine content are influenced by brand and storage conditions [J]. Frontiers in Microbiology, 2017, 8: 358. doi: 10.3389/fmicb.2017.00358. [18] Kinkel L. Microbial population dynamics on leaves [J]. Annual Review of Phytopathology, 1997, 35(1): 327-347. [19] Di Giacomo M, Paolino M, Silvestro D, et al. Microbial community structure and dynamics of dark fire-cured tobacco fermentation [J]. Applied and Environmental Microbiology, 2007, 73(3): 825-837. [20] 何国庆. 食品微生物学[M]. 北京: 中国农业大学出版社, 2009. He G Q. Food microbiology [M]. Beijing: China Agricultural University Press, 2009. [21] Bansal S , Choudhary S , Sharma M , et al. Tea: A native source of antimicrobial agents [J]. Food Research International, 2013, 53(2): 568-584. [22] 祁丹丹, 陈维, 苗爱清, 等. 气相色谱-串联质谱结合化学计量学分析快速陈化对白茶香气的影响[J]. 浙江大学学报(农业与生命科学版), 2018, 44(6): 704-710. Qi D D, Chen W, Miao A Q, et al. Effects of rapid ageing technology on the aroma quality of white tea using gas chromatography-mass spectrometry/mass spectrometry combined with chemometrics [J]. Journal of Zhejiang University (Agric. & Life Sci.), 2018, 44(6): 704-710. Analysis of Bacterial Diversity of Stored White Peony by High-Throughput Sequencing CHEN Jiajia1,2,4, HU Yunfei2,3,4, SHEN Shiyu1,2,4, WANG Zhihua1,2,4, ZHOU Zhe1,2,4, TANG Qin1,2,4, SUN Weijiang1,2,3,4* 1. College of Horticulture, Fujian Agriculture and Forestry University, Fuzhou 352000, China; 2. Industrial Technology Development Base in Fujian Province, Fuzhou 350002, China; 3. Anxi College of Tea Science, Fujian Agriculture and Forestry University, Quanzhou 362400, China; 4. Tea Industry Engineering Technology Research Center of Fujian Province, Fuzhou 350002, China To investigate the diversity of the bacterial communities in stored white peony, 16 S rDNA of bacteria collected from 11 samples of different storage durations were analyzed by high-throughput sequencing. The results show that the species richness and diversity of DB13 were the highest. While in all stored white peony, the dominant phylum wereand. The dominant class wereand.And the dominant bacterial species at genus level include:.The composition structures of samples were similar, but there was difference in their abundance. Storage duration had no significant effect on the bacteria composition of white peony, but environments played important roles. high-throughput sequencing, white peony, bacteria, diversity S571.1 A 1000-369X(2020)04-519-09 2019-12-23 2020-03-02 国家重点研发计划项目(2016YFF0201904-03)、国家自然科学基金项目(31770732)、福建农林大学茶产业链科技创新与服务体系建设 陈佳佳,女,硕士研究生,主要从事茶叶加工方面的研究,1160576736@qq.com。 swj8013@126.com 投稿平台:http://cykk.cbpt.cnki.net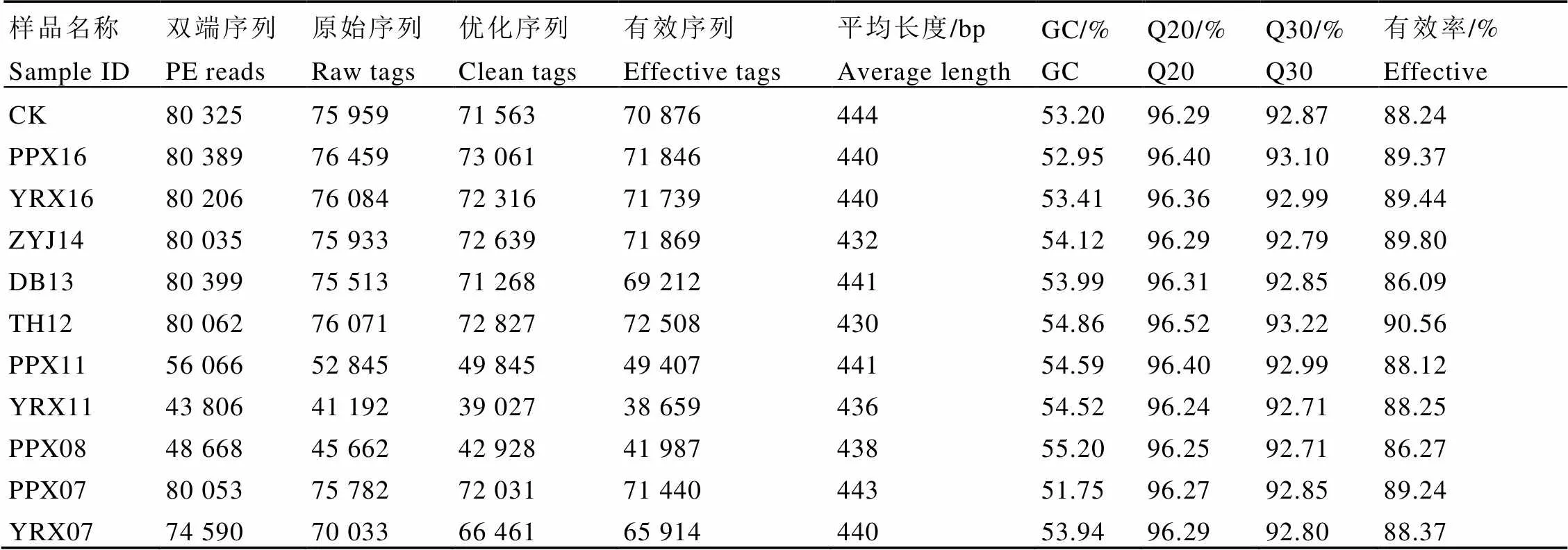
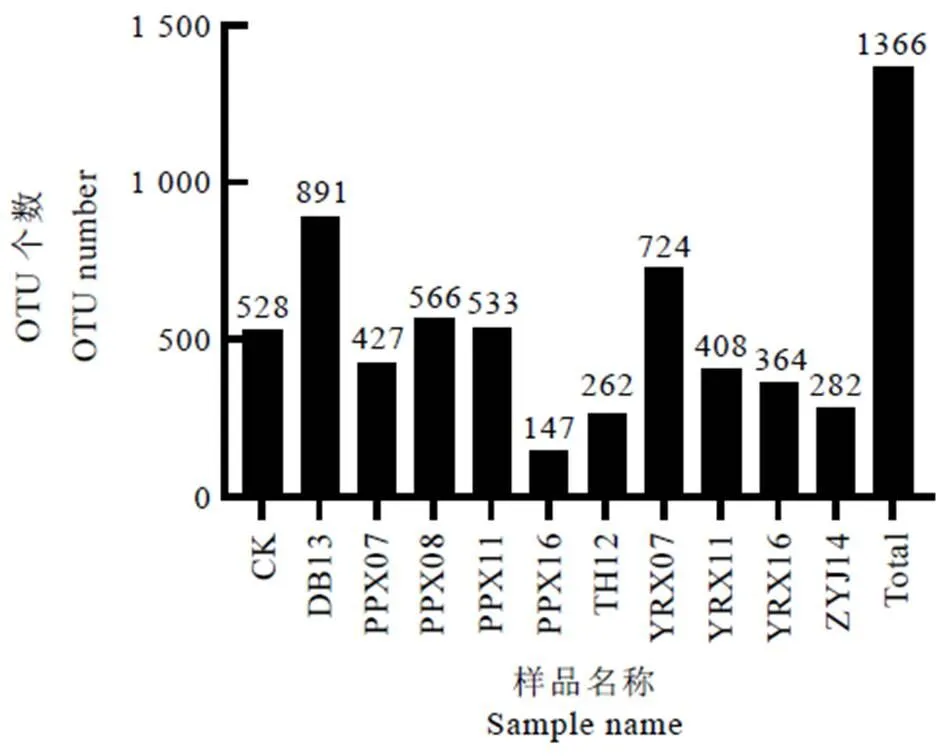
2.3 样品丰富度分析
2.4 样品间细菌群落结构分析
3 讨论
3.1 贮藏白牡丹细菌群落结构
3.2 贮藏环境对白牡丹细菌群落的影响

