蚕丝蛋白纤维的体外消化模拟研究
魏子凯 丁绍敏 陆敏兴 林海涛

摘要: 为了了解蚕丝蛋白纤维在消化系统的消化分解作用后的变化情况,通过体外消化模拟实验,探究了蚕丝蛋白纤维在经过人工胃液和人工肠液的消化分解作用后的形貌变化,并运用扫描电镜、SDS-聚丙烯酰胺凝胶电泳和粒径分布检测方法,测定蚕丝蛋白纤维的形貌和长度变化。结果表明:蚕丝蛋白纤维在人工胃液和人工肠液的消化分解作用后,整体外观呈纤维短棒状,表面较为平滑,两端不规则,粒径在0.5~100 μm呈对数正态分布。
关键词: 蚕丝蛋白纤维;人工消化液;消化分解;形貌变化;粒径分布
Abstract: In order to understand the changes of silk protein fiber after digestion and decomposition in the digestive system, the in vitro digestion simulation experiment was carried out to explore the morphology changes of silk protein fiber after digestion and decomposition through artificial gastric juice and artificial intestinal juice, and the morphology and length changes of silk protein fiber were determined by the means of scanning electron microscope, SDS-polyacrylamide gel electrophoresis and particle size distribution detection. The results showed that the silk protein fibers were short rod-like with smooth surface and irregular ends after digestion and decomposition by artificial gastric juice and artificial intestinal juice, and the particle size distribution presented logarithmic normal distribution, with the particle size of 0.5~100 μm.
Key words: silk protein fiber; artificial digestive juice; digestion; morphology changes; particle size distribution
近年来,随着国内外研究者对蚕丝结构及其改性研究的不断深入,蚕丝已不仅是传统的纺织材料,还作为新型多功能材料受到众多学者的青睐,呈现出欣欣向荣的景象[1]。目前,蚕丝已经成为保健食品、医药材料[2-3]、生物制药[4-6]、功能材料[7]等领域的研究热点,将成为新一代的安全、绿色、环保材料。
蚕丝是由外部丝胶蛋白和内部丝素蛋白两部分组成,几乎全部是蛋白质,丝胶蛋白约占30%,丝素蛋白约占70%[8]。其中,丝素蛋白中非极性氨基酸占比较大,具有良好的疏水性、力学性能和生物相容性[9-10],这也是蚕丝蛋白成为生物医药材料的重要原因之一。但大多数研究将蚕丝蛋白溶解为小分子多肽作为辅助材料加以利用,这样不仅会对蚕丝自身固有的结构造成破坏,同时,还会增加蚕丝溶解、多肽合成的工艺流程及成本。因此,本文通过体外模拟蚕丝蛋白纤维在消化系统中的消化过程,探究蚕丝蛋白纤维在经过人工消化液的消化作用后的形貌变化,为其直接作为新型的药用材料或食用载体材料做出一定的指导。
1 实 验
1.1 材 料
主要实验材料与试剂如表1所示。
1.2 设 备
主要实验仪器型号与规格如表2所示。
2 方 法
2.1 蚕丝蛋白纤维的制备
按照参考文献[11]中蚕丝蛋白纤维的制备方法,將5%的NaOH溶液与尿素按1︰6的质量之比溶解,放入适量蚕茧,在65 ℃的水浴锅中恒温加热45 min,得到长度为2~3 mm的蚕丝蛋白短纤维。
2.2 消化液的配制
2.2.1 人工胃液的配制
按照2015版《中国药典》第三部[12]中生物制品要求,取稀盐酸16.4 mL,加水约800 mL与胃蛋白酶10 g,摇匀使其充分溶解后,调节pH值至1.3,加水稀释定容至1 000 mL,即为人工胃液。
空白人工胃液的配制不含胃蛋白酶,其余与人工胃液配制相同。
2.2.2 人工肠液的配制
按照2015版《中国药典》第三部[12]中生物制品要求,取磷酸二氢钾6.8 g,加水500 mL使其溶解,用0.1 mol/L氢氧化钠溶液调节pH值至6.8;另外称取10 g胰蛋白酶加适量水溶解,将两液混合后,加水定容至1 000 mL,即为人工肠液。
空白人工肠液的配制不含胰蛋白酶,其余与人工肠液配制相同。
2.3 实验设计
2.3.1 人工胃液消化实验设计
实验组:称量0.3 g蚕丝蛋白短纤维放入若干玻璃试管中,添加10 mL人工胃液,封口;置于37.3 ℃的恒温振荡水浴锅中,每5 min手晃动一次,观察并记录2.0、2.5、3.0、3.5、4.0 h的变化情况。
对照组:称量0.3 g蚕丝短纤维放入若干玻璃试管中,添加10 mL相同pH值的无酶空白人工胃液,封口;置于37.3 ℃的恒温振荡水浴锅中,每5 min手晃动一次,观察并记录2.0、2.5、3.0、3.5、4.0 h的变化情况。
2.3.2 人工肠液消化实验设计
实验组:取人工胃液消化实验4 h后的溶液过滤,将蚕丝蛋白短纤维加入若干个盛有等量人工肠液的试管中,封口;置于37.3 ℃的恒温振荡水浴锅中,每5 min手晃动一次,每隔2.0 h取样观察。
对照组:取人工胃液消化实验4 h后的溶液过滤,将蚕丝蛋白短纤维加入盛有等量无酶空白人工肠液的试管中,封口;置于37.3 ℃的恒温振荡水浴锅中,每5 min手晃动一次,每隔2.0 h取样观察。
2.4 光学显微镜检测
取适量经溶解、干燥处理后的蚕丝蛋白短纤维放在载玻片上,制备成临时装片,用光学显微镜对溶解后的蚕丝蛋白纤维进行观察,观察蚕丝蛋白纤维的溶解程度,测定溶解后蚕丝蛋白纤维的长度,并拍照记录。
2.5 电子显微镜观察
将人工胃液和人工肠液消化处理后的蚕丝蛋白干燥,去除上部凝结、粘连的蛋白块,取适量下层沉淀的蛋白粉末进行观察,观察其形貌变化。
2.6 SDS-聚丙烯酰胺凝胶电泳
2.6.1 缓冲液的配制
30%Acr的配制:将29.2 g丙烯酰胺和0.8 g N,N-甲叉双丙烯酰胺放入烧杯中,用适量的去离子水充分溶解,直至透明,然后转移到100 mL容量瓶中,定容至100 mL。将配制好的溶液摇匀,储存在棕色瓶中,在4 ℃的冰箱中保存。
0.5 M的Tris-HCl液的配制:将6 g的三羟基氨基甲烷(Tris)溶解于60 mL去离子水中,用浓盐酸调节pH值至6.8,然后用容量瓶定容至100 mL,在4℃的冰箱中保存。
1.5 M的Tris-HCl液的配制:将18.15 g的三羟基氨基甲烷(Tris)溶解于80 mL去离子水中,用浓盐酸调节pH值至88,然后用容量瓶定容至100 mL,在4 ℃的冰箱中保存。
10%SDS的配制:将10 g SDS溶解于80 mL的水中,并在68 ℃的水浴中加热助溶,充分溶解后用浓盐酸调节pH值至7.2,加水定量至100 g,在4 ℃冰箱中保存备用。
20%SDS的配制:将20 g SDS溶解于80 mL的水中,并在68 ℃的水浴中加热助溶,充分溶解后用浓盐酸调节pH值至7.2,加水定量至100 g,在4℃冰箱中保存备用。
10%过硫酸铵的配制:将1 g过硫酸铵溶解于10 g的去离子水中,在4 ℃的冰箱中保存备用。
另外,2倍样品缓冲液的配制如表3所示;电极缓冲液的配制如表4所示。
Mark蛋白样品的配制[13]:将20 μL的标准蛋白溶解于200 μL的去离子水中,平均分装在20个1.5 mL的离心管内(每个离心管内10 μL),再将等体积的2倍样品缓冲液加入离心管中,然后将其置于沸水中加热5 min,待冷却后置于-20 ℃下保存备用。使用前,取出样品在室温条件下融化后,在沸水中加热3~5 min后再上样。
固定液的配制:将无水乙醇500 mL、冰乙酸100 mL和去离子水400 mL充分混合、摇匀,转移至棕色瓶中保存。
染色液的配制:将甲醇500 mL,冰乙酸100 mL和去离子水400 mL混合、摇匀,加入0.5 g考马斯亮蓝R-50充分溶解。
脫色液的配制:甲醇50 mL,冰乙酸75 mL,去离子水875 mL充分混合、摇匀。
2.6.2 浓缩胶和分离胶的配制
4%浓缩胶的配制如表5所示;13%分离胶的配制如表6所示。
2.7 粒径测定
丝素蛋白是一种纤维状的蛋白,含有非极性氨基酸比例较大,因此丝素蛋白分子亲水性很差。当蚕丝蛋白短纤维被消化液酶解之后,存在不易溶于水的蚕丝蛋白纤维残段,无法测定其相对分子质量。所以,可以通过检测消化酶解后的蚕丝蛋白纤维残段的粒径,来反映它的消化、分解程度。本文将经过人工胃液溶解后的溶液干燥,利用马尔文激光粒度仪测定消化溶解后的蚕丝蛋白纤维粒径,用去离子水作为分散液,将样品添加到分散液中,然后测定蚕丝蛋白纤维残段的大小。由于蚕丝蛋白纤维残段的粒径为非正态分布对称,向大颗粒方向偏高,因此采用对数正态分布进行分析。
3 结果与分析
3.1 人工胃液消化电镜图
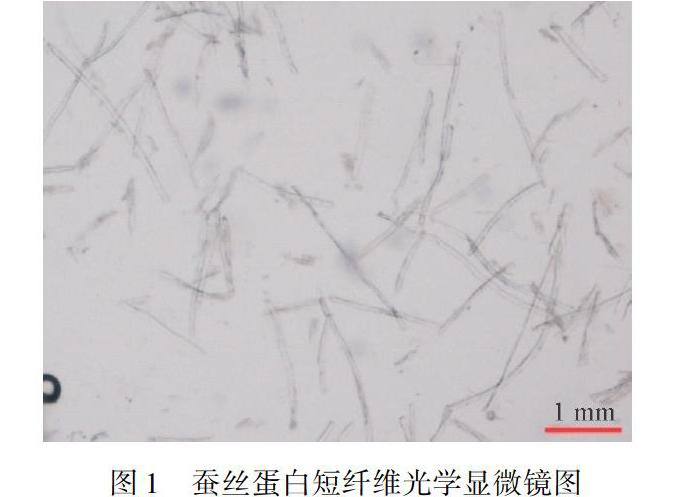
图1为蚕丝蛋白短纤维光学显微镜图,图2为蚕丝蛋白短纤维在人工胃液中消化分解的电镜图。从图1可以看出,蚕丝蛋白短纤维的长度为2~3 mm,而图2(a)中大多数蚕丝蛋白短纤维的长度在100~200 μm,也有少部分纤维长度在200~400 μm;图2(b)中纤维的长度分布在100 μm左右,大多数为100 μm以下,说明蚕丝蛋白短纤维经人工胃液消化作用后,没有被完全溶解,依然为纤维状态,长度从毫米级变为微米级的短纤维。同时,图2(a)中的蚕丝蛋白短纤维的平均长度长于图2(b)中的纤维长度,图2(a)中长纤维的数量也较多,说明蚕丝蛋白短纤维在人工胃液中停留时间越长,人工胃液的消化作用使蚕丝蛋白纤维的平均长度消化变短。
图2(c)中蚕丝蛋白短纤维的长度分布不均匀,大多数纤维长度分布在200~300 μm,还有500 mm以上的长纤维存在;与图2(b)对比来看,说明实验组的人工胃液对蚕丝蛋白短纤维的溶解力较强,胃蛋白酶对蚕丝蛋白有一定的分解作用。
3.2 人工肠液消化电镜图
图3为蚕丝蛋白短纤维在人工肠液中消化分解的电镜图(实验组电镜图放大倍数为1 000倍),由于对照组蚕丝蛋白纤维较长,为了更好地观察,对照组电镜图放大倍数为500倍。从图3可以看出,蚕丝蛋白短纤维依然为纤维状,其中图3(a)纤维的长度在30~50 μm,直径小于10 μm,图3(b)纤维的长度分布在10~20 μm,直径小于10 μm,蚕丝蛋白短纤维经人工胃液和肠液的共同消化作用后,纤维长度变为十几微米,且作用时间越长,纤维长度越短,说明了蚕丝蛋白短纤维能以纤维形态在人工肠液中存在4.0 h以上;两者相比,说明蚕丝蛋白短纤维在人工肠液中随着停留时间增加,纤维长度在不断减短,逐渐被消化系统分解,甚至吸收。图3(c)中蚕丝蛋白短纤维的长度大部分在40~60 μm,也有100 μm以上的长纤维存在,直径大于10 μm;与图3(b)对比来看,说明实验组的人工胃液对蚕丝蛋白短纤维的溶解力较强,胰蛋白酶对蚕丝蛋白也有一定的分解作用。
3.3 SDS-聚丙烯酰胺凝胶电泳分析
图4为对照组和实验组中蚕丝蛋白纤维在人工消化液作用后的蚕丝蛋白分子SDS凝胶电泳图。从图4可以看出,对照组和实验组的蛋白分子电泳图中只有Mark标准蛋白的条带,都没有显示出其他的蛋白条带,说明蚕丝蛋白纤维在经过人工胃液消化之后,未能分解成相对分子质量为14.4~97.4 kDa的小分子蛋白,间接地说明蚕丝蛋白纤维在人工胃液中消化4.0 h后仍然为大分子蛋白。这是因为人工胃液中的胃蛋白酶有专一性,在特定的位点才会发生作用,不能水解复杂空间结构的蚕丝纤维结晶区[14]。同时,也证明蚕丝蛋白短纤维经过消化液的作用后是可以以百微米级的纤维态形状到达小肠,且依然保持良好的疏水性,能起到膳食纤维添加剂的作用,也可以起到抗消化载体的效果。
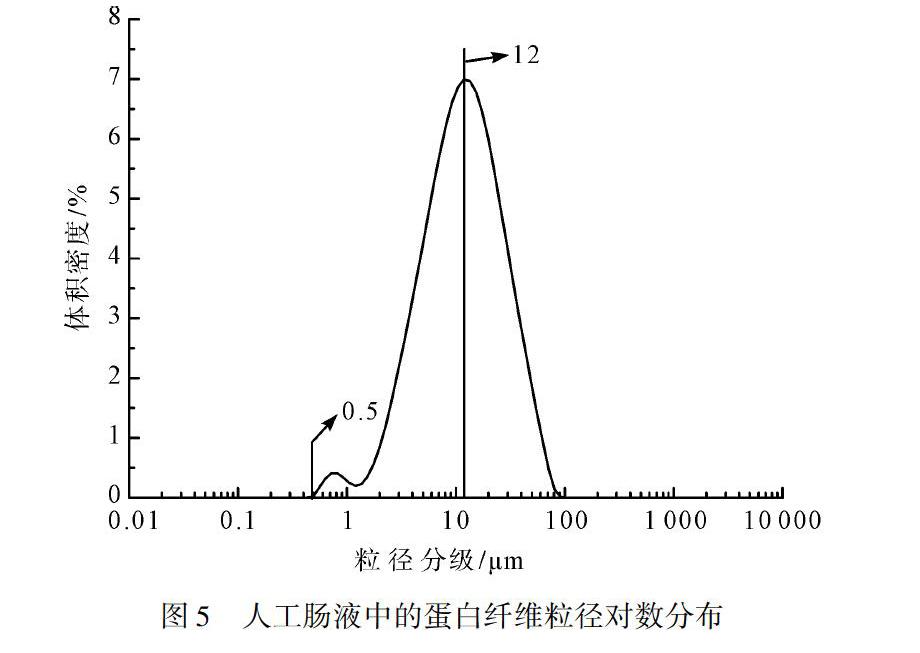
3.4 粒径分析
图5为蚕丝蛋白短纤维经过人工胃液消化作用后,在人工肠液中继续消化4.0 h后的粒徑分布图。从图5可以看出,蚕丝蛋白短纤维的粒度分级在0.5~100 μm呈对数正态分布,体积密度在粒度分级为12 μm左右达到最大值。说明经过体外消化模拟实验以后,蚕丝蛋白纤维在人工胃液的消化作用下,由原来的1~3 mm的长度变为几十到几百微米且粒径更小的纤维。同时,由对数正态分布的特点可知,粒度分级在0.5~12 μm的体积密度和12~100 μm的体积密度相同,说明长度在12 μm左右的蚕丝蛋白短纤维数量居多,有一半以上的蚕丝蛋白纤维长度分布在12~100 μm。因此,蚕丝蛋白纤维在到达肠道时,其纤维长度主要分布在12 μm左右,且仍然为高分子蛋白的纤维状态。
4 结 语
通过体外消化模拟实验,蚕丝蛋白纤维在人工胃液和人工肠液的消化作用下,蚕丝蛋白纤维依然呈纤维状,且表面比较平整光滑,两端呈不规则状,粒径在0.5~100 μm,并以12 μm为中线呈对数正态分布。说明蚕丝蛋白纤维在人工消化液中不易分解,可以应用在药用材料或食用载体材料当中,能很好地发挥其天然优势。
参考文献:
[1]封平. 蚕丝蛋白的结构及食用性研究[J]. 食品研究与开发, 2004, 25(6): 51-54.
FENG Ping. The study of structure and edidility of silk protein[J]. Food Research and Development, 2004, 25(6): 51-54.
[2]刘凯, 匡大江, 王诗怡, 等. 蚕丝蛋白用作胶囊壳材料的研究[J]. 丝绸, 2018, 55(12): 6-11.
LIU Kai, KUANG Dajiang, WANG Shiyi, et al. Study on silk protein used as capsule shell material[J]. Journal of Silk, 2018, 55(12): 6-11.
[3]马艳, 李智, 冉瑞龙, 等. 蚕丝在生物医用材料领域的应用研究[J]. 材料导报, 2018, 32(1): 86-90.
MA Yan, LI Zhi, RAN Ruilong, et al. Research on application of silk in biomaterial field[J]. Materials Reviews, 2018, 32(1): 86-90.
[4]陈永峰, 郑德宇, 郭闻师. 柞蚕丝素蛋白和壳聚糖复合材料的制备及其生物学特性[J]. 武汉大学学报, 2019, 40(1): 84-89.
CHEN Yongfeng, ZHENG Deyu, GUO Wenshi. Preparation of the artificial scaffold formed by tussah silk fibroin/chitosan and its biological properties research[J]. Journal of Wuhan University, 2019, 40(1): 84-89.
[5]吴惠英, 周燕, 左保齐. 丝素蛋白纤维人工韧带的制备及性能分析[J]. 丝绸, 2016, 53(7): 1-6.
WU Huiying, ZHOU Yan, ZUO Baoqi. Preparation of artificial ligament with silk fibroin and analysis of its property[J]. Journal of Silk, 2016, 53(7): 1-6.
[6]王鹏, 左保齐. 不同盐/甲酸溶解体系下丝素膜的制备及性能表征[J]. 丝绸, 2016, 53(7): 18-22.
WANG Peng, ZUO Baoqi. Preparation of silk fibroin films in different salt/formic acid dissolution system and its property characterization[J]. Journal of Silk, 2016, 53(7): 18-22.
[7]徐亚梅, 李明忠. 蚕丝丝素蛋白材料在生物降解性能研究进展[J]. 丝绸, 2011, 48(5): 19-21.
XU Yamei, LI Mingzhong. Research progress of biodegradation properties of silkworm silk fibroin materials[J]. Journal of Silk, 2011, 48(5): 19-21.
[8]MONDAL M, TRIVEDY K, KUMAR S N. The silk proteins, sericin and fibroin in silkworm, Bombyx mori Linn: a review[J]. Caspian Journal of Environmental Sciences, 2007, 5(2): 63-76.
[9]吴惠英. 再生丝素蛋白纤维及其在生物医用材料中的研究進展[J]. 丝绸, 2017, 54(3): 6-12.
WU Huiying. Research progress in regenerated silk fibroin fiber and its application in biomedical materials[J]. Journal of Silk, 2017, 54(3): 6-12.
[10]ZUBIR N, PUSHPANATHAN K. Silk in biomedical engineering: a review[J]. International Journal of Engineering Inventions, 2016, 5(8): 18-19.
[11]魏子凯, 丁绍敏, 陆敏兴, 等. 蚕丝蛋白短纤维的制备方法[J]. 丝绸, 2019, 56(7): 28-33.
WEI Zikai, DING Shaomin, LU Minxing, et al. Preparation methods of silk protein short fibers[J]. Journal of Silk, 2019, 56(7): 28-33.
[12]国家药典委员会. 中华人民共和国药典: 三部[S]. 北京: 中国医药科技出版社, 2015.
Chinese Pharmacopoeia Commission. Pharmacopoeia of the Peoples Republic of China: Three[S]. Beijing: China Medical Science Press, 2015.
[13]张小平. 高分子量丝素蛋白的制备及其纺丝的研究[D]. 苏州: 苏州大学, 2014.
ZHANG Xiaoping. High Molecular Weight Silk Fibroin Used in Spinning[D]. Suzhou: Soochow University, 2014.
[14]任培华. 用酶水解结合盐溶解的方法制备丝素肽[J]. 蚕业科学, 2015, 41(4): 768-772.
REN Peihua. Preparation of silk fibroin peptide by enzymatic hydrolysis combined with salt bath[J]. Science of Sericulture, 2015, 41(4): 768-772.

