基于拉曼光谱快速检测亚氯酸钠法脱木素的动力学及选择性
金克霞, 江泽慧, 马建锋, 田根林, 杨淑敏, 尚莉莉, 冯 龙, 刘杏娥
国际竹藤中心, 竹藤科学与技术重点实验室, 北京 100102
引 言
酸性亚氯酸钠法是目前实验室最常用的木质素脱除方法, 在脱木质素过程中可最大程度地保留综纤维素不被脱除[1]。 研究表明木质素脱除是一个极其复杂的反应过程, 不仅受到细胞壁中木质素-碳水化合物复合体联结类型的影响, 而且木质素大分子间不同化学键合类型, 对试剂的反应程度也不一样[2-4]。 因此, 不同的木质纤维素原料脱木素的动力学表现也存在着差异[5]。 然而, 学者们在用亚氯酸钠法脱木素时, 其处理时间常常以经验性为主, 常用的表征残余木质素含量的方法, 如离子色谱、 红外光谱、 核磁共振等, 不仅制样繁琐、 耗时, 且反映的信息是植物细胞壁的总体平均结果, 关于脱木质素过程中木质素含量在不同细胞及形态学区域的动态变化方面的有效信息相对较少。
拉曼光谱及显微成像具有快速、 简单、 无损、 可重复检测的特点, 同时具有较高的空间和光谱分辨率, 已广泛应用于分子化学结构研究和化学组成分析[6]。 此外, 木质素三种基本结构单元, 即愈疮木基(G)、 紫丁香基(S)和对羟苯基在拉曼光谱中均有特定的特征峰[7]。 因此, 本文拟采用拉曼光谱及显微成像技术, 以阔叶木(桉木)、 针叶木(杉木)、 禾本科(毛竹)中最常见的树种为例, 定性和半定量地测定亚氯酸钠法脱木素过程中残余木质素及单体含量在不同细胞及形态学区域的动态变化, 以加深对亚氯酸钠法脱木素的动力学及选择性的理解。
1 实验部分
1.1 原料
桉木(Eucalyptusurophylla), 高15.6 m, 直径16.5 cm, 采自北京林业大学林场; 杉木(Cunninghamialanceolate(Lamb.) Hook.), 高8.4 m, 直径11.3 cm, 采自浙江省丽水市白云山森林保护区; 毛竹(Phyllostachyspubescens), 三年生, 采自国际竹藤中心安徽黄山太平实验中心林场。 三种木材均取胸径材, 然后利用单面刀片将样品分割成长×宽×高大小为0.5 cm×0.5 cm×1.0 cm左右的矩形样品块, 并用滑走式切片机(Leica RM 2010R)在横截面切取15 μm厚的切片。
1.2 酸性亚氯酸钠处理
将每组切片浸渍在酸性亚氯酸盐溶液中, 密封, 并置于75 ℃的水浴锅中, 处理时间根据不同切片中木质素的实际脱除情况决定(0~1.5 h)。 酸性亚氯酸钠盐溶液的具体配制为: 固液比为1∶26, 亚氯酸钠和冰醋酸的浓度分别0.3 g·g-1, 0.1 mL·g-1。 反应结束后, 加入大量去离子水终止反应, 小心取出切片, 并用去离子水反复冲洗至中性, 获得的样品用于拉曼显微镜检测。
1.3 共聚焦拉曼显微光谱检测
每组亚氯酸盐处理后的切片依次置于载玻片上, 封好片后采用显微共聚焦拉曼光谱(HR Evolution, Horiba Jobin Yvon)进行光谱采集和成像。 为获得较高的空间分辨率, 光谱采集时采用100倍油镜(MPlan100×, Oil, NA=1.25)以及532 nm激发波长, 激光功率为8 mW。 测试时光栅为300 mm-1, 狭缝宽度为100 μm, 扫描步距0.5 μm, 单点光谱采集时间1 s, 光谱测定范围500~3 100 cm-1, 光谱分辨率2 cm-1, 最后利用LabSpec6软件对获得数据进行后期处理, 包括宇宙射线移除和光谱基线校正。
2 结果与讨论
2.1 木质素的拉曼特征峰
图1为未处理的桉木、 杉木、 毛竹纤维细胞次生壁的平均拉曼光谱, 不同树种在1 270, 1 331和1 598 cm-1位置均有特征峰。 其中, 1 598 cm-1归属于木质素芳香族骨架振动, 1 270 cm-1归属于G型木质素芳香环醚键伸缩振动, 1 331 cm-1为S型木质素酚羟基弯曲振动[7]。 特别的, 不同于木材, 禾本科毛竹纤维细胞在1 171 cm-1处有独特的拉曼特征峰, 归属于羟基肉桂酸(HCA)中肉桂酰酯键, 与木质素和半纤维素以酯键和醚键连接, 进而形成木质素-酚酸-碳水化合物复合体存在于禾本科植物细胞壁中[8]。
2.2 亚氯酸钠法脱木素的选择性
通过对木质素特征峰(1 540~1 700 cm-1)区域进行积分, 发现在未处理桉木中, 导管次生壁(V-S)、 木射线次生壁(R-S)及纤维细胞的细胞角隅(CC)和复合胞间层(CML)均含有较高含量的木质素, 而纤维细胞次生壁(F-S)中木质素含量相对较低[图2(a)]。 经亚氯酸钠溶液处理0.5 h后, 木质素含量在各细胞类型中均显著下降, 尤其是纤维细胞的CC和CML区域; 值得注意的是, V-S和R-S中木质素含量依然要高于F-S。 随着处理时间的延长(1.0~1.5 h), 木质素含量的分布变得更均匀, 各细胞浓度均变得很低。 在逐步脱除木质素过程中, V-S和R-S展现出更高的残留木质素浓度[图2(b—d)], 其中V-S木质素强度最高, R-S强度次之, F-S最低, 说明导管细胞中木质素最难被降解, 而纤维细胞中木质素最容易被移除。 类似的, 针叶材杉木在逐步脱木质素过程中, 射线细胞剩余木质素的浓度也略高于纤维细胞(即管胞), 进一步证明在组织水平上纤维细胞中木质素是最容易被降解的[图2(e—h)]。
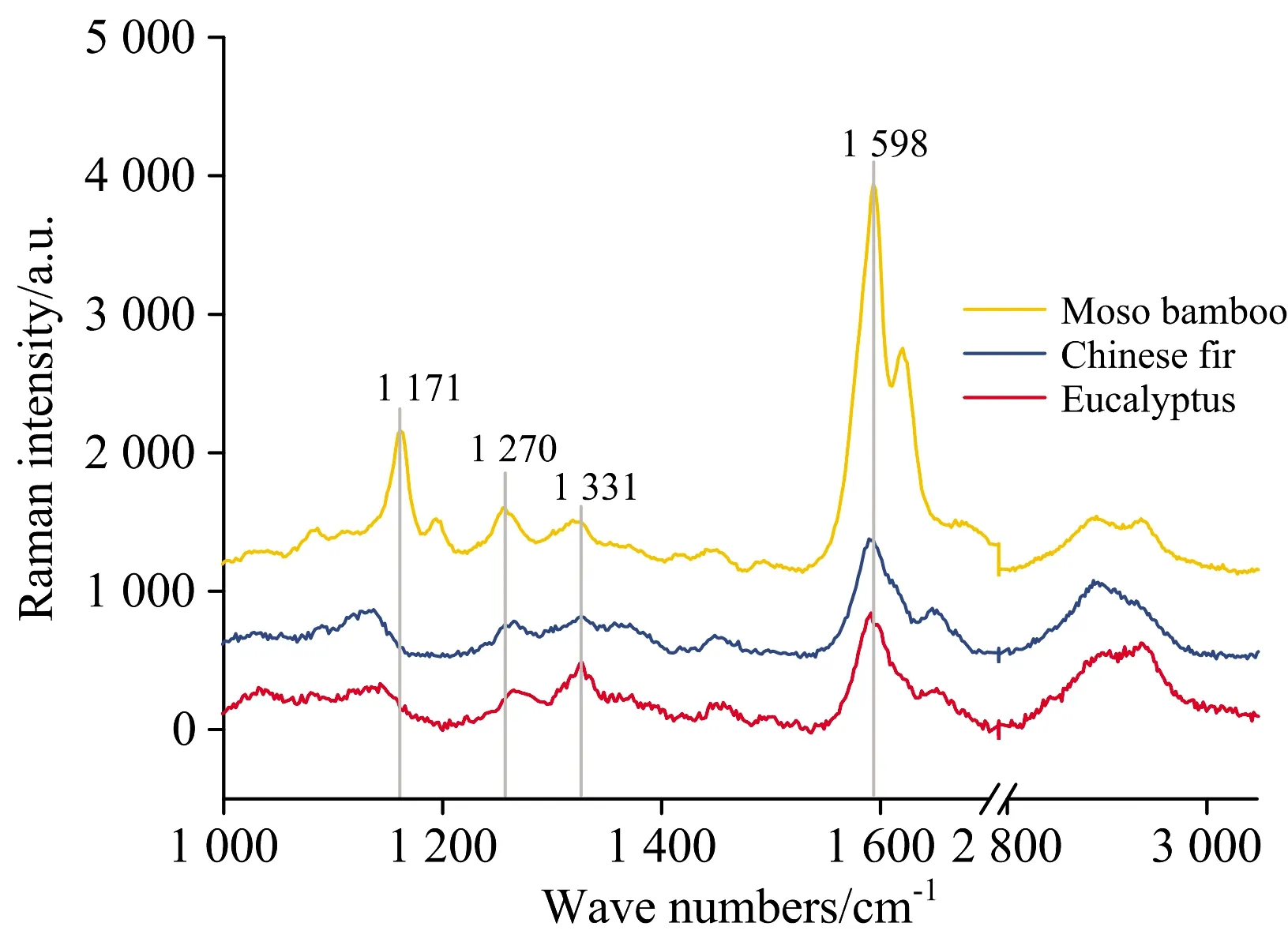
图1 桉木、 杉木、 毛竹纤维细胞的平均拉曼光谱
为了进一步探索脱木质素过程中残余木质素浓度的动态变化, 我们分别提取出不同树种、 不同细胞中木质素在1 598, 1 270(G型)和1 331 cm-1(S型)位置的平均拉曼光谱强度变化(图3, 图4)。 在脱木素过程中, 发现S型木质素的拉曼强度降低比G型木质素更显著, 说明S型木质素在酸性亚氯酸钠溶液中更容易被脱除。 类似的, 在酸处理和碱处理中, 也发现S型木质素更容易被脱除[2, 9]。 这主要是因为S型木质素含有大量的β-β键, 其分子量更低, 有利于促进木质素在细胞壁间的移动和脱除[10]。 此外, S型木质素与碳水化合物间的交联比G型木质素少, 结构更松散, 在木质素溶解过程中其物理屏障更小[11]。
在未处理木材中, V-S和R-S中在1 270 cm-1处拉曼强度明显高于F-S[图3(b)和(e)], 说明V-S和R-S含有更高含量的G型木质素。 就木质化程度而言, 导管、 射线的木质化程度也高于纤维细胞(V-S和R-S在1 598 cm-1处拉曼强度高于F-S), 且在逐步脱木素的过程中三者相对木质素浓度关系也基本保持不变, 这可能与细胞功能有关。 导管和射线细胞作为重要的水分和营养物质传输通道, 在木材形成初期次生壁迅速加厚并木质化, 且在整个木质化阶段都伴随着G型木质素的沉积[12]; 而纤维细胞作为木材主要的机械支撑, 化学成分以纤维素为主, 纤维细胞增厚较慢, 木质化滞后, 木质素的沉积主要以S型木质素为主[13]。 因此, 高浓度的G型木质素及延长的木质化过程使得导管和射线细胞比纤维细胞更难于脱除木质素。

图2 亚氯酸钠脱木素过程中桉木(a—d)、 杉木(e—h)木质素分布拉曼成像

图3 亚氯酸钠脱木素过程中桉木(a—c)、 杉木(d—f)、 毛竹(g—i)木质素拉曼特征峰1 598 cm-1(a, d, g)、
在形态学区域, 木质素的脱除也具有高度的选择性。 在未处理的样品中, 无论是桉木、 杉木, 还是毛竹中, CC的木质素浓度均最高, CML次之, F-S最低。 然而, 经亚氯酸钠处理后, CC和CML区域木质素迅速被脱除, F-S木质素拉曼强度减少量最少(图4), CC木质素浓度反而最低(图3), 说明木质素优先从CC和CML区域脱除。 在细胞壁生物合成过程中, 木质素与碳水化合物通过大量的化学键连接形成“钢筋混泥土”结构。 F-S含有大量的碳水化合物, 该区域的木质素与碳水化合物互相交联形成复杂的三维网状结构; 而在CC和CML区域, 碳水化合物含量极少, 尤其是CC区域几乎不含碳水化合物, 主要以木质素为主, 该区域木质素与碳水化合物化学键连接较少, 因此在脱木素过程中受到的阻力更小, 木质素更容易脱除。

图4 亚氯酸钠脱木素过程中桉木(a—c)、 杉木(d—f)、 毛竹(g—i)木质素拉曼特征峰1 598 cm-1(a, d, g)、 1 270 cm-1(b, e, h)及1 331 cm-1(c, f, i)相对强度减少百分比
2.3 亚氯酸钠法脱木素的动力学
通过提取逐步脱木素过程中样品的平均拉曼光谱强度变化, 我们发现木质素降解在前期最明显, 尤其是前0.5 h内, 各样品、 各区域拉曼强度减少均达80%以上, 而处理后期(1.0~1.5 h)木质素的降解程度要小得多, 大约在5%~15%。 类似的, Siqueira等[14]曾报道甘蔗渣中大量木质素在反应前期(2 h)迅速被脱除, 而后期移除13%的残留木质素需多花一倍的时间。 研究表明, 木质素大分子间通过缩合型C—C键和非缩合型C—O键连接, 包括β-O-4, β-5, β-β, 5-5, 4-O-5等键型, 其中占据最大比例的β-O-4键比缩合结构中β-5, 5-5等键更容易断裂[2, 9]。 因此, 前期优先大量脱除的木质素可能主要以β-O-4键连接, 而后期较难移除的木质素主要以缩合型木质素为主。
尽管不同树种、 不同细胞在脱木素过程中动力学总体趋势基本一致, 但G、 S型木质素的降解在不同细胞间有着巨大区别。 通过提取G型(1 270 cm-1)、 S型(1 331 cm-1)木质素的拉曼光谱变化, 发现在前0.5 h内, G型木质素拉曼强度在桉木的V-S, R-S和F-S中减少量分别为62.33%, 74.27%和62.82%[图4(b)], 而在对应区域S型木质素拉曼强度减少程度分别为68.85%, 71.28%和70.19%[图4(c)], 除R-S外其他区域S型木质素拉曼强度均比G型木质素降低程度更高; 在杉木[图4(e—f)]、 毛竹[图4(h—i)]中, S型木质素的减少也比G型木质素约高5%~10%, 进一步证明S型木质素比G型木质素更容易脱除。 在桉木R-S中, G型木质素的脱除明显高于V-S和F-S, 甚至高于S型木质素单体; 在杉木中, 无论哪种木质素单体, 射线细胞木质素拉曼强度的降低程度也均高于管胞。 射线细胞的脱除规律较为特殊, 这可能与细胞类型有关: 射线细胞属于薄壁细胞, 导管和纤维细胞(阔叶材)或管胞(针叶材)属于厚壁细胞, 亚氯酸钠溶液渗入薄壁的射线细胞比进入厚壁细胞更容易, 因而木质素的减少更明显。
针、 阔叶材及禾本科的脱木素规律基本相似, 但我们发现相同厚度切片的毛竹脱木素所需时间要明显少于木材。 如图3(g)所示, 毛竹脱木素处理0.5 h后其特征峰1 598 cm-1处拉曼强度变化基本趋于平稳。 因此我们缩短检测周期, 每隔10 min检测一次, 发现毛竹在前10 min内1 598 cm-1处拉曼强度在F-S, CML和CC处就分别减少88.65%, 92.93%和91.29%, 而后期(20~60 min)拉曼强度减少只有7%~14%。 相比于木材, 竹材脱木素时间显著缩短, 这可能与竹材中含有大量的HCA有关。 HCA与半纤维素和木质素通过酯键和醚键相连接, 在酸性亚氯酸钠溶液中, 竹材中HCA与木质素之间的酯键比木材中木质素与半纤维素之间的醚键更容易裂解[15], 因此大大缩短了脱木素处理时间。
3 结 论
不同树种、 不同细胞、 不同木质素单元脱除动力学均有差异, 利用拉曼光谱可以简单、 快速的获得不同树种、 组织、 细胞、 木质素单元在脱木素过程中残余木质素含量的动态变化。 在酸性亚氯酸钠法脱木素过程中, 大量木质素在前期迅速被脱除, 后期木质素的移除效率下降。 并且, 亚氯酸钠法脱木素具有高度的选择性: 在组织水平, 导管中木质素最难移除, 射线细胞次之, 纤维细胞最容易; 在形态学区域, 木质素移除率CC最高, 其次是CML, F-S最低; 对于木质素单元而言, S型木质素比G型木质素降解更容易。

