运用逆流技术高效提取紫薯花青素
张琼月,李冰寒, 李林辉
(西华师范大学生命科学学院,四川南充 637009)
花青素是一类水溶性较好的植物源性类黄酮类色素[1-2],通常分布在多种颜色较深的水果、蔬菜细胞组织之中,参与植物花和果实颜色的决定[3-4],如葡萄、黑枸杞、蓝莓、紫甘薯、桑葚等。目前的研究已知,花青素不仅具有较强的抗氧化和清除人体自由基的能力,还有良好的防治癌症、增强记忆、改善视力、控制体重、心血管保护等作用,在食品、药品、保健和美容等行业均有应用[5-11]。
紫薯(Solanum tuberdsm) 又叫紫甘薯、黑薯,因其薯肉呈紫色或深紫色而得名。除了具备普通红薯所含的营养成分外,还富含硒元素和花青素[12]。花青素分布在紫薯的块根和茎叶中,尤其在块根中含量丰富,所以紫薯块根是工业提取花青素的主要原料之一[13]。目前,提取紫薯花青素有多种方式[14]。王兆雨等人[15]运用直接浸提法,提取条件为体积分数50%乙醇提取剂、50 ℃恒温水浴60 min,pH 值3.5,此时花青素的提取率为5.8%。Sun Y Z 等人[16]运用微波提取法,通过响应面法确定最优工艺为盐酸乙醇提取紫薯花青素,料液比1∶5,在71 ℃下提取53 min,花青素含量为363.90 μg/g。回晶等人[17]运用超声波辅助提取法,将盐酸乙醇作为提取液,料液比1∶40,50 ℃恒温提取25 min,最终得到的花青素为324.87 μg/g。但这些方法效率并非很高。
动态逆流提取[18],即将提取溶剂和待提取物料分别从设备两端连续加入,待提取物料向出渣口方向逐级向后移动,最后作为残渣排除,在这个移动过程中,待提取物料中的有效成分浓度越来越低,而用于提取待提取物料中有效成分的提取溶剂从出渣口一侧加入,逐级向前移动,随着提取剂的逐级向前移动,存在于提取剂中的有效提取物浓度越来越高,直到从第一级流出。动态逆流提取的级数依据二者间的反应效率来定,理论上级数越多,提取量越多,但在实际生产中,还需考虑再增加提取级数是否还具有经济效益,如果增加了级数,不再产生更多的效益,那就不再增加。
逆流提取方法在中药活性成分的工业提取上获得了广泛应用[19-25],从枸杞、姜黄、甘草、茶树紫芽、赤灵芝等众多中药材中提取活性物质的研究均有报道,但尚未见其应用于紫薯花青素的提取研究中。以新鲜紫薯为原料,利用逆流提取技术进行紫薯花青素提取工艺的研究,并获得了较为理想的效果。
1 材料与方法
1.1 材料与试剂
绵紫薯9 号块茎,实验室栽培所得。
苋菜红标准品,购于索莱宝公司;无水乙醇、盐酸,均为国产分析纯。
1.2 试验方法
1.2.1 紫薯预处理
选取大小均匀、质量相近、表皮无明显破损的新鲜紫薯洗净,室温下晾干表面水分,切成薄片,于60 ℃下烘干至恒质量,研磨成粉,过50 目筛,密封后4 ℃下避光保存[26]。
1.2.2 逆流提取级数的设定
在正式试验开始前,对样品粉末进行重复静置提取,并分别测定提取液中的花青素含量,以此对逆流提取的最佳级数进行试验验证。参考毕云枫等人[27]的研究结果设置试验条件,对样品进行重复静置提取试验。预试验结果如下:第1 次提取所得滤液中的花青素含量为0.288 mg/g;第2 次提取液中含量为0.182 mg/g;第3 次提取含量为0.092 mg/g;第4 次提取含量为0.049 mg/g;第5 次提取含量为0.039 mg/g。由此结果可看出,第4 次与第5 次提取后所得的滤液中花青素含量极少,无法带来更多效益,即基本没有试验意义,故最终选择以三级逆流的方式开展后续试验操作。
1.2.3 试验装置及运行过程
根据逆流提取理论[18]设置反应容器,紫薯粉末在每一级提取容器中与酸性乙醇溶液反应,并安装冷凝回流装置,以减少提取过程中的酒精损耗。启动反应前调节容器温度,并在整个提取过程中保持恒温。在每次提取结束后,将反应混合物静置至室温,以减少试验误差。用漏斗和滤纸进行固液分离操作,将滤纸上的紫薯粉末固形物用提取溶剂全部冲洗到下一级反应容器中。
三级逆流提取装置示意图见图1。
在反应过程中,新的紫薯粉末从第一级加入,与提取溶剂反应并分离后的固形物(P1) 顺次向下一级转移,同理,第二级反应后,固液分离所得的粉末固形物(P2) 将被全部转移到第三级提取容器中,第三级反应结束后,移除粉末固形物(P3)。而提取溶剂运动方向相反,第三级反应容器是添加新提取溶剂的地方,且第三级提取反应并分离后的滤液(L3) 将作为第二级反应的提取溶剂。同理,第二级提取反应后的滤液(L2) 将用于第一级提取反应,而第一级的提取溶剂经过滤后,即为最终的花青素粗提液(L1)。
1.2.4 提取紫薯花青素的单因素分析
以一定体积分数的乙醇溶液作为提取溶剂,在一定提取温度、料液比、提取时间下,将紫薯花青素溶解于其中,是常用的提取方法,试验也采用乙醇溶液作为提取溶剂,以逆流提取方法,探索其最优提取条件及提取效率。
(1) 乙醇体积分数对紫薯花青素提取的影响。称取适量紫薯粉末从第一级容器中加入,按照1∶10的料液比在第三级提取容器中分别加入体积分数为30%,40%,50%,60%,70%的乙醇溶液(盐酸调节pH 值至1.5),在反应过程中保持60 ℃恒温,每份粉末的总反应时间为2 h,即每一级反应持续时间为2/3 h。 从提取溶剂加入第三级容器起,在其经历了第三级提取、第二级提取、第一级提取后,到第一级固液分离得到花青素粗提液为止的过程为一整个逆流提取流程。将经历整个逆流提取流程后得到的花青素粗提液以转速6 000 r/min 离心1 min,收集上清液(即花青素溶液) 进行后续分析。重复3 次,以平均值代表该因素下的提取效率。
(2) 料液比对紫薯花青素提取的影响。称取适量紫薯粉末从第一级容器中加入,分别按照1∶5,1∶10,1∶15,1∶20,1∶25 的料液比在第三级提取容器中加入体积分数为40%的乙醇溶液(盐酸调节pH 值至1.5),于60 ℃下恒温,每份粉末的总反应时间为2 h,即每一级反应持续时间为2/3 h。然后,将经历整个逆流提取流程后得到的花青素粗提液以转速6 000 r/min 离心1 min,收集所得上清液进行后续分析。将以上流程重复3 次,以平均值代表该因素下的提取效率。
(3) 提取温度对紫薯花青素提取的影响。称取适量紫薯粉末从第一级容器中加入,按料液比1∶20在第三级提取容器中加入体积分数为40%的乙醇溶液(盐酸调节pH 值至1.5),分别设置试验提取温度为50,60,70,80,90 ℃,并在提取过程中保持恒温,每份粉末的总反应时间为2 h,即每一级反应持续时间为2/3 h。然后,将经历整个逆流提取流程后得到的花青素粗提液以转速6 000 r/min 离心1 min,收集所得上清液进行后续分析。将以上流程重复3 次,以平均值代表该因素下的提取效率。
(4) 提取时间对紫薯花青素提取的影响。称取适量紫薯粉末从第一级容器中加入,按料液比1∶20在第三级提取容器中加入体积分数为40%的乙醇溶液(盐酸调节pH 值至1.5),设置试验提取温度为80 ℃,每份粉末的总反应时间分别设置为2.0,2.5,3.0,3.5,4.0 h,即每一级反应持续时间分别为2/3,5/6,1,7/6,4/3 h。将经历整个逆流提取流程后得到的花青素粗提液以转速6 000 r/min 离心1 min,收集所得上清液进行后续分析。将以上流程重复3 次,以平均值代表该因素下的提取效率。
1.2.5 提取紫薯花青素的多因素分析
在单因素试验的基础上,综合考查乙醇体积分数、料液比、提取温度和提取时间4 个因素对逆流提取法提取紫薯花青素的影响,以花青素得率为指标,设计正交试验,以期得到从紫薯中提取花青素的较好工艺。
L9(34)正交试验因素与水平设计见表1。
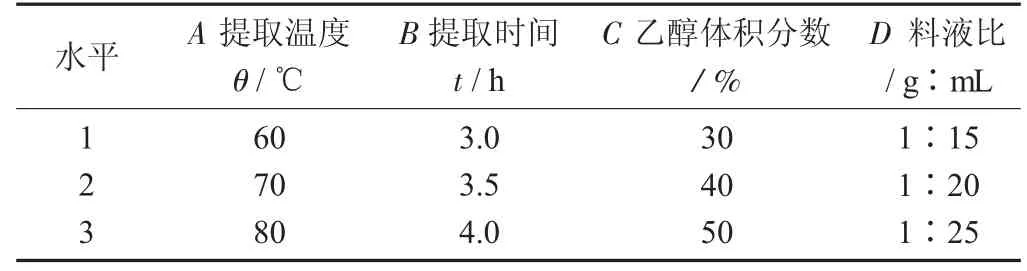
表1 L9(34)正交试验因素与水平设计
1.2.6 超声波提取法
超声波提取法是近年来研究紫薯花青素提取领域中的一大热点,多项研究围绕超声波法提取紫薯花青素展开[14,17,27],并认为是目前提取紫薯花青素最好的方法。紫薯品种不同,其中花青素含量也存在差异,由于缺乏不同提取方法对同一紫薯品种提取花青素效率的参考文献,在进行该项工作时,张卫波等人[28]用超声波法提取花青素的工艺被选择,用于与该试验方法进行比较,评判二者的优劣。其最佳提取条件为乙醇体积分数80%,超声温度30 ℃,超声时间10 min,紫薯与提取剂的料液比1∶25,提取完毕后将粗提液以转速6 000 r/min 离心1 min,对上清液即为花青素溶液进行含量测定。将以上流程重复3 次,结果取平均值。
1.3 花青素含量测定
1.3.1 标准曲线的制作
苋菜红标准曲线的绘制参照文献[29],具体操作为精密称取0.100 g (准确至0.001 g) 苋菜红标准品100 mL 容量瓶中,加去离子水(pH 值7.0) 定容,得到质量浓度1 mg/mL 的苋菜红标准液。分别移取0.50,1.00,1.50,2.00,2.50,3.00,3.50 mL 至50 mL容量瓶中,用去离子水(pH 值7.0) 定容。于波长520 nm 处测吸光度,以苋菜红溶液为横坐标,吸光度为纵坐标,绘制苋菜红标准曲线。回归方程为Y=0.288 4X+ 0.060 9,R2=0.999 6。
苋菜红标准曲线见图2。
1.3.2 花青素含量的测定
将待测花青素溶液用乙醇溶液(pH 值1.5) 进行稀释,于波长520 nm 处测吸光度[30],每组试验设置3 次平行,结果取平均数。再根据标准曲线回归方程计算出提取液质量浓度C (10-5g/mL),计算紫薯花青素得率P,计算公式为:
式中:V——提取液体积,mL;
n——稀释倍数;
M——紫薯粉末质量,g。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 乙醇体积分数对紫薯花青素含量的影响乙醇体积分数对花青素含量的影响见图3。
由图3 可知,乙醇体积分数为40%时花青素含量最高。一定范围内,乙醇体积分数越大提取效果越差,推测可能因为花青素属于水溶性色素,乙醇体积分数越高其水占比越小,反而不利于花青素的提取。而在体积分数为70%之后得率又有上升,可能是高体积分数乙醇对细胞有了杀伤作用,从而使得细胞内的花青素被提取出来。
2.1.2 料液比对紫薯花青素含量的影响
料液比对花青素含量的影响见图4。
图4 料液比对花青素含量的影响
由图4 可知,在料液比过小时,提取液容易达到相对饱和,并且量相对更少,所以不利于花青素的工业提取;而在料液比过大时,提取液内花青素浓度变化不大,但原料用量增加,出现不必要的浪费。由此得知,当料液比为1∶20 时,花青素的提取效果最好。
2.1.3 提取温度对紫薯花青素含量的影响
提取温度对花青素含量的影响见图5。
由图5 可知,提取温度为80 ℃时,花青素含量远远高于其他提取温度。在一定范围内,提取温度的升高有利于分子运动,还可起到破坏细胞的作用,从而有利于花青素的释放。但超过一定提取温度界限,花青素受热被破坏[7],提取到的量反而减少。
2.1.4 提取时间对紫薯花青素含量的影响
提取时间对花青素含量的影响见图6。
由图6 可知,一定范围内,花青素含量随着提取时间增加而增加,可能是因为有充足的时间利于花青素从细胞内充分释放。当提取时间过长,一是花青素容易分解,二是时间成本增加。因此,3.5 h是提取花青素的最佳时间。
2.2 正交试验结果与分析
正交试验结果与分析见表2。
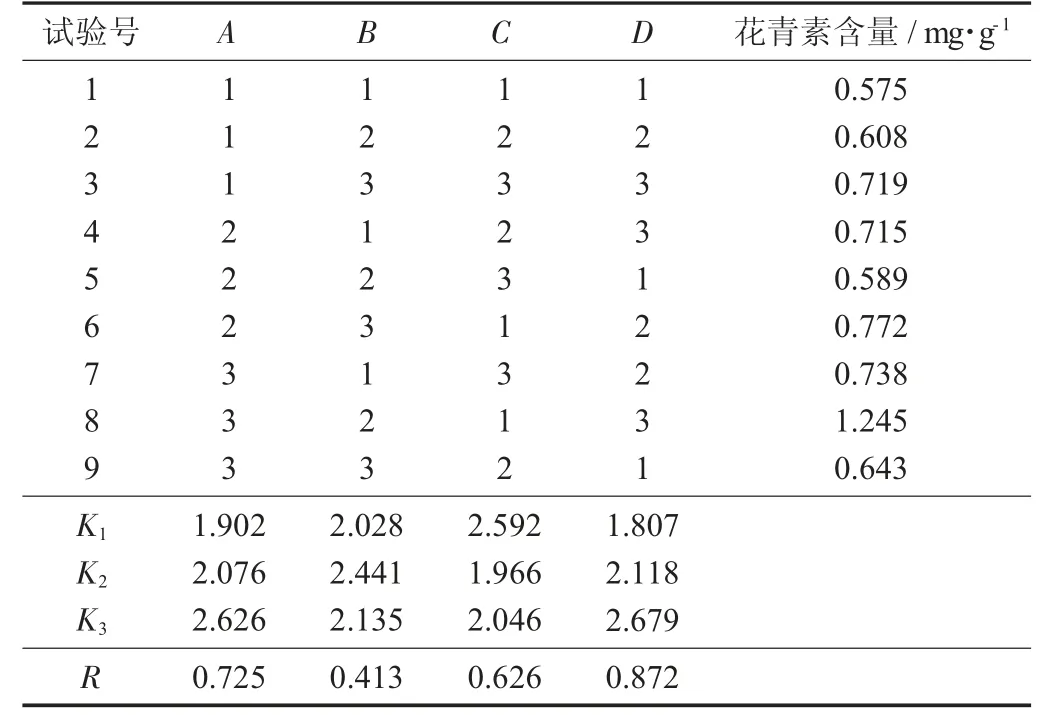
表2 正交试验结果与分析
由表2 可以得知,各个因素影响试验结果的主次顺序为D>C>A>B,即料液比>乙醇体积分数>提取温度>提取时间。由此结果可知,料液比对于逆流提取效果的影响是最大的,设置合适的料液比不仅能将提取效果最大化,还能提高原料利用率,避免成本浪费。乙醇体积分数对于逆流提取也有较大的影响作用,选择合适的体积分数能够促使提取效果达到最好。相对而言,提取温度和提取时间对最终提取效果的影响不如前2 项,但保持适宜的提取温度、设置最佳的提取时间,也能进一步提高逆流提取的效率。
最终得出逆流提取法在提取紫薯花青素时的最佳工艺条件为A3B2C1D3,即酸性乙醇体积分数30%,料液比1∶25,提取温度80 ℃,提取时间3.5 h,此时花青素含量为1.245 mg/g。
2.3 超声波提取试验结果与分析
在文献所示的最佳试验条件下[28],对同一批次紫薯粉末进行超声波提取,所得花青素含量为0.513 mg/g,而运用逆流提取法的花青素含量为1.245 mg/g。由结果得知,逆流提取法的提取效果远远好于超声波提取法。
3 结论
直接提取法是最原始的提取方法之一,操作时只需将原料和提取溶剂充分混合后,进行一次性静置提取即可。王兆雨等人[15]以体积分数50%乙醇为提取剂,提取温度50 ℃,提取时间60 min,pH 值调节至3.5 为提取条件,进行了紫薯花青素的直接提取试验。此时,原料中花青素的提取率为5.8%。直接提取法操作简单易行,但也有提取时间较长、原料利用率低、提取效率低等缺点。
用纤维素酶和果胶酶进行辅助从紫薯粉末中提取花青素也是常用方法之一。这2 种酶都有破坏植物细胞壁的作用[16],能促使花青素从细胞中大量释放并在萃取剂中迅速溶解。虽然酶辅助法提取效果优于直接提取法,但其实质并未发生改变,仍然是一次性静置提取。并且酶解法提取成本较高,对试验的温度要求也较严格。因此,不适合于工业提取花青素。
微波法的原理是原料粉末吸收了微波能量,使细胞内的温度迅速升高,细胞内的压力超过细胞壁的膨胀能力,从而导致植物细胞破裂,其内的活性成分自由流出。Sun Y Z 等人[16]通过响应面法探究微波法提取紫甘薯花青素的最佳条件,结果是以盐酸乙醇作为提取剂,料液比1∶5,提取温度71 ℃,提取时间53 min,得到的最终含量为363.90 μg/g。 然而,微波法在溶剂的选择上有一定的局限性,这也在一定程度上限制了微波在工业提取紫薯花青素中的应用。
与微波法不同的是,超声波法在提取过程中产生高速强烈的空化作用和搅拌作用,破坏植物细胞,使溶剂大量渗透到细胞中,从而大大提高了提取效率。超声波法不仅提取时间短,而且提取温度低、提取范围广泛。这就决定了超声波法在近年来众多紫薯花青素提取研究中的重要地位。回晶等人[17]使用盐酸乙醇作为提取剂,料液比1∶40,提取温度50 ℃,提取时间25 min,花青素的最终含量为324.87 μg/g。关于2 种提取方法联合作用的研究也有发表[31],研究者将超声波和纤维素酶共同作用于紫薯花青素的提取过程,其在最适条件下的花青素得率为8.77%。
试验选取了当前应用最为广泛的超声波提取法与逆流提取法相比较[32]。在参考文献所示的最适条件下[28],超声波提取法与逆流提取法使用同一批次紫薯粉末分别进行花青素提取试验,其中花青素含量的测定与计算方式均相同,试验得出的最终结论为逆流提取的花青素含量为1.245 mg/g,而超声波提取法的花青素含量为0.513 mg/g。由此可知,相较于其他方法,逆流提取在花青素得率方面有着无可比拟的优势,这也给紫薯花青素提取工业带来了新方向。因此,逆流提取法在紫薯花青素的工厂化提取中具有极大的应用前景。

