新型pH敏感型氧化锰纳米探针的制备与表征
邢 新,司元纯,陆依凡,许 瑞,陈乔尔,邹多宏
与其他的成像方式,如CT、X线等相比,磁共振成像(magnetic resonance imaging,MRI)具有非电离、出色的空间及解剖分辨率等优势[1]。然而MRI却受到目标灵敏度低的限制。那么开发多种模式的纳米探针就成为了解决这一问题的一种策略[2]。目前,癌症仍然是当今死亡率最高的疾病之一[3]。MRI被广泛地应用于肿瘤的诊治,目前几乎一半的MRI需要造影剂的参与[4],将纳米探针与MRI技术结合,可以精确地定位肿瘤的部位[5];钆的复合物一直以来被广泛的应用于此,然而钆离子具有潜在的毒性。因此,研究者们不断地去开发低毒性、高灵敏度的基于其他顺磁性金属的纳米探针[6]。该研究合成了一种锰基氧化物纳米粒子(manganese oxide nanoparticles,MnO-NPs),它对pH响应,具有较高比表面积和低生物毒性,可以被开发成为新一代磁共振纳米造影剂。
1 材料与方法
1.1 试剂与材料聚丙烯酸(poly acrylic acid,PAA)、谷胱甘肽(glutathione,GSH)购买自北京索莱宝科技有限公司;一水硫酸锰(manganese sulfate monohydrate,MnSO4·H2O)购买自上海阿拉丁公司;细胞计数试剂盒(cell counting kit-8,CCK-8)购买自日本同仁化学研究所。
1.2 仪器及其使用使用透射电子显微镜(JEM-2100F,日本JEOL公司)观察样品的形态;使用粒度分析仪(NanoBrook 90plus Zeta,美国Brookhaven公司)检测样品的粒径大小;孔隙率分仪( TristarⅡ,3020M,美国Micromeritics公司) 测量样品的氮吸附-脱附等温曲线;X射线衍射仪(XRD,TTR-Ⅲ,日本Rigaku公司)分析晶体结构;热重分析仪(TGA,Q5000IR,美国TA公司)对材料进行热重分析;X射线光电子能谱分析仪(XPS,ESCALAB 250,美国Thermo公司)分析材料元素组成;使用电感耦合等离子发射光谱(ICP-OES,ICAP7200,美国Thermo公司)检测锰离子的释放;使用傅里叶变换红外光谱仪(FTIR,iS10,美国Nicolet公司)检测有机共价键;使用酶联免疫检测仪(MQX200,美国Bio-tek公司)检测吸光度。
1.3 材料合成取0.5 g NaOH、0.1 g的GSH、1.0 g的PAA置于100 ml锥形瓶中,向其中加入10 ml无水乙醇和40 ml的超纯水,在N2的保护下60 ℃反应20 min;随后向其中加入1 ml 100 mg/ml的 MnSO4,继续反应5 h,反应结束后以12 000 r/min的转速离心5 min,收集离心产物,使用超纯水洗涤3~5次后获取氧化锰纳米颗粒样品。
1.4 MnO-NPs的表征取适量MnO-NPs分散于超纯水中,使用超声波震荡形成悬浮液,将悬液滴于附有支持膜的铜网上,待液体挥发后将其置于透射电子显微镜下以观察样品的大小、形态、表面特性等。采用XRD、XPS、TGA、FTIR分别检测该样品。
1.5 弛豫效能检测取0.5 g琼脂糖粉末置于100 ml锥形瓶中,磁力搅拌下加热到100 ℃,澄清透明后,降温到80 ℃待用。取等量且适量纳米材料,分别置于pH为7.4、5.5、4.5的PBS缓冲液中,37 ℃下震荡24 h,分别用相应的PBS缓冲液稀释到相等的合适浓度,分别取100、50、25、12.5、6.25、0 μl溶液置于200 μl离心管中,分别加入100、150、175、187.5、193.75、200 μl琼脂糖凝胶。用移液枪吹打混匀后,置于4 ℃冰箱冷藏凝固,使用7.0 T磁共振扫描仪,检测不同离心管的T1弛豫时间。使用ICP-OES测定Mn2+浓度。通过纵向驰豫值的倒数/Mn2+浓度的线性拟合,来计算纵向弛豫率。
1.6 Mn2+释放研究取9只50 ml离心管,分编号为1~9,每组3只离心管,分成3组,分别加入39.5 ml pH为7.4、5.5和4.5的PBS缓冲液。取0.5 ml浓度为10 mg/ml纳米材料分别分散于离心管中,置于37 ℃恒温震荡箱中,在5、15、30、60、90、180、360、720、1 440 min时各取1 ml液体分别置于9个2 ml离心管中,转速为15 000 r/min,离心5 min,吸取0.5 ml上清液于5 ml离心管中,加入1.5 ml超纯水和1 ml浓硝酸,震荡摇匀后,静置6 h,过0.45 μm的滤膜,滤液注入2 ml离心管中,静置12 h后,使用ICP-OES检测Mn2+的含量。
1.7 氧化锰的生物相容性研究将人牙龈成纤维细胞(human gingival fibroblasts,HGF)按照1×104个/孔接种于96孔板中,使用含有10%胎牛血清的DMEM高糖培养基培养。接种24 h后,使用PBS缓冲液洗涤细胞2遍,向其中加入不同浓度的MnO-NPs,共培养24、48 h之后使用CCK-8试剂盒检测。
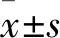
2 结果
2.1 MnO-NPs结构的表征透射电子显微镜观察可见制得的氧化锰呈片形花瓣状,尺度较为均一,合成的产物具有晶体结构,直径约为5 nm;粒径分布比较窄,其直径约为100 nm(图1A),其表面可见有一定数量的孔道(图1C、D)。 该氧化锰颗粒的比表面积达到了231.01 cm3/g(图2A),在孔直径为1.6和12 nm时孔容积最大(图2B)。粒度分析仪结果显示,该纳米颗粒具有较窄的粒径,其水合粒径约为400 nm(图3A)。X射线衍射仪结果显示所获取的纳米颗粒与Mn3O4的PDF卡片吻合,由此可知所获取的氧化锰为Mn3O4(图3B)。傅里叶变换红外光谱仪结果显示该纳米粒子在波数为521.6和629.2 cm-1处具有明显的吸收峰,这是分属八面体Mn-O伸缩振动和四面体Mn-O伸缩振动(图3C)。热重分析从室温(20 ℃)开始,以20 ℃/min的速度升温,直至820 ℃,其结果显示合成的氧化锰重量在20~150 ℃之间损失了3.33%,这部分主要是由于水分子的损失,在150~400 ℃之间损失了6.38%,这部分是由于有机物GSH以及PAA的损失。400 ℃ 以后重量趋于平稳,说明此时有机物已被完全去除(图3D)。
X射线光电子能谱分析仪的结果如图4所示,采用C1s结合能作为内标准,结果显示该纳米粒子中含有锰和氧元素。

图1 氧化锰纳米颗粒在不同倍数下的透射电镜图 A:×8 000;B:×40 000;C:×160 000;D:×160 000
2.2 不同pH下氧化锰纳米颗粒的弛豫率在场强为7.0 T的磁共振扫描器中,测得在pH为7.4时,其纵向弛豫率为2.3 mmol-1·s-1,当pH为5.5时,其纵向弛豫率为6.3 mmol-1·s-1,而当pH为4.5时,则达到了13.0 mmol-1·s-1。氧化锰纳米颗粒的纵向弛豫率与pH有着明显的关联,即pH越低,其纵向弛豫率越高(图5A)。
2.3 Mn2+释放研究在pH为7.4的PBS溶液中,Mn2+几乎不泄露,此时的氧化锰纳米颗粒是相对稳定的,当pH偏向酸性,在pH为5.5和4.5时,Mn2+释放速度加快,但是其24 h释放量也不足0.5%,说明该材料非常稳定(图5B)。

图2 孔隙率分析仪检测 A:MnO-NPs的比表面积;B:MnO-NPs的孔直径分布
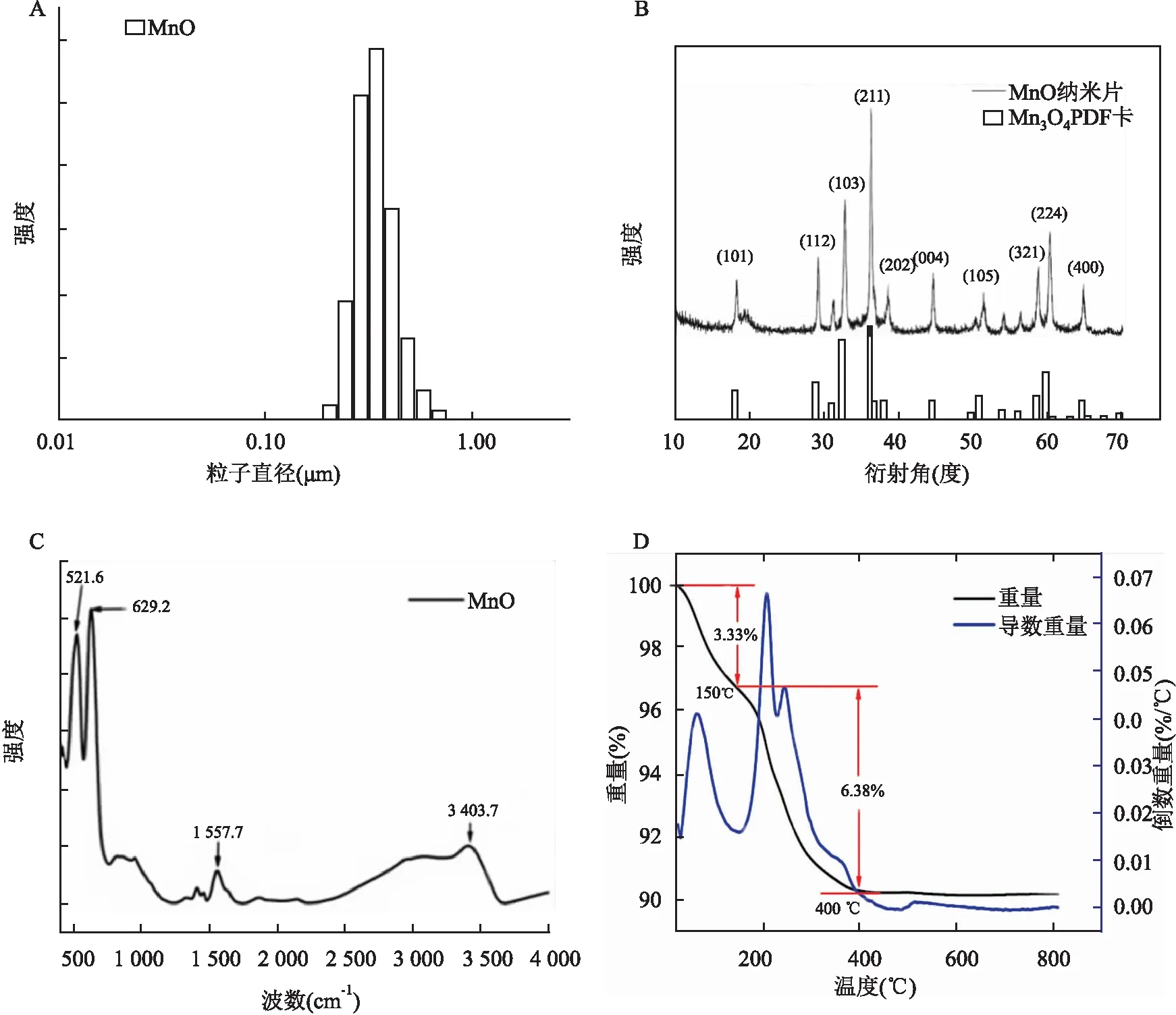
图3 MnO-NPs的表征
2.4 氧化锰纳米颗粒的细胞生物相容性研究为了验证所合成的氧化锰纳米颗粒是否具有细胞毒性,采用了CCK-8来对其进行检测。使用不同浓度的氧化锰纳米颗粒与HGF共同培养24、48 h,与对照组(氧化锰浓度为0 μg/ml)进行比较,所得结果进行单因素方差分析。结果可见,共同培养24 h情况下,与对照组相进行单因素比较,所有组别存活率差异无统计学意义(F=0.924,P>0.05);在共同培养48 h后,与对照组进行单因素比较,当浓度为16 μg/ml时,其存活率差异有统计学意义(P=0.038),但此时细胞存活率高于对照组细胞存活率,与对照组比较,其他浓度组结果差异无统计学差异(F=2.496,P>0.05);见表1、图6。
3 讨论
分子成像领域最热点的话题就是要求非电离、非侵入性以及能够实时监测细胞中所发生的分子事件[7]。而MRI则恰好具备有这些优点,因而它在临床中拥有着非常广泛的应用[8]。而MRI之所以可以成功,很大程度上是由于造影剂的使用,造影剂通过加速组织环境中质子的弛豫率从而增强MRI图像中的信号[9]。

图4 氧化锰颗粒的XPS结果

图5 MnO-NPs的造影效能和稳定性检测

表1 HGF与MnO-NPs共培养24 h和48 h细胞存活率

图6 HGF与MnO-NPs共培养24 h和48 h细胞存活率
锰基化合物应用于造影剂已有了非常多的研究,例如二乙烯三胺五乙酸锰,锰的氧化物,Mn(Ⅱ)/Mn(Ⅲ)的杂化结构等[6,10-11]。通常情况下可以将锰基造影剂分为两大类,即锰的氧化物以及Mn2+螯合物,但是由于Mn2+螯合物血液循环时间短并且容易在脑部堆积从而产生毒性,因此研究者们更多的将精力放在了锰氧化物上[12]。本研究所合成的纳米粒子结合XPS和XRD的结果可证实为Mn3O4,其中锰的价态分别为二价和三价。低价态的锰离子相比较于Mn4+来说具有更高的造影效能,尤其是Mn2+。这是由于Mn2+的3D轨道上排列有5个未成对的电子,这可以产生较大的磁矩,并引起附近原子核的磁弛豫[13],因此成分为Mn3O4的MnO-NPs理论上就拥有更高的造影效能。PAA具有非常良好的生物相容性以及亲水性[14];可以将它用作为pH响应聚合物来修饰纳米颗粒。肿瘤微环境具有微酸的特点,本研究使用了pH响应聚合物PAA作为MnO-NPs的修饰剂,因此该纳米粒子可能会具有pH敏感性,从而可以对肿瘤微环境响应,为了验证其是否具有这一性能,在不同的pH条件下测定了它的弛豫效能。当pH为4.5时,该纳米颗粒弛豫效能最高,其弛豫率达到了13.0 mmol-1·s-1,显著地高于pH为5.5及7.4时的弛豫率,并且酸性条件下可见Mn2+释放速率更快,因此MnO-NPs可以对pH响应。而另一方面,肿瘤的微环境除了微酸以外,还有着高浓度的GSH,有研究表明,高含量的GSH可以破坏Mn-O键,并且弱酸的环境可以促进Mn2+的释放[15],从而该纳米造影剂有望在肿瘤部位具有更高的造影效能。当纳米造影剂注射入血管内之后其稳定性和生物毒性就成为了一个不可忽视的问题。与HGF共培养后,MnO-NPs并未对HGF产生明显的生物毒性;同时这一氧化锰纳米颗粒即便在pH达到4.5时,其24 h Mn2+释放量也不足0.5%,这说明该材料稳定性和安全性较好,具有应用于人体的潜能。结合以上几点,本研究所合成的这一新型氧化锰纳米材料,有望作为一种酸敏造影剂应用于肿瘤的MRI检测中。
具有靶向肿瘤药物输送功能的纳米平台可以增强抗癌药的特异性,并且改善肿瘤部位的药物浓度。本研究中,尽管未将这一新型氧化锰纳米颗粒与抗癌药负载,但是通过透射电子显微镜观察可以发现其表面具有一定的孔道,同时孔隙率分析仪的结果也印证了孔道的存在,并且其水合粒径约为200 nm,比较适合作为纳米给药平台,将来也可以将其改良后与抗癌药负载应用于此,从而成为一种具有诊断及给药作用的全新纳米探针。
在这项研究中,首先提出了一种新型花瓣状氧化锰纳米颗粒。通过透射电子显微镜直径约为100 nm,随后的X射线衍射仪检测确定了所合成的材料为Mn3O4;弛豫效能检测以及锰离子释放研究表明了它具有酸敏造影剂应用的潜能;生物相容性检测则说明了它几乎无生物毒性,可以安全地应用于人体。本研究表明该氧化锰纳米粒子结构稳定,生物相容性佳,对pH敏感,酸性条件下拥有着较高的弛豫效能。因而这一纳米颗粒将可能作为一种新的纳米造影剂应用于临床,改良后甚至可以成为一个诊疗一体化的纳米平台从而拥有着更加广泛的应用前景。

