PHF5A通过NF-κB通路影响胃癌细胞MGC803的增殖和迁移
曹一凡,张如通,苟雅雯,陈乐乐,陈 思,张开光
胃癌是消化系统常见的肿瘤之一,胃癌的发病率和死亡率均位于我国恶性肿瘤的前五位[1]。尽管胃癌的诊断和治疗在近年取得较多进展,但是治疗和诊断的形势依然严峻,其中主要原因之一就是其发病的分子机制较为复杂,尚不明确,这也是目前胃癌研究的热点之一。
PHF5A(plant homodomain finger-like domain-containing protein 5A)是一种在真核生物中高度保守的蛋白。对于真核细胞,选择性剪接和肿瘤的发生可能有一定的关系[2]。早先的研究报道,PHF5A可与剪接小体中的U2 snRNP复合物及依赖ATP的解旋酶超家族相互作用,可能作为不同基因的通用转录调控因子发挥作用[3-4]。近些年的研究显示PHF5A蛋白参与多种肿瘤的发生和发展,对肿瘤细胞干性、细胞周期调控、代谢、信号转导等生物学过程均有影响[5-9],但其表达异常与胃腺癌之间的关系尚无相关研究。该文旨在探究PHF5A在胃癌的表达情况及其对胃癌细胞生物学行为的影响。
1 材料与方法
1.1 细胞培养胃癌细胞系MGC803、MKN45购自北京协和细胞资源中心;胃癌细胞系AGS购自中国科学院上海生命科学研究院细胞资源中心;胃正常上皮细胞GES-1由中国人民解放军大学樊代明课题组惠赠;MKN45和GES-1细胞在补充10%胎牛血清(美国Gibco公司)和1%青霉素-链霉素混合物(上海碧云天公司)的1640培养基中培养;MGC803和AGS分别在补充同样血清和青-链霉素的DMEM(美国GIBCO公司)和F12(美国Sigma公司)培养。所有细胞均置于5%CO2、37 ℃的恒温细胞培养箱中培养。
1.2 qPCR法检测PHF5A在细胞系中的mRNA表达水平用Trizol试剂(美国Invitrogen公司)提取GES-1、MKN45、MGC803、AGS细胞总RNA,根据制造商的说明书使用逆转录试剂盒(南京Vazyme公司,R123-01)逆转录为cDNA,用AceQ qPCR SYBR Green Master Mix试剂盒(南京Vazyme公司,Q11-02)进行所有qPCR中的 mRNA定量分析,以β-actin作为内参照。使用引物如下:PHF5A上游引物为5′- GCACTCTGGTGCGCATATGTGA-3′,下游引物为5′- GACAATCTTTGGGCAGCCATCTC-3′;β-actin上游引物为5′-GGACTTCGAGCAAGAGATGG-3,下游引物为5′-AGCACTGTGTTGGCGTACAG-3′(上海生工生物工程公司)。每组设置3个复孔。运用2-ΔΔCt法计算mRNA相对表达量。
1.3 Western blot法检测PHF5A在细胞系中的蛋白表达水平选取处于对数生长期的GES-1、MKN45、MGC803、AGS细胞,弃上清液,用预冷的PBS洗3次,加入200 μl含1% PMSF(上海碧云天公司)和1%蛋白酶抑制剂(美国Sigma公司)的细胞裂解液并用细胞刮刀在冰上刮取细胞,转移至1.5 ml离心管中并置于冰上裂解30 min,13 000 r/min,4 ℃离心15 min,吸取上清液提取总蛋白。使用Bradford(上海生工生物工程公司)依据说明书用酶标仪测量蛋白浓度并绘制标准曲线,计算蛋白浓度。取总蛋白量相同样品,用PBS补充至相同体积并加入对应量的loading buffer混合,在95 ℃金属浴中煮沸15 min使蛋白变性,-20 ℃保存。制备12%的聚丙烯酰胺凝胶,以β-actin (武汉三鹰生物公司,1 ∶1 000)作为内参,加入蛋白并电泳,以湿转法将蛋白转移到PVDF膜上,用5%脱脂奶粉封闭1 h后,将膜放入1%BSA稀释的对应的抗体中,4 ℃冰箱内封闭过夜。次日用TBST于摇床上摇晃清洗3次,每次10 min。二抗室温孵育1 h后再用TBST清洗3次,用ECL化学发光试剂盒(美国Advansta公司)显影,最后用Image J 图像处理系统分析并对图像进行半定量。
1.4 慢病毒敲低PHF5A对照/实验细胞系的建立采用HEK293T细胞包装慢病毒并感染目的细胞。实验使用的空载及敲低质粒从中国科学技术大学生命科学院Human shRNA library获取,PHF5A所选用两种不同的敲低序列分别为sh1:5′-CCGGGCCTAC TACTACCAGCAGAAACTCGAGTTTCTGCTGGTAGTA GTAGGCTTTTTG-3′;sh2:5′-CCGGTGTGTGATTTGT GACTCCTATCTCGAGATAGGAGTCACAAATCACACA TTTTTG-3′。实验中设置3组,转染PLKO.1空载质粒的细胞为阴性对照组,命名为sh-NC组,转染PLKO.1-ShPHF5A-sh1质粒的命名为sh1组,转染PLKO.1-ShPHF5A-sh2质粒的命名为sh2组,sh1和sh2作为实验组。配置182 μl无血清DMEM和18 μl PEI混合物并加入1.5 μg包装质粒pMD2G和psPAX2以及3.0 μg目的shRNA,静置后滴加至密度为60%左右的HEK293T细胞中,4 h后更换新鲜培养基,在培养箱中孵育2 d,收集含有病毒的上清液,用0.22 μm无菌滤器过滤后用以培养待感染的密度为60%左右的MGC803细胞中并加入8 μg/ml聚凝胺充分混合,在培养箱中孵育1 d后,用PBS温和的洗涤目的细胞并更换新鲜的培养基,24 h后加入嘌呤霉素筛选。
1.5 Western blot法检测敲低质粒转染后胃癌MGC803细胞系中PHF5A的表达水平取筛选后的生长状态良好的细胞,以β-actin为内参,按照“1.3项”中的方法检测细胞中PHF5A(1 ∶1 000,武汉三鹰生物公司,15554-1-AP)蛋白表达水平。
1.6 克隆形成实验取生长状态良好的筛选后的对照组和实验组细胞,用预热的PBS洗去漂浮细胞,用胰酶(上海碧云天公司)37 ℃消化3 min,1 200 r/min、3 min离心并重悬后吹打成均匀的细胞悬液,在血球计数板上计数。以每孔5 000个细胞铺于6孔板,并摇晃使细胞在孔中均匀分布,后小心移至培养箱。10 d后取出6孔板,弃上清液,PBS清洗后用4%甲醛固定15 min,用1%结晶紫染色15 min,用PBS清洗后拍照,并在镜下随机选取5个视野,计数超过100个细胞的克隆形成的数量。
1.7 细胞生长曲线计数取生长状态良好的筛选后的阴性对照和实验组细胞,用预热PBS洗去漂浮细胞,用胰酶消化并离心重悬吹打成均匀的细胞悬液,在血球计数板上计数。以每孔15 000个细胞将细胞铺在12孔板中,每孔补培养基至1 ml。自第2天起每天取阴性对照组及实验组sh1、sh2对应的孔各2个,消化细胞后再用400 μl PBS将对应的孔吹打清洗3次并在镜下观察孔中无残余细胞,以保证所有细胞均被收集。将消化后的细胞悬液及对应PBS一起离心并用1 ml PBS重悬,用血球计数板计数并计算对应孔细胞密度,每组2个孔分别计数2次取均值,共计数5 d。绘制阴性对照和实验组的生长曲线。
1.8 细胞划痕实验取生长状态良好的筛选后的阴性对照和实验组细胞,用胰酶消化并离心重悬吹打成均匀的细胞悬液,在血球计数板上计数。取每孔750 000个细胞,将细胞铺在6孔板中,待细胞贴壁。用200 μl移液枪枪头在培养板上划十字,弃培养基并用PBS冲洗,去除漂浮细胞,加入无血清培养基。在0、6、12、24 h后在显微镜下观察细胞迁移愈合情况并拍照,用Image J软件进行半定量评价其迁移能力。
1.9 Western blot法检测对照组和实验组中NF-κB P65、IκBα、p-IκBα和Cyclin D1蛋白表达水平测量细胞核内NF-κB p65蛋白表达水平需提取核蛋白,蛋白提取取用状态良好的筛选后的阴性对照和实验组细胞,用PBS洗1次,用细胞刮刀收集细胞,13 000 r/min离心2 min收集细胞沉淀,用核蛋白提取试剂盒(北京Solarbio公司,0050)按照说明书提取细胞核蛋白,用BCA蛋白定量试剂盒(上海碧云天公司)测量蛋白浓度,定量后用PBS稀释成相同浓度,加入loading buffer在95 ℃中煮15 min,-20 ℃保存。IκBα、p-IκBα和Cyclin D1蛋白水平的检测使用细胞总蛋白。以β-actin作为内参,其他细胞蛋白提取和Western blot实验过程同“1.3项”。NF-κB p65(美国CST公司, 8242)、IκBα(武汉三鹰生物公司,10268-1-AP)、p-IκBα(美国Abcam公司,ab133462)和Cyclin D1(武汉三鹰生物公司, 60186-1-Ig)一抗孵育采用1 ∶500的浓度。
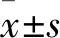
2 结果
2.1 PHF5A的mRNA和蛋白在胃正常上皮细胞株及胃癌细胞株中的表达情况PHF5A在胃癌细胞株MKN45、MGC803和AGS中的mRNA水平分别为胃正常上皮细胞株GES-1的1.77倍(t=4.78,P<0.01)、2.16倍(t=8.2,P<0.01)和1.74倍(t=10.53,P<0.01)(图1A),其在胃癌细胞株MKN45、MGC803和AGS中的蛋白表达水平分别为GES-1的2.2倍(t=9.045,P<0.01)、2.4倍(t=13.22 ,P<0.01)和1.4倍(t=3.96,P<0.05)(图1B、C)。可见,与胃正常上皮细胞比较,胃癌细胞中的PHF5A在mRNA和蛋白水平上表达均增高,差异有统计学意义。
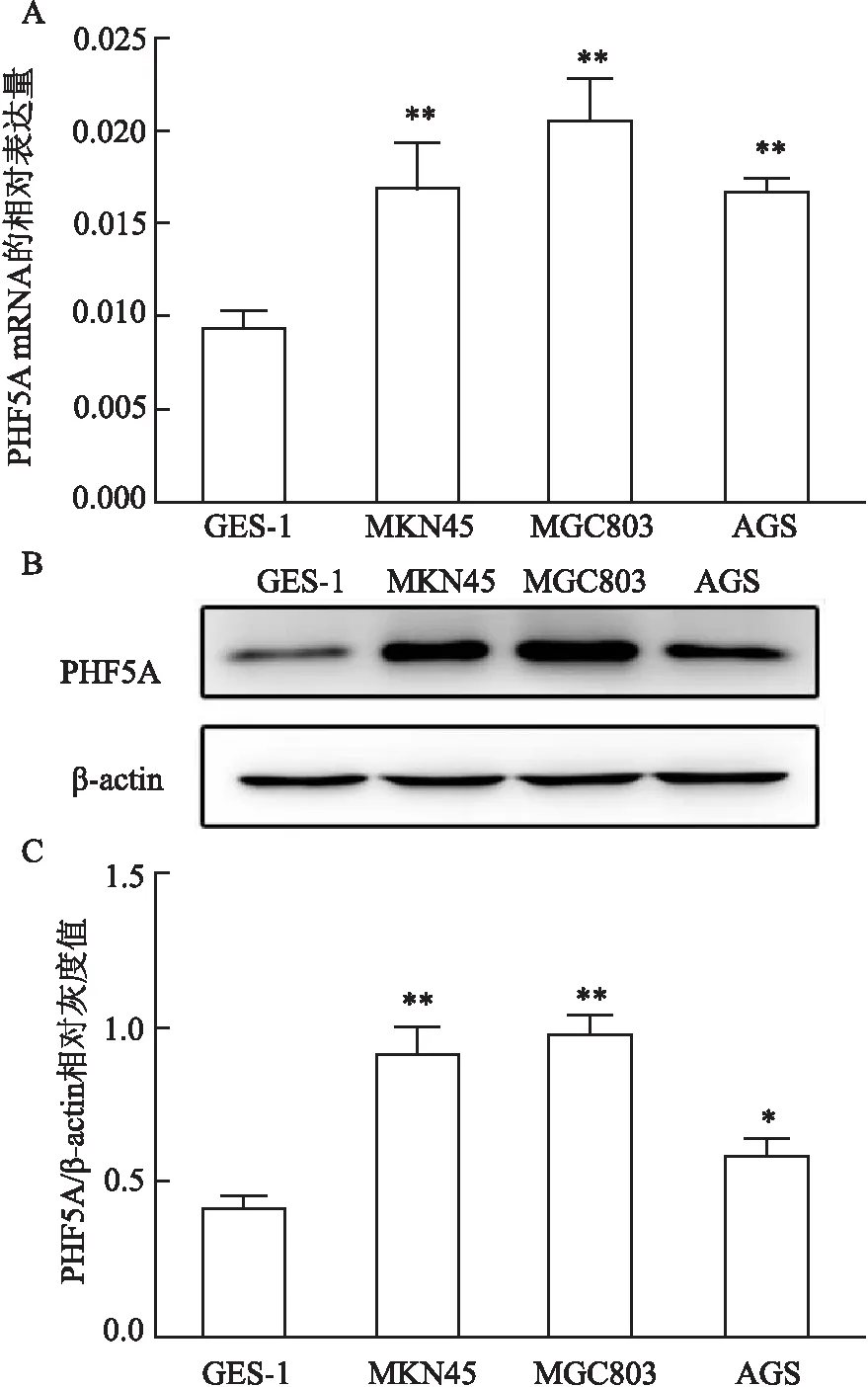
图1 GES-1细胞和MKN45、MGC803、AGS细胞中PHF5A的mRNA和蛋白表达水平
2.2 慢病毒转染抑制MGC803细胞中PHF5A蛋白表达慢病毒转染并经过药物筛选以后,在MGC803细胞中,与sh-NC组比较,sh1组蛋白表达水平下降了约43.3 %(t=11.5,P<0.01),sh2组下降了约36.4 %(t=9.42,P<0.01)(见图2),表明以慢病毒为工具,使用不同的shRNA序列干扰PHF5A的表达后,两组干扰质粒可以有效抑制胃癌细胞MGC803中PHF5A的基因表达。
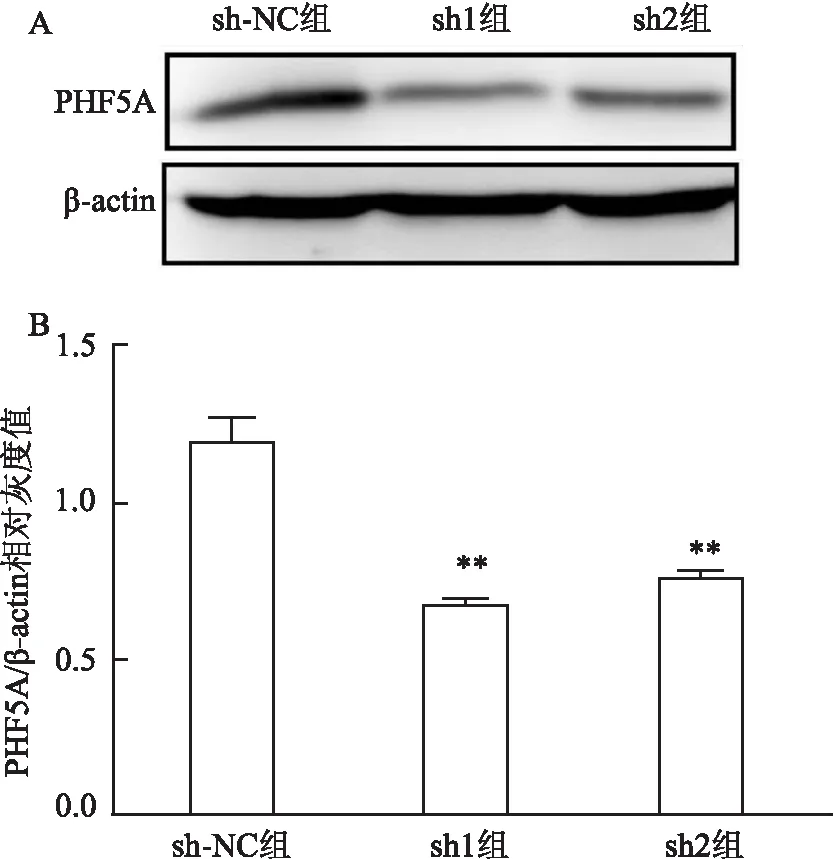
图2 Western blot 法检测MGC803细胞中PHF5A的敲低效果
2.3 干扰PHF5A表达抑制胃癌细胞的增殖转染后进行生长曲线计数和集落形成实验。到第5天,sh-NC、sh1、sh2组三组间细胞数量有差异(F=100.69,P<0.01)(图3),2周后集落形成率也明显下降(F=30.295,P<0.01)(图4)。说明抑制PHF5A的表达可以抑制胃癌细胞的生长,抑制其集落形成的能力。
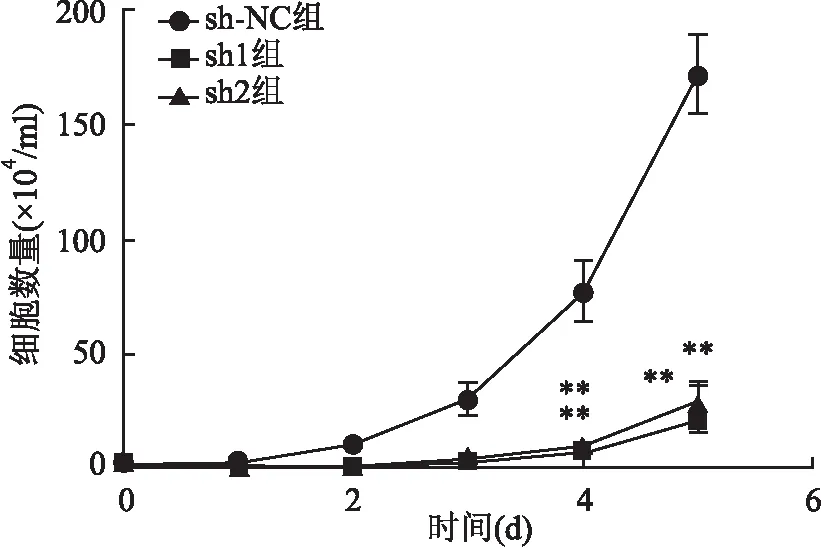
图3 慢病毒转染质粒后各组MGC803细胞增殖情况
2.4 干扰PHF5A表达抑制胃癌细胞的迁移采用划痕实验检测细胞的迁移能力 ,结果显示(图5),与sh-NC组(18.12±0.86)%比较,24 h后sh1组(12.48±0.54)%和sh2组(11.26±0.97)%划痕愈合率分别降低了31%和38%,三组间差异有统计学意义(F=187.37 ,P<0.01)。由此可见抑制PHF5A可以抑制MGC803细胞的迁移能力。

图4 集落形成实验分析敲低PHF5A对MGC803细胞集落形成的影响
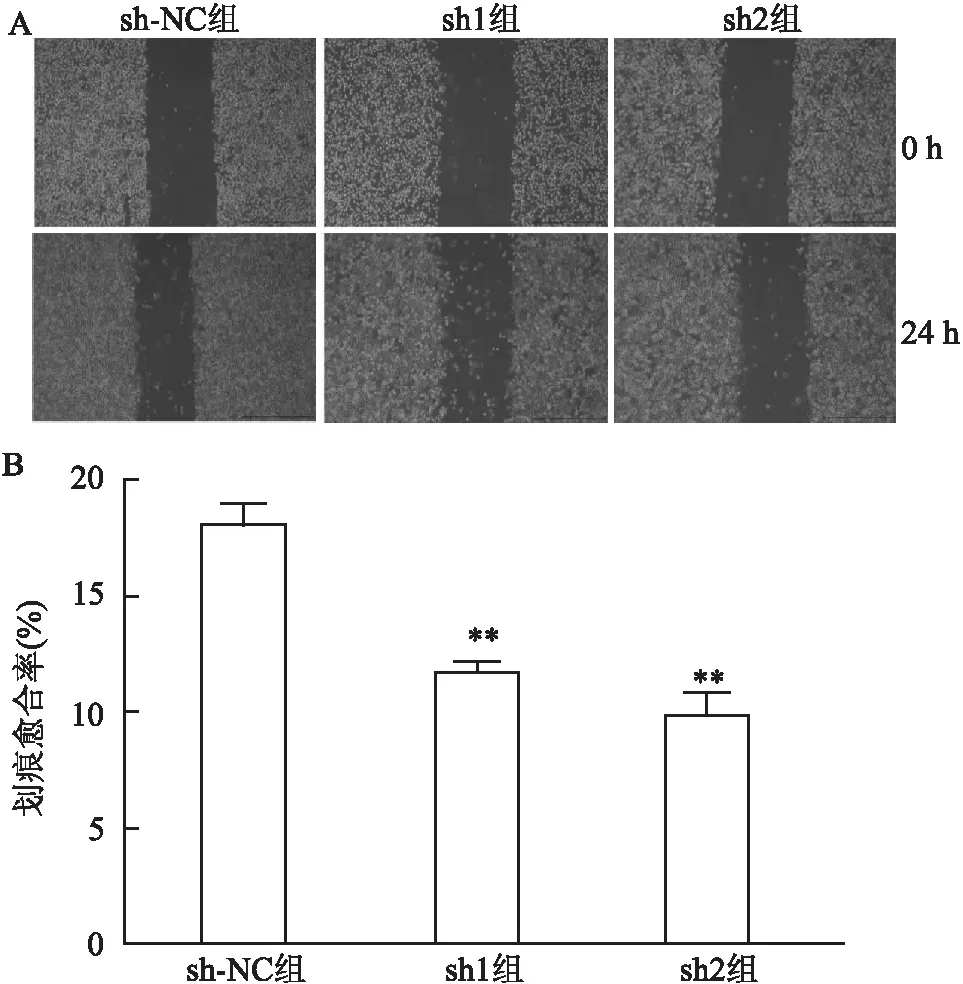
图5 划痕实验检测MGC803细胞迁移能力 ×40
2.5 干扰PHF5A表达对胃癌MGC803细胞中NF-κB p65、p-IκBα、Cyclin D1蛋白表达的影响用Western blot法检测各组细胞核内NF-κB p65蛋白表达水平的变化,可见与sh-NC组比较,sh1组(t=10.03,P<0.01)和sh2组(t=14.88,P=0.001)细胞核内NF-κB p65表达水平均下降。与sh-NC组比较,在细胞总蛋白中,在IκBα表达量无明显变化的前提下,p-IκBα表达减少,Cyclin D1的表达量也减少(图6)。

图6 慢病毒转染胃癌MGC803后各组NF-κB通路中相关蛋白的表达情况
3 讨论
胃癌是全球范围内高发的恶性肿瘤。虽然近年来胃癌在诊断、手术治疗和靶向治疗方面都有新的进展,但由于对其发病的分子机制了解有限,所以很多患者即使在经合理治疗后,预后仍然较差。
近期有多篇研究[5-9]显示PHF5A表达的失调可能和肿瘤的发生发展有密切的关系。有研究[5]显示,较之于正常神经干细胞,PHF5A是胶质母细胞瘤干细胞扩增所必需的。在乳腺癌中,PHF5A在乳腺癌组织中表达增加,它的上调可以抑制fas介导的凋亡,且和较差的预后相关[6]。在肺腺癌中,PHF5A促进肿瘤细胞的增殖、转移和侵袭,促细胞进入G0/G1期,抑制顺铂诱导的细胞凋亡。PHF5A小分子抑制剂pladienolide以剂量依赖的形式抑制H1299和A549细胞的生长[7-8]。在结直肠癌中,PHF5A通过乙酰化促进选择性剪接介导KDM3A的上调,调节代谢和应激反应,促进结肠直肠癌的发生[9]。本实验通过Western blot、荧光定量PCR等方法检测PHF5A在胃正常上皮细胞和多种胃癌细胞mRNA和蛋白水平上的表达情况,并设计两种shRNA序列在胃癌细胞MGC803敲低PHF5A,探究PHF5A在胃癌细胞株中的作用,以证明PHF5A在肿瘤细胞中的表达高于胃正常上皮细胞,抑制其蛋白表达可以使胃癌细胞MGC803的增殖、克隆形成和迁移能力减弱。
NF-κB通路在免疫反应和炎症反应中发挥的作用已经为人们所熟知,越来越多的证据支持其在肿瘤的发生发展中也扮演了一定的角色[10-13]。早在2001年就有研究[11]提示NF-κB在胃癌细胞核中的表达水平明显高于邻近正常上皮细胞,且通过增加uPA等侵袭相关因子参与了胃癌的发展。2016年文献[12]报道了NF-κB p65在胃癌组织中的上调与不良的预后密切相关。文献[13]提示PHF5A在肝癌中被证实上调并与NF-κB通路的激活有着密切的关系,在细胞中敲低PHF5A可以抑制肝癌的迁移和侵袭,同时NF-κB抑制剂也可以抑制PHF5A对肝癌细胞迁移和侵袭的促进作用。本研究通过Western blot法检测抑制PHF5A蛋白表达的胃细胞系MGC803中核蛋白的NF-κB及总蛋白中IκBα、p-IκBα及NF-κB可能的下游基因Cyclin D1的蛋白表达情况,初步探索了PHF5A对胃癌细胞生物学功能产生的影响可能是通过激活NF-κB通路产生的。
综上,PHF5A在胃癌细胞中高表达,可能作为一种癌基因通过影响NF-κB通路促进了胃癌细胞的增殖和迁移。但其与胃癌的相关性和期间的具体机制尚需要更多的临床数据及动物实验的补充和证实。
——一道江苏高考题的奥秘解读和拓展

