铁皮石斛多糖对神经细胞凋亡抑制作用的研究
沈鸿涛,刘 雪,吴婷婷,窦仁刚,吴建贤,洪永锋
近年来流行病学资料表明[1],我国脑血管病的发病率和死亡率明显高于心血管病,系居首位的人口死亡原因。脑血管病中,以缺血性脑卒中最为多见。缺血性脑卒中是指因脑部血液供应障碍,缺血、缺氧所导致的局限性脑组织缺血性坏死或软化。脑缺血后引起脑组织的炎症反应是继发性神经损伤的重要机制[1]。脑组织缺血后的炎症反应主要是由于脑细胞释放大量肿瘤坏死因子-α(tumour necrosis factor,TNF-α),最终导致神经细胞大量凋亡,此过程不仅是引起脑缺血患者各种功能障碍的基础,也是影响患者预后的主要因素之一[2-4]。
铁皮石斛作为传统的名贵中药,具有十分有效的药用和保健价值。铁皮石斛多糖(dendrobium of polysaccharide,DOP)为铁皮石斛最主要的成分,铁皮石斛所含多糖成分是其它类石斛的数倍。已有研究[5]表明DOP具有抗炎、提高机体免疫能力的作用。而对于缺血性脑卒中,脑组织的炎症反应所引起的神经细胞凋亡是导致各种功能障碍的基础。因此,探究DOP抑制脑组织炎症引起的神经细胞凋亡作用具有重要的潜在价值[6]。
该实验的目的是为了探讨传统中药成分DOP是否具有抑制由TNF-α引起的HT22神经细胞凋亡作用,并找出其作用的最佳浓度,旨在为临床治疗缺血性脑卒中并改善其预后提供新的思路。
1 材料与方法
1.1 细胞来源与培养本研究使用的小鼠海马神经元细胞系(HT22)购自中国科学院上海生化细胞所,置于37 ℃、5% CO2恒温培养箱中培养。该细胞系是体外研究谷氨酸毒性的良好模型,在很多神经退行性疾病,例如阿尔兹海默病(alzheimer's disease,AD)和帕金森病(parkinson's disease,PD)的研究中均有很好应用[6]。细胞按照3×105个细胞数种于六孔板中,分别设置正常培养组、不同浓度TNF-α组、加入不同浓度DOP共同培养组。
1.2 主要试剂DMEM高糖培养基与胎牛血清购自美国Gibco公司;β-actin、p53、caspase-3、BAX引物购自上海生物工程技术有限公司;反转录试剂盒购自日本Takara公司;β-actin、p53、caspase-3、BAX单克隆抗体购自美国Santa Cruz Biotechnology公司;Annexin V/PI双染试剂盒购自美国BD公司;蛋白提取试剂盒、吉姆萨染色液、Hoechst染色液购自中国上海碧云天公司;二抗购自北京中杉金桥公司;ECL化学发光试剂盒购自美国Pierce公司。
1.3 方法
1.3.1荧光定量PCR 用Trizol试剂提取和纯化总RNA。通过逆转录酶逆转录得到cDNA,然后进行PCR扩增;条件如下:在95 ℃下变性15 min,然后进行40个循环,每次循环包括:95 ℃、10 s,53 ℃、30 s,之后4 ℃冷却5 min。最后采用2-ΔΔCt方法用于比较每组中标志物的基因表达。所有PCR一式三份进行,并通过熔解曲线对单峰的存在进行验证。
1.3.2Western blot 体外培养HT22细胞,按照预设分组培养。用含有蛋白酶/磷酸酶抑制剂和苯基甲磺酰氟(phenylmethanesulfonyl fluoride,PMSF)的RIPA缓冲液在冰上裂解收集的细胞。裂解时间20 min,然后将样品转移到新的Eppendorf管中,并以12 000 r/min在4 ℃下离心15 min。将上清液小心地转移到新管中并在-20 ℃下保存直至进一步使用。使用二辛可宁酸(Bicinchoninic acid,BCA)蛋白质测定试剂盒测量各个分组中蛋白质浓度。将蛋白质样品(各30 μg)电解并转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,其在室温下用含有0.2% Tween-20的5%脱脂奶粉封闭1~2 h。轻轻摇动后,洗涤5次(每次8 min),然后分别加入兔抗鼠p53单克隆抗体(1 ∶1 000),兔抗鼠caspase-3单克隆抗体(1 ∶1 000),兔抗鼠BAX单克隆抗体(1 ∶1 000),在4 ℃过夜,将膜与辣根过氧化物酶(HRP)偶联的山羊抗兔IgG(1 ∶5 000)在室温下孵育1 h。使用ECL advance Western blot检测试剂盒检测黑暗中的化学发光。
1.3.3CCK-8实验 在96孔板中接种3×103个HT22细胞过夜,然后设置5 ng/ml TNF-α组和正常培养组,孵育12、24、48 h后,每孔加入10 μl CCK-8检测液,培养箱中孵育2 h后,颜色的深浅与细胞的增殖成正比,与细胞毒性成反比,使用酶标仪在450 mm波长处测定吸光度(OD值),间接反映活细胞数量。
1.3.4吉姆萨染色 体外培养HT22细胞,按照预设分组在6孔板中进行培养。用4%多聚甲醛固定细胞15 min,然后PBS洗涤细胞3次,每次5 min,将按说明书配制好的吉姆萨染液加入6孔板中,覆盖细胞,染色15~30 min,吸去染液,用中性蒸馏水缓慢冲洗至出现淡蓝色即可,镜下观察。正常细胞淡染蓝色,凋亡细胞则深染蓝色。
1.3.5Hoechst染色 体外培养HT22细胞,按照预设分组在6孔板中进行培养。用4%多聚甲醛固定细胞15 min,然后PBS洗涤细胞3次,每次5 min,将Hoechst 33258染色液加入6孔板中,覆盖细胞,染色10 min,吸去染液,PBS洗3次,每次5 min,超净台中避风风干,在荧光倒置显微镜下观察并拍照。Hoechst 33258的最大激发波长为346 nm,最大发射波长为460 nm;Hoechst 33258和双链DNA结合后,最大激发波长为352 nm,最大发射波长为461 nm。正常细胞细胞核呈均匀蓝染,形状规则且完整,凋亡细胞的胞核呈致密浓染,或呈碎块状致密浓染和半月形凝聚。
1.3.6Tunel染色 按照预设分组将细胞在细胞爬片上进行培养。用4%多聚甲醛固定细胞15 min,然后PBS洗涤细胞3次,每次5 min,将吸附细胞的载玻片在0.2%的Triton X-100中处理5 min,PBS洗涤细胞3次,每次5 min,从标记液( vial 2: Label Solution)中吸出100 μl用于2个阴性对照( 50 μl/ 个),将50 μl酶缓冲液(vial 1: Enzyme Solution)加入到剩余450 μl的标记液中充分混合均匀,得到500 μl Tunel反应液(50 μl/样本),往样品上滴加Tunel反应液(覆盖整个样品),阴性对照加标记液,湿盒中37 ℃避光孵育60 min,PBS洗涤细胞3次,每次5 min,抗荧光淬灭封片液封片,用荧光倒置显微镜或激光共聚焦显微镜(confocal)检测。正常细胞被4′,6-二脒基-2-苯基吲哚(DAPI)标记为蓝色,凋亡细胞为绿色。
1.3.7Annexin V/PI凋亡流式细胞术 体外培养HT22细胞,按照预设分组在6孔板中进行培养。用不含EDTA的胰酶消化细胞后,于室温2 000 r/min离心5~10 min,收集细胞,每组细胞数不少于1×105个,用预冷1×PBS(4 ℃)重悬细胞一次,2 000 r/min离心5~10 min,洗涤细胞,加入400 μl 的1×Binding Buffer 悬浮细胞,加入5 μl的Annexin V-FITC混匀后,避光,室温孵育15 min,上机前5 min再加入5 μl的PI染色,上机检测。
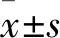
2 结果
2.1 5 ng/ml TNF-α为诱导HT22细胞发生凋亡的最佳浓度PCR实验结果表明,在加入不同浓度(2.5、5、10、20 ng/ml)TNF-α培养HT22细胞24 h后:与正常培养组比较,凋亡相关基因(p53、caspase-3、BAX)的表达量均升高,差异有统计学意义(P<0.05);其中5 ng/ml TNF-α组与其余浓度TNF-α组比较诱导HT22细胞发生凋亡的效果最为显著(图1A)。同时,CCK-8实验结果显示,5 ng/ml TNF-α可以抑制HT22神经细胞的增殖,且在加入TNF-α后培养12 h时的抑制效果最佳(图1B、1C),此时与正常培养组比较差异有统计学意义(P<0.05),此后其对HT22细胞增值的抑制作用逐渐减弱,至24 h时,TNF-α组中HT22细胞的增殖与正常培养组间已无明显差异(P>0.05)。

图1 TNF-α诱导HT22细胞凋亡PCR检测和细胞增殖实验

图2 DOP抑制HT22细胞凋亡相关基因和蛋白表达的作用检测
2.2 DOP可以抑制由TNF-α引起的HT22细胞凋亡相关基因及蛋白的表达分别将不同浓度(10、15、20、25、30 μg/ml)的DOP与5 ng/ml TNF-α共同培养HT22细胞,同时设立5 ng/ml TNF-α培养组、正常培养组。培养24 h后,与正常培养组比较,5 ng/ml TNF-α组凋亡相关基因(p53、caspase-3、BAX)的表达量均升高,差异有统计学意义(P<0.000 1);与5 ng/ml TNF-α组比较,除了15 μg/ml DOP组p53的表达量降低无统计学差异(P>0.05),其余DOP组p53、caspase-3、BAX凋亡基因的表达均被抑制(P<0.05),其中在20、25 μg/ml DOP浓度下,抑制效果最佳,差异有统计学意义(P<0.05)(图2A)。Western blot结果(图2B)表明,与正常培养组比较,在加入5 ng/ml TNF-α后,凋亡相关蛋白p53、caspase-3、BAX的表达水平均升高(P<0.01);与5 ng/ml TNF-α组比较,p53、caspase-3、BAX蛋白的表达均可被20、25 μg/ml DOP抑制,差异有统计学意义(P<0.05)。
2.3 DOP可显著减少由TNF-α引起的HT22细胞凋亡数量吉姆萨染色结果(图3A)显示,加入5 ng/ml TNF-α后,深染凋亡细胞数量较正常培养组增多;与5 ng/ml TNF-α组比较,分别加入20、25 μg/ml DOP后,深染凋亡细胞数量均减少。Hoechst染色结果(图3B)表明,与正常培养组比较,5 ng/ml TNF-α培养HT22细胞24 h后,蓝色深染细胞(凋亡细胞)数量增多,差异有统计学意义(P<0.000 1);分别加入20、25 μg/ml DOP后,其凋亡细胞的数量与5 ng/ml TNF-α组比较均减少,差异有统计学意义(P<0.000 1)。Tunel染色结果(图3C)显示,与正常培养组比较,5 ng/ml TNF-α组绿色凋亡细胞增多,差异有统计学意义(P<0.000 1);与5 ng/ml TNF-α组比较,分别加入20、25 μg/ml DOP 后,绿色凋亡细胞减少,差异有统计学意义(P<0.001)。Annexin V/PI凋亡流式细胞术检测结果(图3D)表明,在加入5 ng/ml TNF-α后,HT22细胞的凋亡比例可达到29.74%,而正常培养组仅为6.97%,说明TNF-α可以增加HT22细胞的凋亡比例;在分别加入20、25 μg/ml DOP后,HT22细胞的凋亡比例分别为22.80%和24.48%,均较5 ng/ml TNF-α组的凋亡比例降低,差异有统计学意义(P<0.01),表明浓度为20、25 μg/ml的DOP均可抑制由TNF-α引起的HT22细胞凋亡。

图3 流式细胞术及不同染色方法检测HT22细胞凋亡数量和比例
3 讨论
患者发生缺血性脑卒中时,由于大脑局部的缺血或缺氧等原因引起脑组织的炎症反应进而受损、坏死。TNF-α是引发脑组织炎症的主要细胞因子之一[7]。在缺血性脑卒中后的急性期与恢复期,由于炎症反应导致神经细胞大量凋亡,凋亡的神经细胞不但自身会失去原有功能,并可阻断细胞间的信号连接,从而加重缺血性脑卒中患者的各种功能障碍,并阻碍神经功能的恢复。临床上,缺血性脑卒中患者将会表现为运动与感觉障碍、失语、吞咽困难、认知障碍等,并且恢复缓慢或难以恢复[8-9]。因此,有效抑制由TNF-α引起的神经细胞凋亡对改善缺血性脑卒中的功能预后有着重要临床意义[10-11]。
本研究在加入不同浓度(2.5、5、10、20 ng/ml)的TNF-α培养HT22细胞24 h后,HT22细胞内p53、caspase-3、BAX凋亡相关基因及蛋白的表达均呈现不同程度的升高,该结果证实了TNF-α的确可导致HT22神经细胞凋亡,且其机制为促进凋亡相关基因的表达,从而启动细胞凋亡程序[12]。其中以5 ng/ml TNF-α引起HT22神经细胞凋亡的效果最佳,而非更高的浓度,其原因考虑为:在10 ng/ml或20 ng/ml浓度的TNF-α作用下,HT22神经细胞内产生了强烈的炎症反应,导致细胞毒性,细胞直接死亡,而非启动细胞内的凋亡程序。另外,本研究以5 ng/ml的TNF-α对HT22细胞进行培养后,发现此浓度的TNF-α对HT22细胞的增殖亦有抑制作用,且在加入TNF-α培养12 h的抑制效果达到最大,此后这种抑制效果逐渐减弱,至培养24 h抑制增殖的效果已消失,分析这可能与细胞系的连续性传代特性有关[13]。
本实验以TNF-α培养HT22细胞的同时,加入不同浓度(10、15、20、25、30 μg/ml)的DOP共培养HT22细胞发现,与TNF-α组比较,除了15 μg/ml DOP组HT22细胞内p53基因的表达下降差异无统计学意义外,其余浓度的DOP组3种凋亡基因(p53、caspase-3、BAX)的表达均呈降低趋势,其中,以20、25 μg/ml DOP组的降低最为显著。进而,本研究采用20、25 μg/ml的DOP为实验浓度,对HT22细胞内3种凋亡基因(p53、caspase-3、BAX)的蛋白进行了检测,其结果与3种基因的表达检测结果完全一致,即p53、caspase-3、BAX蛋白的表达亦被20、25 μg/ml DOP抑制。同时,吉姆萨染色、Hoechst染色、Tunel染色的结果均表明,在加入5 ng/ml TNF-α后,HT22凋亡细胞的数量增多,但这种现象在同时加入20、25 μg/ml DOP后得到了抑制。流式细胞分析结果表明,正常培养24 h时HT22凋亡细胞仅占6.97%;在加入5 ng/ml TNF-α后,HT22细胞的凋亡比例高达29.74%;但在加入20、25 μg/ml DOP后,HT22细胞的凋亡比例分别下降至22.80%和24.48% 。
TNF-α通常由两种方式引起细胞凋亡,一种方式为作用于细胞膜上的TNF-R1受体,上调细胞内caspase-8的表达量,caspase-8作为caspase家族中的重要一员,它可通过上调caspase-3的表达,启动细胞内凋亡程序,引起细胞凋亡[14];另一种方式是TNF-α作用于细胞膜上TNF-R2受体,激活细胞内的NIK(诱导激酶),诱导细胞上调NF-κB的表达,NF-κB的错误调节会引发凋亡基因p53的表达增加,从而引起细胞凋亡。BAX作为Bck-2家族中的重要促凋亡基因,BAX与Bcl-2的比例关系决定了细胞抑制凋亡作用的强弱[15]。本实验研究结果一致表明DOP具有对抗TNF-α引起的HT22细胞损伤、凋亡作用,且其发挥作用的机制可能与抑制了3种凋亡基因(p53、Caspase-3、BAX)的活化与表达有关。
综上所述,本实验通过对凋亡相关基因、蛋白以及HT22凋亡细胞数量和比例等的系列检测,证实了TNF-α可以引起HT22神经细胞的凋亡,且5 ng/ml TNF-α系最佳的作用浓度。同时,DOP作为一种历史悠久的名贵中草药,在对抗由TNF-α引起的HT22神经细胞凋亡方面有着积极而显著的作用,这为改善缺血性脑卒中预后的进一步研究提供了新思路。然而,本实验的不足之处在于未能揭示DOP抑制TNF-α引起的神经细胞凋亡的具体作用方式,今后将会继续探讨。

