CalliSpheres载药微球在肝癌介入治疗中的临床疗效评价
宋 文,彭赵宏,张德志,李晓舒,张国兵,施万印,熊 壮,赵本胜,汪名权,陶龙香
经导管灌注化疗栓塞术(transarterial chemoembolization, TACE)是中晚期包括原发性肝癌和转移性肝癌主要治疗手段之一,疗效在临床上已经获得广泛认可[1]。常见的栓塞材料系碘化油和化疗药物的乳化剂以及明胶海绵等。然而这种乳化剂的稳定性相对较差,化疗药物局部作用持续时间短,周围扩散快,易导致全身不良反应[2]。近年来,由于栓塞材料的不断发展,载药微球经导管灌注化疗栓塞(drug-eluting beads transarterial chemoembolization, DEB-TACE)成为一种新的肝癌介入治疗方法,在临床上得到逐步开展[3-5]。载药微球是通过静电吸附化疗药物,经导管栓塞瘤体后,在瘤体局部化疗药物缓慢释放,从而较长时间保持化疗药物的局部浓度,同时降低全身药物不良反应。现将安徽医科大学第一附属医院采用国产CalliSpheres载药微球治疗58例原发性肝癌和24例转移性肝癌患者临床疗效和安全性总结如下。
1 材料与方法
1.1 病例资料回顾性分析安徽医科大学第一附属医院2017年1月~2019年11月收集的82例CalliSpheres 载药栓塞微球治疗的肝癌患者(3例患者行两次载药微球栓塞),其中男性66例,女性16例,年龄41~92(61.9±11.7)岁。82例患者经病理学、实验室检查和影像学检查诊断为肝癌。58例为原发性肝癌,24例为转移性肝癌(其中12例结直肠癌肝转移,9例胃癌肝转移,1例食管癌肝转移,1例喉癌肝转移,1例卵巢癌肝转移)。肝功能Child-pugh A级62例(原发组47例,转移组15例),Child-pugh B级20例(原发组11例,转移组9例),2组患者术前肝功能差异无统计学意义,肿瘤最大直径(多结节以最大结节直径计算),<5 cm 37例(原发组25例,转移组12例),5~10 cm 45例(原发组33例,转移组12例)。所有患者根据术前检查资料和一般情况进行病情评估,充分告知患者及家属病情、手术方案等并签署介入手术知情同意书。
1.2 材料与设备大型设备:GE公司Optima CL323i数字减影血管造影(digital subtraction angiography, DSA)机(美国)。材料:泰尔茂公司5 F动脉鞘、5 F RH造影导管、2.7 F Progreat 微导管(日本)。江苏恒瑞医药股份有限公司提供的CalliSpheres 载药栓塞微球(直径100~300 μm)。江苏无锡辉瑞制药有限公司提供的表柔比星,规格10 mg/支。江苏恒瑞医药股份有限公司提供的伊立替康,规格40 mg/支。
1.3 治疗方法载药微球准备:介入术前30 min准备载药微球,先将CalliSpheres微球用20 ml注射器抽出,垂直注射器使微球沉降分层,推出上层液体部分,留置微球约3~4 ml。用5%的葡萄糖4 ml充分溶解表柔比星或伊立替康(常规表柔比星使用量为60 mg用于原发性肝癌,伊立替康160 mg用于转移性肝癌),再将装有微球的注射器抽取全部抽取全部化疗药物,让微球与化疗药物混合载药,并且每5 min轻摇1次,使其充分载药,载药时间一般为30 min,微球载药后用非离子型对比剂按体积1 ∶1配比轻摇匀放入一次性无菌杯中静置5 min后使用。
介入治疗过程:患者平卧于DSA手术台上,采用Seldinger穿刺术,穿刺成功后置入5 F血管鞘,在导丝的引导下将5 F RH造影导管置入腹腔干或者肠系膜上动脉造影,造影明确肝动脉及肿瘤供血动脉后,用2.7 F Progreat 微导管超选肿瘤供血动脉,将CalliSpheres 载药栓塞微球用1 ml/min速度,以脉冲的方式经微导管注射入病灶供血动脉,直至血流停滞。注射完毕,造影提示肿瘤染色消失后结束手术。术后给予保肝、抑酸、止吐、抗炎等对症处理。
术后随访:术后3~5 d、1个月根据情况对患者进行随访,随访内容包括患者一般情况,血常规、肝肾功能、止凝血、肿瘤指标、肝脏影像学检查等。
疗效评价:本组病例中多发病灶以最大病灶直径进行评估,术中DSA造影明确肿瘤血供情况。术后3~5 d复查肝功能,术后1个月复查肝脏增强CT或增强MRI检查,明确肝内病灶变化情况,有无再生活性病灶,以制定下一步治疗方案。肿瘤的疗效评价以国际通用标准(modified response evaluation criteria in solid tumors, mRECIST)进行评价,分为完全缓解(complete remission,CR):肿瘤增强扫描无活性病灶强化;部分缓解(partial remission,PR):肿瘤病灶强化部分至少缩小30%;疾病稳定(stable diseease,SD):病灶变化情况介于PR和PD水平之间;疾病进展(progressive disease,PD):病灶强化部分超过原来病灶20%或出现新的病灶。疾病缓解率:CR+PR/患者总数×100%,疾病控制率:CR+PR+SD/患者总数×100%。
术后并发症:主要包括恶心、呕吐、发热、上腹饱胀不适、肝区疼痛、肝脓肿、肝肾功能异常等。
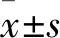
2 结果
2.1 技术成功率原发组和转移组共82例患者均进行CalliSpheres 载药栓塞微球化疗栓塞,技术成功率100%。
2.2 原发组和转移组患者DSA造影结果原发组病灶强化明显,肿瘤血供丰富,染色明显,继发组病灶呈环形强化,肿瘤血供稍差,染色浅淡。

表1 两组患者临床疗效对比[n(%)]

表2 两组患者肝功能术后对比

表3 两组患者术后不良反应对比[n(%)]
2.3 原发组和转移组临床疗效对比原发组和转移组治疗后的1个月疾病缓解率分别为74.14%和50.00%,疾病控制率分别为100.00%和75.00%,差异有统计学意义(P<0.05),具体结果见表1。治疗后2组患者肝功能生化指标比较,转移组肝功能损害程度高于原发组,具体结果见表2。两组患者术后均出现不同程度的不良反应,恶心、呕吐和/或肝区疼痛不适等,转移组发生概率高于对照组,具体结果见表3。两组患者均未出现肝脓肿,肝功能衰竭等严重并发症。
2.4 两组患者典型病例图1,患者男,67岁,术前诊断为原发性肝癌,肝脏增强CT提示肝左叶巨块型病灶,动脉期强化明显(1A),栓塞后1个月复查肝脏CT提示肝左叶病灶未见明显强化,肿瘤坏死,较术前明显缩小(1B)。术中经导管行肝动脉DSA造影显示肝左叶肿瘤染色明显(1C),采用CalliSpheres 载药微球栓塞后肝动脉DSA造影显示肝左叶肿瘤供血动脉阻断,无明显肿瘤染色(1D)。图2,患者男,71岁,诊断为结肠癌伴肝脏多发转移,肝脏增强CT提示肝右叶多发类圆形病灶,动脉期轻度强化(2A),栓塞后1个月复查肝脏CT提示病灶动脉期未见明显强化,肿瘤坏死,较术前有所缩小(2B)。术中经导管行肝动脉DSA造影,肝右叶肿瘤浅淡染色(2C),采用CalliSpheres 载药微球超选择栓塞后,行肝动脉DSA造影显示肝右叶肿瘤供血动脉阻断,未见明显肿瘤染色(2D)。
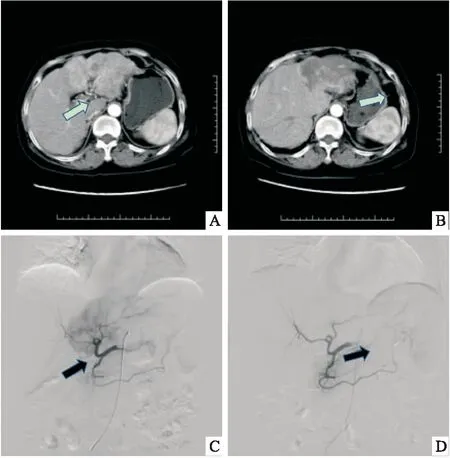
图1 原发性肝癌患者介入治疗前后CT及术中DSA造影
3 讨论
目前TACE仍是中晚期肝癌、外科术后复发性肝癌的主要治疗手段之一[6]。传统的TACE采用是液态碘化油加化疗药物充分乳化成乳化剂后经导管灌注栓塞病灶,但是这种乳化剂局部稳定性较差,化疗药物可以通过体循环进入全身各个系统,易导致不良反应,同时降低了局部疗效[7]。载药微球作为一种新型的栓塞材料应用于中晚期肝癌的介入[8-9]。载药微球具有良好的组织相容性、亲水性等优点,加载化疗药物后缓慢释放,使肿瘤内较长时间保持化疗药物的高浓度,最大程度提高了肿瘤的疗效,同时也提高了治疗的安全性。目前国内常用的栓塞微球主要有HepaSphere微球和国产CalliSpheres微球,目前国内已有临床研究两种微球在原发性肝癌的介入治疗疗效,但效果未见明显差异性[3,9-10]。
图2 转移性肝癌患者介入治疗前后CT及术中DSA造影
本研究采用的是国产CalliSpheres载药微球,观察原发性和转移性肝癌载药微球栓塞后的临床疗效和安全性。原发性肝癌1个月后复查影像学资料提示疾病缓解率达到74.14%,疾病控制率达到100.00%,结果与国内外报道基本相似,国内刘金等[9]报道的CalliSpheres载药微球栓塞术后疾病缓解率和控制率分别是75.0%和91.7%,国外Malagari et al[11]报道的HepaSphere载药微球栓塞术后疾病缓解率和控制率分别是68.9%和88.9%。然而,本研究中转移性肝癌的1个月疾病缓解率为50.00%,疾病控制率为75.00%, 相较于原发性肝癌,疗效较差,考虑与肝癌血供相关。原发性肝癌绝大多数是肝动脉参与供血,系富血供肿瘤,影像学检查,动脉期肿瘤明显强化,转移性肝癌绝大多数为乏血供肿瘤,在影像学检查中,大部分肿瘤动脉期呈环形轻度强化。原发性肝癌经导管肝动脉栓塞治疗较转移性肝癌更彻底。在肝功能影响上转移性肝癌治疗后大于原发性肝癌,主要因为转移性肝癌多数病灶多发,并且分散,又系乏血供,导管完全超选择肿瘤供血动脉困难,栓塞过程中难免误栓正常肝脏组织。并发症发生率与原发性肝癌传统TACE相似,DEB-TACE术后并发症主要有发热、恶心、呕吐、肝区疼痛不适等[2,12],大部分患者术后会出现转氨酶一过性升高[8]。目前有随机对照性临床试验研究证实,与传统TACE相比,DEB-TACE患者术后腹痛程度较轻[13]。在本研究中,2组患者术后均出现了不同程度的发热、恶心、呕吐、肝区疼痛不适等,但转移组并发症的发生率高于原发组,可能同样是因为转移性肝癌大部分为乏血供肿瘤,病灶多发,导管完全超选肿瘤供血动脉困难,正常肝脏误栓较多等原因。
本研究中的2组病例证实,国产CalliSpheres载药微球在肝癌的介入治疗中是安全有效的,能够达到一定临床疗效,同时并发症的发生轻微可逆,尤其是原发性肝癌患者,疗效确切。但是由于载药微球栓塞较彻底,病灶坏死程度较高,所以术中应尽量超选靶血管,避免误栓正常肝脏组织。由于本研究样本量有限,随访时间较短,非多中心联合研究,仍有一定局限性。因此,对于国产CalliSpheres载药微球的长期疗效,我们将进一步收集大样本,通过多中心联合研究等,以便得出更加准确、客观的结论。

