不同来源的胰腺星状细胞CircRNA表达谱差异分析
蔡 茗,邵 峰,林先盛,陶 冶,王思雨,黄 强
胰腺癌是一种的高恶性程度的消化道肿瘤,其发病率逐年攀升,患者预后极差。胰腺星状细胞(pancreatic stellate cells,PSCs)是一种位于胰腺周围的间质细胞,在正常胰腺中处于静息状态,而在胰腺癌的背景下,PSCs会被激活,转变为激活态[1-3]。激活态PSCs可以通过特定的基因来调控胰腺癌细胞的生长、侵袭和转移。研究[4]表明circRNA具有保守的结合位点,能以“分子海绵”的形式结合特定的促癌microRNA来使其下调,从而促进胰腺癌的侵袭和转移。目前已有研究证实组织块外植法和改良的酶消化密度梯度离心法可以分离出正常胰腺相关胰腺星状细胞(normal pancreas-associated pancreatic stellate cells ,NaPSCs)与癌症相关胰腺星状细胞(cancer-associated pancreatic stellate cells,CaPSCs)[1-3]。该实验在此基础上,以NaPSCs和CaPSCs作为切入点,以期寻找与CaPSCs调控胰腺癌细胞侵袭和转移相关的circRNA及其下游靶基因,进一步阐明胰腺癌发生和发展中的信号通路和生物学过程,同时为胰腺癌的靶向治疗提供新的思路和理论依据。
1 材料与方法
1.1 细胞系及主要试剂CaPSCs和NaPSCs由本课题组分离、纯化、培养得到。人胰腺癌细胞系Panc-1购自中科院上海细胞库。DMEM购自美国HyClone公司;胎牛血清(FBS) 购自以色列Biological Industries公司;胰蛋白酶、青霉素-链霉素双抗均购自美国赛默飞世尔科技公司;CCK-8试剂盒购自上海碧云天生物科技有限公司;RNA提取试剂TRIzol购自美国Invitrogen公司;RNA逆转录试剂盒购自美国Thermo Fisher公司。转录组高通量测序和随后的生物信息学分析在上海Genergy Biotech公司进行。
1.2 细胞系
1.2.1Panc-1细胞系 将Panc-1在添加了双抗(100 U/ml青霉素及100 μg/ml链霉素)的DMEM培养基(10% FBS)中于37 ℃、5%CO2培养箱内培养。
1.2.2CaPSCs和NaPSCs 本研究收集了安徽医科大学附属省立医院普外科2018年1~12月间的5例胰腺癌患者手术切除的胰腺癌组织和5例胰腺良性疾病患者手术切除的正常胰腺组织,按组织块外植法和改良的酶消化密度梯度离心法[1-3]对NaPSCs和CaPSCs进行分离,纯化。之后均在添加了双抗的DMEM(10% FBS)培养基中于37 ℃、5%CO2培养箱内培养。
1.3 细胞共培养将CaPSCs和NaPSCs分别与Panc-1细胞以Transwell体系进行共培养(6孔板),上层小室规格为4.6 cm2,在其中接种4×105个Panc-1细胞。下层孔板规格为9.6 cm2,在其中分别接种4×105个来源于不同患者的NaPSCs和CaPSCs,于37 ℃、5%CO2培养箱内共培养24 h再用于检测。
1.4 Panc-1细胞CCK-8检测将来自于不同患者的CaPSCs和NaPSCs共培养体系中的Panc-1细胞消化后,接种于96孔板中(3×103个细胞/孔)。然后参照CCK-8试剂盒说明书进行检测,方法如下:将处于对数生长期的Panc-1细胞进行消化后配制成细胞悬液,按3×103个细胞/孔接种于96孔板(100 μl/孔),设置空白对照(只加培养基),置于37 ℃、5%CO2培养箱中进行培养。待检测前每孔中加入10 μl CCK-8溶液后,将培养板放入培养箱中孵育3 h。以空白对照孔为参照调定零点,酶标仪上450 nm处测定各孔吸光度值(OD值) ,以相对应的OD比值表示细胞增殖能力的大小。各组取5孔平均值,绘制增殖曲线,实验均重复3次。
1.5 NaPSCs1和CaPSCs1的RNA高通量测序从CaPSCs1和NaPSCs1中各选取3个样本提取总RNA,分离纯化后反转录成互补脱氧核糖核酸(cDNA),然后进行RNA高通量测序。采用Deseq-2软件对测序数据进行差异表达分析,选取差异表达倍数≥2和P<0.05的基因作为有统计学意义的两组之间的差异表达基因,差异表达基因行使的主要生物学功能和信号通路由KEGG条目的分析来表示。并使用基于Arraystar的miRNA靶标预测软件,建立ceRNA网络,来预测circRNA与microRNA之间的相互作用。
1.6 qRT-PCR验证采用TRIzol试剂盒按说明书提取CaPSCs1和NaPSCs1的总RNA,用5 μl NaPSCs1和CaPSCs1的总mRNA经逆转录合成的cDNA为模板,然后在PikoReal RT-PCR系统(美国赛默飞世尔科技公司)上进行基于SYBR Green的RT-PCR确定RNA水平。反应条件如下:95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸30 s,40个循环,以Folds=2-ΔΔCt表示目的基因在实验组与对照组中表达的相对倍比关系。实验重复3次,计算平均值。各基因引物序列见表1。

表1 用于环状RNA水平qRT-PCR分析的引物序列
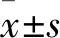
2 结果
2.1 Panc-1与不同来源的胰腺星状细胞共培养后的CCK-8增殖能力检测为了筛选出对Panc-1增殖能力影响最大的PSCs,将CaPSCs1~5和NaPSCs1~5与Panc-1细胞分别进行共培养后,对Panc-1细胞进行CCK-8实验。CaPSCs1~5组促进Panc-1细胞增殖的能力强于NaPSCs1~5组,差异有统计学意义(t=2.09,P<0.05),见图1A。同时,筛选出CaPSCs1~5中CaPSCs1促进Panc-1增殖能力最强,见图1B。筛选出NaPSCs1~5中NaPSCs1促进Panc-1增殖能力最弱,见图1C。
2.2 RNA高通量测序筛选差异RNA根据各组的上、下调基因,以不同实验组中和不同样品中Log2(差异表达倍数)为横坐标,以-Log10(P值)为纵坐标,绘制差异表达基因的火山图(图2)。如图2A所示,与NaPSCs1比较,CaPSCs1组有841个差异circRNA(其中下调的有453个,上调的有388个),其中差异表达最明显的circRNA为chr7:154954255|154998784(差异表达倍数=10.098,P<0.05)、chr10:12081472|12120267(差异表达倍数=10.077,P<0.05)以及chr10:76909966|77019099(差异表达倍数=9.714,P<0.05),差异均有统计学意义;如图2B所示,与NaPSCs1组比较,CaPSCs1组有8 155个差异mRNA (其中下调的有4 226个,上调的有3 929个);如图2C所示,与NaPSCs1比较,CaPSCs1组有73个差异microRNA (其中下调的有16个,上调的有57个)。

图1 CCK-8细胞增殖实验

图2 差异表达基因火山图
2.3 KEGG条目分析如图3所示,以富集的差异circRNA的基因计数为横坐标,以差异基因富集的信号通路为纵坐标,绘制KEGG条形图。基因计数越高,P值越小,差异基因富集越明显 。结果表明差异circRNA主要富集的信号通路为Toll样受体信号通路、TNF信号通路、T细胞受体信号通路和HIF-1信号通路。如图4所示,以富集的差异circRNA的基因比例为横坐标,以差异基因富集的生物过程为纵坐标绘制KEGG富集q值结果图。基因比例越高,P值越小,差异基因富集越明显。结果阐明KEGG基因富集主要集中在细胞-底物连接和细胞-基质黏附连接等生物过程。

图3 差异基因KEGG条形图
2.4 差异circRNA的靶基因预测如表2及图5所示,差异表达的circRNA: chr7:154954255|154998784、chr10:12081472|12120267以及chr10:76909966|77019099均有其对应的靶基因(microRNA)。
2.5 差异circRNA的qRT-PCR验证CaPSCs1中的3种circRNA相对表达量均高于NaPSCs1,与测序结果相符。所有结果均重复3次,差异有统计学意义。见图6。

图5 ceRNA网络

图6 3种circRNA在CaPSCs1和NaPSCs1的circRNA表达水平
3 讨论
目前,手术根治性切除是胰腺癌最有效的治疗方式,但大量的初诊患者因为肿瘤的侵袭和转移,而错过了胰腺癌根治性手术的时机。化疗和放疗目前也是治疗胰腺癌的方案之一,但效果不佳。近年来,PSCs相关靶向药物精准化治疗胰腺癌成为令人瞩目的焦点,研究表明PSCs与胰腺癌细胞共同构成了肿瘤发生发展的微环境[5]。即胰腺癌细胞产生的细胞因子可以通过多种信号途径来促进静息态PSCs产生α-SMA和I型前胶原C肽,使PSCs活化为激活态PSCs[6]。而激活态PSCs可以迅速增殖并主动迁徙,同时分泌多种信号分子,如结缔组织生长因子、TGF-β等 ,这些信号分子可以反过来作用于胰腺癌细胞,促进胰腺癌细胞生长、增殖和迁移[7-8]。PSCs不但能和胰腺癌细胞相互作用,还能与肿瘤微环境的其他细胞,如中性粒细胞、巨噬细胞等发生相互作用来促进胰腺癌的疾病进展[9-10]。由此可见,PSCs在胰腺癌的疾病进展中扮演着重要角色。因此,探明PSCs和胰腺癌细胞相互作用的具体机制可以为胰腺癌的靶向治疗方案提供重要指导。
circRNA是一种具有组织特异性的共价闭合环状结构的非编码RNA,且比线性RNA更为稳定,并具有基因调控功能。目前,研究证实了circRNA在包括胰腺癌在内的多种恶性肿瘤的发生和发展中有着不可替代的作用[11],而且circRNA还与癌症相关的microRNA存在着联系,其以circRNA-microRNA调控轴的形式参与了癌症发生和发展的过程[12]。但关于PSCs是否能通过circRNA-microRNA调控轴靶向调控胰腺癌肿瘤进展的研究则未有过报道。因此,本研究分离培养了不同来源的PSCs,然后通过将其与Panc-1细胞共培养来模拟胰腺癌背景下的细胞微环境。之后利用CCK-8实验对共培养后的PSCs进行筛选,并最终得到了CaPSCs1和NaPSCs1。之后我们用RNA高通量测序分析并比较了这两种细胞的RNA表达谱,得到了9 069个差异有统计学意义的基因。同时,为排除筛选数据假阳性的可能性,本研究选择前3位差异性表达最大的circRNA:chr7:154954255|154998784、chr10:12081472|12120267以及chr10:76909966|77019099进行qRT-PCR验证了其与测序结果一致,并用CeRNA网络预测了其对应的下游靶基因(microRNA)分别为hsa-miR-612、hsa-miR-1301-3p、hsa-miR-4459。这为建立PSCs相关的circRNA-microRNA调控通路提供了依据。本研究还将筛得的差异表达基因进行KEGG条目分析发现了差异基因富集的信号传导通路为Toll样受体信号通路、TNF信号通路、T细胞受体信号通路、HIF-1信号通路等。这一结果表明,差异表达基因可能直接或间接参与胰腺癌的增殖和侵袭的多种信号传导环节,同时也说明人胰腺癌发生、发展过程中基因调控改变的复杂性生物过程。KEGG生物过程则主要富集在细胞-底物连接和细胞-基质黏附连接等方面。研究[13]表明不同疾病环境中分离出的PSCs保持不同的表型是细胞-基质相互作用的结果。此外,Apte et al[14]证明了细胞外基质的组成能影响PSCs基因的表达模式。Bynigeri et al[15]认为PSCs-基质,PSCs-底物之间的相互作用是动态的,即早期发挥抗癌作用,而在后期则产生促癌作用。因此,胰腺癌中PSCs相关的细胞-底物连接和细胞-基质黏附连接可以有助于阐明肿瘤细胞与基质细胞之间相互作用的机制,这将为基质靶向治疗提供新的靶点。
综上,本研究比较了从胰腺癌组织和正常胰腺组织中培养的原代CaPSCs1和NaPSCs1之间circRNA表达谱的差异,并对PSCs促进胰腺癌进展的circRNA-microRNA调控通路和差异基因富集的生物学途径进行了初步探讨。后续的研究将对胰腺癌细胞和正常胰腺细胞中circRNA表达谱的差异进行比较,同时进一步增加本研究的样本量,并进行体外动物实验以及细胞功能学实验。

