铝酸钠溶液全碱分析的影响因
李银菊

摘 要:铝酸钠溶液全碱分析属于酸碱滴定分析,分析过程酸碱反应生成的CO2,对滴定分析结果造成影响,所以溶液要进行煮沸1-2min,以赶跑溶液中的CO2,但同时溶液中过量的盐酸的挥发,指示剂指示终点的变化,也对滴定分析结果造成影响。本文主要探讨全堿分析过程对滴定分析结果的影响因素。
关键词:铝酸钠溶液;温度;挥发;酚酞指示剂
1 背景
拜耳法氧化铝生产过程物料--铝酸钠溶液,在各生产阶段了解其中的全碱含量,是生产过程中一项重要的分析指标,对氧化铝生产管理控制有着重要的意义。铝酸钠溶液中碱存在的形式有苛性碱和碳酸碱,这两种碱的总和称为全碱,所以全碱的分析实际是对这两种形式碱含量的分析。苛性碱是指铝酸钠溶液中游离的OH-根,以Na2OK来表示;而铝酸钠溶液中CO3-的含量以Na2OC来表示,即碳酸碱;全碱则以Na2OT表示。
2 全碱分析方法
在测定全碱时,同时对铝酸钠溶液中氧化铝含量进行测定。用过量的EDTA络合氧化铝,再在试样溶液中加入过量的盐酸,进行加热煮沸1-2min,使反应完全,然后用标准氢氧化钠溶液返滴定过量的盐酸,测定全碱含量;再用标准醋酸锌溶液返滴定过量的EDTA,测定氧化铝含量。但在滴定全碱含量过程,过剩的EDTA在酚酞变色时,要离解出一个氢离子,消耗等当量的碱,因此计算全碱时应加以补正。以下为相关的化学反应式:
加入过量EDTA和盐酸化学反应式:
NaAl(OH)4+Na2H2Y+2HCl(pH=5)→NaAlY+2NaCl+4H2O
NaOH+HCl→NaCl+H2O
Na2CO3+2HCl→2NaCl+H2O+CO2
返滴定化学反应式:
HCl+NaOH→NaCl+H2O
NaAlY+NaOH→Na2Al(OH)Y
Na2H2Y+NaOH→NaAlY+H2O
式中Na2H2Y为EDTA二钠。
分析结果计算:
式中:
V-所取试样的毫升数;
V1-加入0.3226mol/L盐酸标准溶液的毫升数;
V2-消耗0.3226mol/L氢氧化钠标准溶液的毫升数;
V3-消耗0.03226mol/L醋酸锌标准溶液的毫升数。
3 分析过程的影响因素
由于全碱分析属于酸碱滴定分析,所使用的指示剂为绿光--酚酞指示剂,滴定达到终点时pH=9左右,偏碱性。而铝酸钠溶液溶液中碳酸碱在跟盐酸反应后生成的CO2,在水溶液中有一定的溶解度,根据相关文献,酸碱滴定在达到滴定终点时,在水溶液中CO2有94%左右以HCO3-形式存在,HCO3-是CO2跟氢氧化钠反应的产物,说明滴定过程溶液中的CO2消耗了氢氧化钠,影响分析结果。所以在进行酸碱滴定前,溶液要进行煮沸1-2min排除CO2,以减小分析误差。但在煮沸过程中溶液过量的盐酸也会造成挥发,从而影响分析结果。同时滴定分析使用的绿光--酚酞指示剂在不同的温度下,达到变色点不同,也会对分析结果造成影响。
3.1 溶液中CO2的影响
铝酸钠溶液在加入过量盐酸时,其中的碳酸碱跟盐酸反应生产CO2,CO2能溶解在水中,跟水反应生产碳酸,常温、常压条件下其在水中的溶解度在0.05%以下,饱和溶液的浓度为0.033mol/L,在水溶液中大部分以水合物的形式存在,只有1%CO2与水化合形成碳酸。溶液中存在的CO2在以酚酞为指示剂,滴定达到变色终点时,会跟氢氧化钠标准溶液反应,影响分析结果。CO2在水中溶解度跟温度成反比关系,随温度的升高而降低。实验室在常压下,以溶液煮沸1-2min,达到排除CO2的目的。
3.2 煮沸溶液盐酸挥发的影响
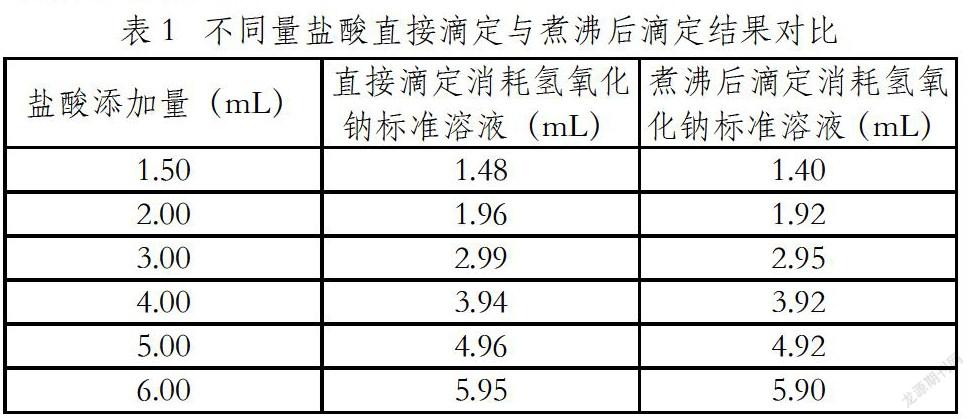
溶液在加入过量盐酸后,需煮沸1-2min,以排除溶液中的CO2,但在煮沸过程,溶液中过量的盐酸也会挥发,对分析结果造成影响。根据实际样品分析时溶液的总量以纯水代替,再加入盐酸过量的量,一份直接用氢氧化钠标准溶液滴定,另一份进行煮沸2min后,再进行滴定。滴定结果如下表1:
3.3 溶液温度对滴定的影响
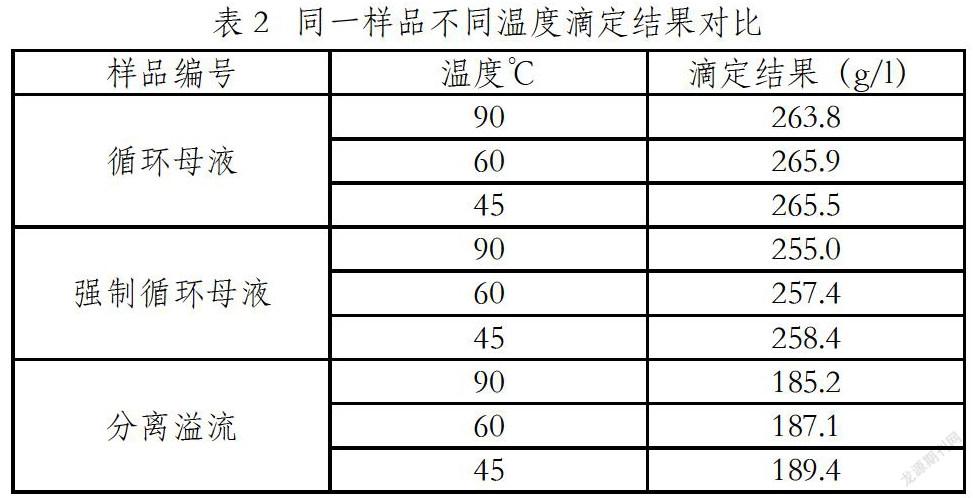
酚酞指示剂本身是有机弱酸,其能作为指示剂是酚酞分子在不同的稀酸、稀碱溶液中形成不同型体,在用标准氢氧化钠溶液返滴定过量的盐酸过程中,溶液pH值由酸性到滴定达到终点时pH=9左右,偏碱性。酚酞分子由无色的内酯型结构逐步转变成红色的醌式结构,达到指示滴定终点的目的。由于酚酞指示剂本身是有机弱酸,所以在溶液中存在无色内酯型结构与红色的醌式结构电离平衡,而溶液温度对这一电离平衡移动有影响,不同温度全碱滴定结果,如表2。
4 影响因素分析
CO2能溶解在水中,在以酚酞为指示剂进行溶液滴定,达到变色点时pH=9左右,溶液中的CO2跟氢氧化钠标液反应,造成分析结果偏低,所以滴定前需要煮沸1-2min,排除溶液中的CO2。从表1可以看出,由于盐酸极易挥发,溶液煮沸过程,造成盐酸的挥发加速,使分析结果偏高。虽然溶液温度升高有利于酚酞指示剂的电离,解离出更多的红色的醌式结构,使滴定终点提前,但从表2的对比数据可以看出,同一样品在不同溶液温度下,随温度的升高分析结果偏低,说明溶液温度的升高可能使酚酞指示剂电离平衡向无色内酯型结构移动,或者温度升高使酚酞分子发生内部结构重排,使红色醌式结构减少,滴定分析时只有在滴加更多的氢氧化钠标液后,红色的醌式结构达到一定浓度时,人眼才能识别出颜色的变化,从而造成分析结果偏低。
5 结论
样品分析过程产生的CO2可以通过煮沸,消除影响,但同时必须注意盐酸的挥发会造成分析结果偏高,溶液的温度会影响酚酞指示剂的滴定终点,且随温度的升高,使分析结果偏低。
参考文献:
[1]吴淑琰,应桃开.中学化学教学中结合真实生活背景的调查与分析[J].化学教育,2007,028(04):38-39,51.
[2]王万林,史建公,刘鑫.酚酞指示剂在酸溶液中的颜色变化及其变色机理[J].化学世界,2010(03):189-191.

