肌红蛋白血红素辅基与珠蛋白相互作用机制
朱宏星 王道营 徐为民 孙冲 葛庆丰 周宝晶 刘潇


摘 要:通过紫外-可见光谱、荧光光谱和分子对接技术研究血红素辅基与珠蛋白相互作用的机制。紫外-可见光谱结果表明,血红素辅基对珠蛋白的二级结构产生了影响;荧光光谱分析表明,血红素辅基与珠蛋白结合生成复合物,产生静态荧光猝灭,288、298、308 K下的结合常数分别为1.497×109、3.818×109、1.327×1010 L/mol,结合位点数为1.87±0.12,血红素辅基对珠蛋白的结合作用力主要是疏水相互作用;同时通过分子对接技术确定了氢键对维持肌红蛋白空间结构的稳定性也极为重要;紫外-可见光谱、荧光光谱和分子对接结果均互相印证。
关键词:肌红蛋白;血红素辅基;珠蛋白;相互作用;肉品品质
Abstract: In this experiment, the mechanism of the interaction between the heme prosthetic group of myoglobin and globin was studied by means of ultraviolet (UV)-visible spectroscopy, fluorescence spectroscopy and molecular docking. The influence of the hemin prosthetic group on the secondary structure of globin was proved by the UV-visible spectroscopic results. Fluorescence quenching analysis showed that the heme prosthetic group could be combined with globin to form a complex via hydrophobic interaction. The binding constants were 1.497 × 109, 3.818 × 109, and 1.327 × 1010 L/mol at 288, 298 and 308 K, respectively, and the number of binding sites was 1.87 ± 0.12. Molecular docking results further indicated that hydrogen bonding plays a vital role in the spatial structure of myoglobin. All results obtained in this study were consistent with one another.
Keywords: myoglobin; hemin prosthetic group; globin; interaction; meat quality
DOI:10.7506/rlyj1001-8123-20200427-107
中圖分类号:TS251.1 文献标志码:A 文章编号:1001-8123(2020)07-0007-06
引文格式:
朱宏星, 王道营, 徐为民, 等. 肌红蛋白血红素辅基与珠蛋白相互作用机制[J]. 肉类研究, 2020, 34(7): 7-12. DOI:10.7506/rlyj1001-8123-20200427-107. http://www.rlyj.net.cn
ZHU Hongxing, WANG Daoying, XU Weimin, et al. Mechanism of interaction between heme prosthetic group of myoglobin and globin[J]. Meat Research, 2020, 34(7): 7-12. DOI:10.7506/rlyj1001-8123-20200427-107. http://www.rlyj.net.cn
肌红蛋白由含1 条多肽链的珠蛋白和1 个血红素辅基(卟啉环-Fe络合物)构成,是肉品的主要呈色物质[1]。血红素辅基是一个具有卟啉环结构的小分子,每个血红素辅基由4 个杂环化合物吡咯组成1 个卟啉平面环,环中心为1 个亚铁离子或铁离子[2],分别称亚铁血红素和高铁血红素,分子式均为C34H32N4FeO4,亚铁血红素很容易被氧化成高铁血红素[3]。
血红素辅基中心卟啉铁价位的改变以及血红素辅基与珠蛋白结合力的变化影响肉色变化[4]。血红素辅基具有亲合性,除了由于血红素辅基卟啉环上的铁原子与珠蛋白肽链上氨基酸形成配位键外[5],血红素辅基亲水性丙酸基团可以以氢键与邻近珠蛋白上的氨基酸发生相互作用,同时血红素辅基与珠蛋白的亲合力还与肌红蛋白分子存在疏水性的空腔有关,这些结合力能够稳定肌红蛋白结构[6]。但是,肌红蛋白中这些结合力的稳定性受很多因素影响,血红素辅基与珠蛋白配位键的强度与pH值、温度和连接的氨基酸等因素有关[7-9]。氢键对肌红蛋白空间结构的稳定性极为重要,特别是对二级结构的形成起关键作用[10]。温度、pH值、盐、酶类等均会导致氢键改变,从而影响肌红蛋白的空间结构。疏水作用是蛋白质折叠的主要驱动力[11-12],当蛋白质外部的亲水基团受到破坏(如高温和高盐)或与非极性基团(如表面活性剂的非极性基团)相互作用时,疏水基团就会暴露出来,疏水作用力则被破坏。这些结合力的改变都有可能使肌红蛋白构象发生改变,血红素辅基就有可能暴露,甚至从肌红蛋白中脱落[13]。
近年来,采用光谱法研究小分子和蛋白质的相互作用已成为生命科学、化学、药学和食品科学等领域的研究热点[14-17]。本研究采用紫外-可见光谱、荧光光谱及分子对接技术分析血红素辅基与珠蛋白的相互作用,从而得到二者之间如结合常數、结合位点数、作用力类型以及结合位点等重要信息。通过揭示血红素辅基与珠蛋白的相互作用,为控制肌红蛋白血红素辅基的脱落、稳定肉色、提高肉品品质提供参考。
1 材料与方法
1.1 材料与试剂
珠蛋白 南京金斯瑞生物科技有限公司;血红素辅基 美国Sigma-Aldrich公司。
1.2 仪器与设备
HH-4数显恒温水浴锅 常州国华电器有限公司;FE20/FG2 pH计、AL电子天平 瑞士梅特勒-托利多集团;多功能酶标仪 美国Biotek仪器有限公司;1500圆二色谱仪 日本Jasco公司;LS-55荧光分光光度计 美国Perkin Elmer公司。
1.3 方法
1.3.1 溶液配制
准确称取血红素辅基粉末0.016 3 g,用30 mmol/L NaOH溶液配制成浓度为1 mmol/L的储备液并4 ℃避光保存;用磷酸盐缓冲液(phosphate buffered saline,PBS)(含85 mmol/L氯化钠、20 mmol/L磷酸氢二钠、20 mmol/L磷酸二氢钠,pH 7.0)将储备液稀释成浓度分别为4×10-6、6×10-6、8×10-6、10×10-6、12×10-6、14×10-6、16×10-6、20×10-6、24×10-6、28×10-6 mol/L的血红素辅基溶液,4 ℃避光保存备用。
将珠蛋白用pH 7.0的PBS稀释至所需浓度,4 ℃避光保存备用。
1.3.2 紫外-可见光谱法分析
采用多功能酶标仪对血红素辅基与珠蛋白混合液进行紫外-可见光谱研究。
将1 mL浓度为26×10-6 mol/L的珠蛋白溶液分别与1 mL浓度为4×10-6、8×10-6、12×10-6、16×10-6、20×10-6、24×10-6、28×10-6 mol/L的血红素辅基溶液于比色管中混合,对照组为1 mL PBS和1 mL珠蛋白溶液的混合溶液,25 ℃孵育1 h后进行检测,检测波长为240~320 nm[18]。
1.3.3 圆二色性光谱法分析珠蛋白二级结构变化
采用圆二色谱仪分析血红素辅基与珠蛋白作用后珠蛋白的二级结构变化。
将1 mL浓度为13×10-6 mol/L的珠蛋白溶液分别与1 mL浓度为4×10-6、6×10-6、8×10-6、10×10-6、12×10-6、14×10-6、16×10-6 mol/L的血红素辅基溶液混合。对照组为1 mL PBS和1 mL珠蛋白的混合溶液。25 ℃恒温孵育1 h后进行检测,检测波长为190~240 nm[19]。
1.3.4 荧光光谱法分析血红素辅基与珠蛋白相互作用的荧光猝灭机理
采用荧光分光光度计分析血红素辅基与珠蛋白的结合常数和结合位点数。通过改变温度的方式判断两分子是否是形成了复合物[20]。
将1 mL浓度为26×10-6 mol/L的珠蛋白溶液分别与1 mL浓度为4×10-6、8×10-6、12×10-6、16×10-6、20×10-6、24×10-6、28×10-6 mol/L的血红素辅基溶液混合,转移至比色管中,对照组为1 mL PBS和1 mL珠蛋白溶液的混合溶液。按上述方法配制3 组待测混合液,分别在15、25、35 ℃(288、298、308 K)恒温孵育1 h后进行荧光光谱扫描。参数设置为:发射波长290~550 nm,固定激发波长280 nm,激发和发射狭缝宽度分别为8 nm和5 nm,扫描速率300 nm/min,测定并记录相应的荧光强度[21]。
动态猝灭符合Stern-Volmer方程[22],如式(1)所示。
静态猝灭符合Lineweaver-Burk方程[23],如式(2)所示。
式中:F0和F分别为未加入和加入血红素辅基时珠蛋白的荧光强度;Kq为双分子猝灭过程的速率常数/(L/(mol·s));τ0为猝灭剂不存在时荧光分子的平均寿命(10-8 s);Ksv为动态猝灭常数/(L/mol);[Q]为猝灭剂血红素辅基的浓度/(mol/L);Ka为血红素辅基与珠蛋白的结合常数/(L/mol);n为结合位点数。
1.3.5 血红素辅基与珠蛋白结合作用力的测定
为判断血红素辅基与珠蛋白之间的相互作用,可以根据反应前后的热力学焓变(ΔH)、熵变(ΔS)和自由能变化(ΔG)进行判断[24]。根据Vant Hoff方程计算ΔH和ΔS[25],如式(3)所示。
式中:R为热力学气体常数(8.314 J/(mol·K));Ka为血红素辅基与珠蛋白的结合常数/(L/mol);T为热力学温度/K。
以lnKa对1/T作线性图,由式(4)计算ΔG,若ΔG<0,则两分子间的反应为自发反应。
1.3.6 分子对接模拟技术建立血红素辅基与珠蛋白分子间作用模型
从蛋白质数据库(www.rcsb.org)中下载珠蛋白的晶体结构,用AutoDockTools软件对珠蛋白晶体结构进行前期优化,除水、加氢、调整电荷等均使用系统默认值进行系列优化。将系列优化后的珠蛋白与血红素辅基通过AutoDock软件自带的模建规则和Python脚本,建立血红素辅基与珠蛋白分子间作用模型。首先,利用半柔性对接方法使得血红素辅基与珠蛋白在活性区域内相互契合,再根据基于全最小二乘准则的线性聚类算法进行构象搜索,得到最有可能的分子间作用方式,基于经验性函数对分子对接进行结合自由能计算,最后根据打分函数评价对接结果,获得合理的血红素辅基与珠蛋白分子间作用模型,进而结合光谱实验数据评估血红素辅基与珠蛋白分子间作用模型的合理性[26]。
1.4 数据处理
采用Excel软件和Origin 8.5.1软件进行数据分析和绘图;采用AutoDockTools软件进行分子对接模拟实验的前期优化及后期分析,采用AutoDock软件完成分子对接实验。
2 結果与分析
2.1 紫外-可见吸收光谱分析结果
由图1可知,珠蛋白在280 nm波长处有明显的紫外吸收峰,这是由于肽链上的色氨酸和酪氨酸的芳杂环发生了π→π*电子跃迁[27-29],随着血红素辅基浓度的提高,珠蛋白紫外吸收峰峰值有增大趋势,说明血红素辅基与珠蛋白发生了相互作用,证明血红素辅基的加入使珠蛋白的微环境发生变化[30]。
2.2 圆二色性光谱分析结果
0~7. 血红素辅基浓度分别为0、4×10-6、6×10-6、8×10-6、10×10-6、12×10-6、14×10-6、16×10-6 mol/L。
在圆二色性光谱中,珠蛋白溶液在208、222 nm波长处呈现双负峰,190 nm波长附近有1 个正峰,为α-螺旋特征峰。由图2可知,与不添加血红素辅基的珠蛋白溶液相比,添加不同浓度血红素辅基的珠蛋白溶液负峰与正峰的强度均明显增强。加入血红素辅基后的珠蛋白无规卷曲相对含量发生微小变化,α-螺旋相对含量明显升高,β-折叠相对含量明显降低,表明血红素辅基主要通过改变α-螺旋和β-折叠影响珠蛋白的结构,使珠蛋白肽链发生收缩,疏水性增强[31]。上述结果说明,血红素辅基改变了珠蛋白的构象。
2.3 血红素辅基对珠蛋白的荧光猝灭机理
由图3可知,在280 nm激发波长下,珠蛋白在335 nm波长处产生最大荧光发射峰。不同温度下(288、298、308 K),随着血红素辅基浓度的提高,荧光峰均逐渐变宽,荧光强度呈规律性降低趋势,最后荧光猝灭程度趋于稳定。
以血红素辅基浓度为横坐标,F0/F为纵坐标,绘制不同温度下珠蛋白的荧光猝灭Stern-Volmer曲线,如图4所示。
由表1可知,在288、298、308 K下求得的Ksv分别为4.756×105、4.546×105、4.321×105 L/mol。随着温度的升高,Ksv减小,且3 种温度下,Kq均远大于各类猝灭剂对生物大分子最大扩散碰撞猝灭的速率常数2.0×1010 L/(mol·s)[32],因此可以判断血红素辅基对珠蛋白作用产生的猝灭现象不是动态猝灭,而主要是形成了复合物的静态猝灭。
2.4 血红素辅基与珠蛋白的结合常数和结合位点数
血红素辅基与珠蛋白的结合属于静态猝灭,符合Lineweaver-Burk方程。因此,以lg[Q]为横坐标,以lg[(F0-F)/F]为纵坐标,绘制不同温度下lg[(F0-F)/F]-lg[Q]双对数曲线图。通过计算可以求得血红素辅基与珠蛋白作用的结合常数(Ka)和结合位点数(n)。
由图5和表2可知,不同温度下,血红素辅基与珠蛋白作用的Ka较大,且变化不大,说明该反应的结合作用较稳定,288、298、308 K下Ka分别为1.497×109、3.818×109、1.327×1010 L/mol。可以推断血红素辅基与珠蛋白之间存在较高的结合力,3 个温度下的平均结合位点数约为1.87。
2.5 血红素辅基与珠蛋白结合作用力类型
由血红素辅基与珠蛋白相互作用的lnKa-1/T线性方程计算出ΔH=79.46 kJ/mol,ΔS=451.06 J/(mol·K)。
由表3可知,ΔG<0,说明血红素辅基对珠蛋白的反应是自发进行的。其中ΔH>0、ΔS>0,推测珠蛋白与血红素辅基结合的主要作用力为疏水相互作用。
2.6 血红素辅基与珠蛋白的结合特性
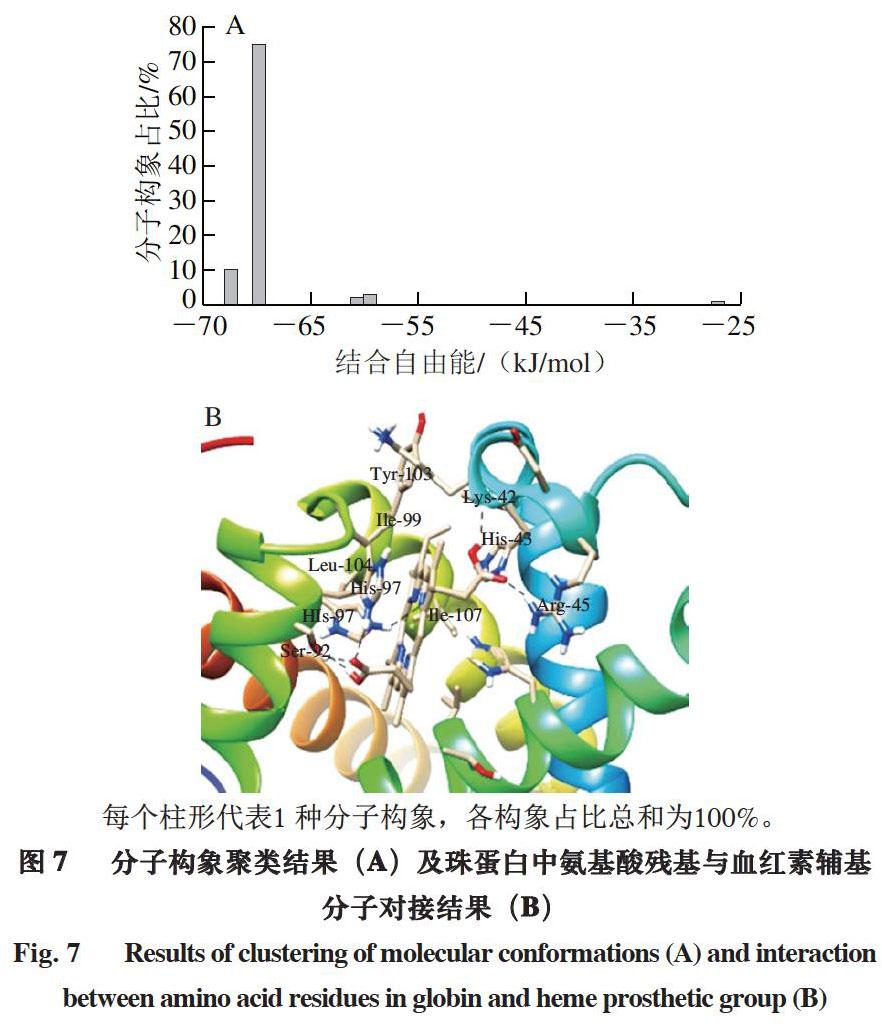
每个柱形代表1 种分子构象,各构象占比总和为100%。
利用AutoDock软件对血红素辅基与珠蛋白所形成复合物的结构进行分子对接研究,选取数目最多、能量最低的构象作为代表性构象,再分析主客体间相互作用情况。由图7可知,血红素辅基结合区域的疏水性口袋由Tyr-103、Lys-42、Ile-99、His-43、Arg-45、His-64、Ile-107、Leu-104、His-97、His-93和Ser-92构成。主客体之间存在疏水相互作用。血红素辅基同His-97、Arg-45、Lys-42、His-93、Ser-92残基间存在氢键作用,键长依次为1.950、2.274、2.434、2.431、2.309、2.400 ?。因此,血红素辅基和珠蛋白之间存在较高的亲合力。通过计算,血红素辅基与珠蛋白的结合自由能为-67.88 kJ/mol。当前选取的优势构象在分子对接模拟结果中的占比达到75%,通过计算结果可以认为,在实际对接过程中该构象是最合理的。
3 结 论
利用紫外-可见光谱法、荧光光谱法和分子对接技术研究血红素辅基与珠蛋白的相互作用。紫外-可见光谱结果表明,随着血红素辅基浓度的增大,280 nm波长处珠蛋白的特征吸收峰逐渐升高,说明血红素辅基对珠蛋白的二级结构产生了影响;荧光光谱法研究结果表明,血红素辅基与珠蛋白结合生成复合物,产生静态荧光猝灭,求得血红素辅基与珠蛋白的结合常数及结合位点数;同时确定了血红素辅基对珠蛋白的结合作用力主要是疏水相互作用;通过分子对接确定了氢键对维持肌红蛋白空间结构的稳定性也极为重要,特别是对二级结构的形成起关键作用。但这些结合力易受如温度、pH值等因素的影响,从而使肌红蛋白构象发生改变,导致血红素辅基暴露,甚至从肌红蛋白中脱落,造成对肉品品质的不良影响,如肉品色泽劣变、加快脂质氧化等。本研究能够为探索血红素辅基与珠蛋白的相互作用以及更有效地控制肉品品质提供参考。
参考文献:
[1] SEIDEMAN S C, CROSS H R, SMITH G C, et al. Factors associated with fresh meat color: a review[J]. Journal of Food Quality, 1984, 6(3): 211-237. DOI:10.1111/j.1745-4557.1984.tb00826.x.
[2] 朱宏星, 孙冲, 王道营, 等. 肌红蛋白理化性质及肉色劣变影响因素研究进展[J]. 肉类研究, 2019, 33(6): 55-63. DOI:10.7506/rlyj1001-8123-20190415-080.
[3] PHILLIPS J D. Heme biosynthesis and the porphyrias[J]. Molecular Genetics and Metabolism, 2019, 128(3): 164-177. DOI:10.1016/j.ymgme.2019.04.008.
[4] SUMAN S P, JOSEPH P. Myoglobin chemistry and meat color[J]. Annual Review of Food Science and Technology, 2013, 4: 79-99. DOI:10.1146/annurev-food-030212-182623.
[5] MOCZYGEMBA C, GUIDRY J, WITTUNG-STAFSHEDE P. Heme orientation affects holo-myoglobin folding and unfolding kinetics[J]. FEBS Letters, 2000, 470(2): 203-206. DOI:10.1016/S0014-5793(00)01319-3.
[6] MONDAL S, RAPOSO M L, GHOSH A, et al. Physicochemical and conformational studies on interaction of myoglobin with an amino-acid based anionic surfactant, sodium N-dodecanoyl sarcosinate(SDDS)[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2019, 577: 167-174. DOI:10.1016/j.colsurfa.2019.05.061.
[7] BADEN N, TERAZIMA M. Intermolecular Interaction of myoglobin with water molecules along the pH denaturation curve[J]. The Journal of Physical Chemistry B, 2006, 110(31): 15548-15555. DOI:10.1021/jp0602171.
[8] MEERSMAN F, SMELLER L, HEREMANS K. Comparative fourier transform infrared spectroscopy study of cold-, pressure-, and heat-induced unfolding and aggregation of myoglobin[J]. Biophysical Journal, 2002, 82(5): 2635-2644. DOI:10.1016/S0006-3495(02)75605-1.
[9] 劉越, 孙冲, 李鹏鹏, 等. 高效液相色谱分析不同理化因素对血红素辅基稳定性的影响[J]. 江苏农业科学, 2018, 46(16): 145-149. DOI:10.15889/j.issn.1002-1302.2018.16.037.
[10] BIKADI Z, DEMKO L, HAZAI E. Functional and structural characterization of a protein based on analysis of its hydrogen bonding network by hydrogen bonding plot[J]. Archives of Biochemistry and Biophysics, 2007, 461(2): 225-234. DOI:10.1016/j.abb.2007.02.020.
[11] ZHOU R H, HUANG X H, MARGULIS C J, et al. Hydrophobic collapse in multidomain protein folding[J]. Science, 2004, 305: 1605-1609. DOI:10.1126/science.1101176.
[12] PACE C N, FU H, FRYAR K L, et al. Contribution of hydrophobic interactions to protein stability[J]. Journal of Molecular Biology, 2011, 408(3): 514-528. DOI:10.1016/j.jmb.2011.02.053.
[13] DROGHETTI E, SUMITHRAN S, SONO M, et al. Effects of urea and acetic acid on the heme axial ligation structure of ferric myoglobin at very acidic pH[J]. Archives of Biochemistry and Biophysics, 2009, 489(1/2): 68-75. DOI:10.1016/j.abb.2009.07.008.
[14] 智丽飞, 王秀文, 李晓明, 等. 光谱法研究一种葡萄糖酰胺阳离子表面活性剂与BSA的相互作用[J]. 化学研究与应用, 2019, 31(7): 1299-1305. DOI:10.3969/j.issn.1004-1656.2019.07.011.
[15] 岳鑫, 包怡红. 基于荧光及紫外光谱法对红松种鳞多酚与乳清蛋白相互作用的研究[J]. 现代食品科技, 2019, 35(7): 114-120. DOI:10.13982/j.mfst.1673-9078.2019.7.016.
[16] 施沈佳, 李剑瑛, 黎中宝, 等. 没食子酸与牛血红蛋白相互作用的研究[J]. 生物技术进展, 2019, 9(1): 54-61. DOI:10.19586/j.2095-2341.2018.0103.
[17] 顾佳丽, 伊鲁东, 李东玲, 等. 光谱法研究小分子与蛋白质间相互作用的进展[J]. 科学技术与工程, 2018, 18(14): 85-90. DOI:10.3969/j.issn.1671-1815.2018.14.014.
[18] 陈凤英, 金振国, 杨林, 等. 紫外吸收光谱法和电化学法研究 原儿茶醛与牛血清蛋白的相互作用及共存金属离子的影响[J]. 分析试验室, 2019, 38(11): 1289-1294. DOI:10.13595/j.cnki.issn1000-0720.2019.013002.
[19] 郭庆英, 刘敏, 赵燕娜, 等. 表没食子儿茶素没食子酸酯对柔红霉素与人血清白蛋白相互作用影响的光谱学及细胞毒性研究[J].
光谱学与光谱分析, 2020, 40(6): 1821-1827. DOI:10.3964/j.issn.
1000-0593(2020)06-1821-07.
[20] 王秀文, 王颖莉, 于茜, 等. 采用荧光光谱法研究DDAF与BSA的相互作用[J]. 中国测试, 2019, 45(7): 80-86. DOI:10.11857/j.issn.1674-5124.2018110075.
[21] 王晓霞, 聂智华, 李松波, 等. 多光谱法与分子对接法研究盐酸四环素与牛血清白蛋白的相互作用[J]. 光谱学与光谱分析, 2018, 38(8): 2468-2476. DOI:10.3964/j.issn.1000-0593(2018)08-2468-09.
[22] KUMAR S, HALDER S, KUMARI S, et al. Study on interactions of cationic gemini surfactants with folded and unfolded bovine serum albumin: effect of spacer group of surfactants[J]. Journal of Molecular Liquids, 2017, 243: 369-379. DOI:10.1016/j.molliq.2017.07.122.
[23] AKRAM M, ANSARI F, BHAT I A, et al. Probing interaction of bovine serum albumin (BSA) with the biodegradable version of cationic gemini surfactants[J]. Journal of Molecular Liquids, 2019, 276: 519-528. DOI:10.1016/j.molliq.2018.10.123.
[24] 梅杰, 彭晓旋, 范智恒, 等. 白杨素与瘦素蛋白相互作用研究[J]. 中国中药杂志, 2018, 43(12): 2563-2569. DOI:10.19540/j.cnki.cjcmm.20180228.002.
[25] REZENDE J D P, HUDSON E A, DE PAULA H M C, et al. Human serum albumin-resveratrol complex formation: effect of the phenolic chemical structure on the kinetic and thermodynamic parameters of the interactions[J]. Food Chemistry, 2020, 307: 125514. DOI:10.1016/j.foodchem.2019.125514.
[26] 周凤, 郑韦韦, 刘鹏飞, 等. 钙调蛋白质与富勒烯结合模式的分子对接研究[J]. 湖北医药学院学报, 2019, 38(5): 422-425; 414; 515. DOI:10.13819/j.issn.2096-708X.2019.05.002.
[27] 朱姝冉, 张淼, 周光宏, 等. 利用光谱技术分析加热温度对肌红蛋白结构的影响[J]. 食品工业科技, 2018, 39(24): 35-39. DOI:10.13386/j.issn.1002-0306.2018.24.006.
[28] 劉康, 胡承孝, 蔡苗苗, 等. 硒对铬-牛血清白蛋白互作光谱特征的影响[J]. 浙江农业学报, 2020, 32(1): 149-159. DOI:10.3969/j.issn.1004-1524.2020.01.19.
[29] 张剑, 张博, 韩禄, 等. 紫外分光光度法测定维拉帕米与牛血清白蛋白相互作用结合常数[J]. 化学研究与应用, 2019, 31(7): 1347-1350. DOI:10.3969/j.issn.1004-1656.2019.07.018.
[30] 龚含情, 陈建波. 利用光谱法和分子对接技术研究4-乙基-2-甲氧基苯酚与人血清白蛋白之间的相互作用[J]. 光谱学与光谱分析, 2018, 38(6): 1869-1873. DOI:10.3964/j.issn.1000-0593(2018)06-1869-05.
[31] 王晓霞, 聂智华, 马力通, 等. 多光谱法和分子对接模拟法研究美满霉素与牛血清白蛋白的相互作用[J]. 光谱学与光谱分析, 2020, 40(5): 1503-1508. DOI:10.3964/j.issn.1000-0593(2020)05-1503-06.
[32] 刘勤勤, 朱科学, 郭晓娜, 等. 茶多酚与大豆分离蛋白的相互作用[J]. 食品科学, 2015, 36(17): 43-47. DOI:10.7506/spkxl002-6630-201517009.

