利用Briggs-Rauscher振荡体系检测丹皮酚
周 颖,张望宁,张 慧,张兰兰,胡 刚
(安徽大学 化学化工学院,安徽 合肥 230601)
非线性化学动力学[1-4]行为,是指处于非平衡状态下其内部的一些状态量会呈现出周期性变化规律的系统,化学振荡是较为典型的一种,已被报道的振荡体系的种类有很多.就目前而言,研究得较为全面的振荡体系主要是Briggs-Rauscher(BR)反应和Belousov-Zhabotinsky[5-6]反应.早前的实验探究中振荡反应主要以Ce4+或Mn2+等金属离子为催化剂,后期采用大环配合物[7]替代,苹果酸、丙二酸等具有活泼亚甲基的有机物均可以作为有机底物[8].这两种振荡体系主要应用于定量分析方面,比如测定离子、有机试剂,抗氧化性分析等.近年来,BR体系被广泛应用于定量分析有机物,已经报道的抗氧化剂类有抗坏血酸[9]、咖啡酸[10]、维生素类[11-12]等,天然多酚类化合物有橄榄苦苷[13]、松果菊苷[13]等,除此之外还应用于酒类[14]以及大豆提取物[15]等相关检测.通过待检测物对BR体系的微扰作用对物质进行分析检测,该方法具有操作简便、精确度高等优点.
丹皮酚(图示1),又名芍药酮,是从牡丹的根皮中提取出来的一种小分子酚类化合物[16],有天然抗生素之称[17].丹皮酚具有促进微循环、抗癌、降血压、抗炎等多种药理作用[18];丹皮酚能使沉积在皮肤中的色素褪色,用于增白皮肤;丹皮酚还可以作为一种优良的天然添加剂应用于杀虫剂中,因此找到一种简便的测定丹皮酚的方法是有必要的.
检测丹皮酚的方法有分光光度法[19]、高效液相色谱法[20]及其他方法[21].笔者采用一种新的检测方法即利用BR振荡体系来实现对丹皮酚的定量检测,H2SO4- KIO3- [NiL](ClO4)2(图示2)-丙二酸(MA)- H2O2作为检测溶液,其中L为5,7,7,12,14,14-六甲基-1,4,8,11-四氮杂环十四烷-4,11-二烯.将一定浓度的丹皮酚溶液加入BR振荡体系中后,从振荡图谱中观察丹皮酚的加入对体系振荡的影响,并分析加入的丹皮酚的浓度和抑制时间(tin)之间的变化关系,从而建立一种具有操作简单、可靠性强等优势的检测丹皮酚的可行性方法.

图示1 丹皮酚的结构图示2 [NiL](ClO4)2的结构
1 实验部分
1.1 实验试剂与仪器
所用的药品:H2SO4(98%)、丙二酸(MA)、碘酸钾(KIO3)以及过氧化氢(30%)都由阿拉丁生物化学有限公司购入,丹皮酚是从中国国药化工试剂公司购入,所使用的药品均为分析纯,催化剂[NiL]-(ClO4)2(图示2)根据文献[22-23]中提供的方法制得,并对其进行了IR测试和元素分析.
仪器:恒温磁力搅拌器(85-2),上海越众仪器设备有限公司;甘汞电极(217)、铂电极(213),上海雷磁;电子分析天平(FA1054N),沈阳龙腾电子有限公司;放大器(INA-BTA)、GO!LINK,美国威尼尔;超声清洗器(JP3-120),上海超声仪器有限公司;电化学工作站(LK200型),上海伟业仪器有限公司;紫外可见分光光度计(UV-3600),上海谱元仪器有限公司;移液枪(20~200 μL),德国热电公司.
1.2 实验步骤
首先用H2SO4(98%)配制出0.025 mol·L-1的H2SO4溶液,并以0.025 mol·L-1的H2SO4为溶剂配制出0.017 3 mol·L-1[NiL](ClO4)2溶液、0.14 mol·L-1KIO3溶液、2.0 mol·L-1MA溶液、4.0 mol·L-1的H2O2溶液.用蒸馏水配制0.01 mol·L-1丹皮酚溶液.向50 mL的烧杯中加入14.5 mL 0.025 mol·L-1H2SO4、2.0 mL 0.017 3 mol·L-1[NiL](ClO4)2、5.5 mL 0.14 mol·L-1KIO3、3.5 mL 2.0 mol·L-1MA溶液.将铂电极和甘汞电极固定在磁力搅拌器的支架上,然后将电极探头浸入混合溶液中,打开磁力搅拌器,调节转速500 r·min-1,在冰浴条件下对混合溶液进行均质处理,2个电极通过放大器(美国,威尼尔)和GO!LINK与计算机(PC)相连接,打开Logger Lite 数据采集程序,在设置参数栏设置好采样时间,接着移取14.5 mL 4.0 mol·L-1的H2O2溶液到烧杯中,然后点击开始采集按钮,软件会将电势随时间变化的实验数据记录在PC机上,如图1(a)所示.重复以上操作步骤,当振荡图谱出现第6个振荡电势最低位点处时,用移液枪移取40 μL 0.01 mol·L-1丹皮酚溶液,振荡结束后的图谱如图1(b)所示,从图谱中可以看到丹皮酚的加入会使得体系的振荡受到抑制,并在一定的抑制期(tin)后恢复振荡.为了便于后续实验的探究,将振荡停止到振荡恢复的时间定义为抑制期(tin).

(a)无扰动的标准BR振荡图谱; (b)加入1.0×10-5mol·L-1丹皮酚后的扰动振荡图谱. 共同条件:c(H2SO4)=0.025 mol·L-1,c(KIO3) =0.019 25 mol·L-1,c(MA)=0.175 mol·L-1; c([NiL](ClO4)2)=8.65×10-4 mol·L-1,c(H2O2)=1.45 mol·L-1;T=(4±0.5) ℃;R =500 r·min-1.图1 体系振荡图谱
2 结果与讨论
2.1 体系组分的优化
BR振荡体系是由H2SO4,KIO3,MA,H2O2,[NiL](ClO4)2这5种不同组分构成,调节其中任一组分浓度都会改变BR体系的振荡响应,从而影响丹皮酚的检测结果.因此在实验中,采用控制变量法来调控振荡体系中各个组分的浓度,以获得检测丹皮酚的最优组分浓度.
体系中最优H2SO4浓度的探究.在温度(4±0.5)℃、转速500 r·min-1的反应条件下,体系中各组分浓度c([NiL](ClO4)2)=8.65×10-4mol·L-1,c(KIO3)=0.019 25 mol·L-1,c(MA)=0.175 mol·L-1,c(H2SO4)=1.45 mol·L-1保持不变,在H2SO4浓度为0.018 75~0.040 mol·L-1范围内,改变体系中H2SO4的浓度,所得抑制时间(tin)与H2SO4浓度的关系如图2(a)所示.从图中可以看到,在H2SO4浓度区间为0.025~0.030 mol·L-1时,抑制时间不会过长或过短,选用区间中c(H2SO4)=0.025 mol·L-1作为体系中H2SO4的最优浓度.
体系中最优[NiL](ClO4)2浓度的探究.在温度(4±0.5) ℃、转速 500 r·min-1的反应条件下,体系中各组分浓度c(H2SO4)=0.025 mol·L-1,c(KIO3)=0.019 25 mol·L-1,c(MA)=0.175 mol·L-1,c(H2O2)=1.45 mol·L-1保持不变,在[NiL](ClO4)2的浓度为5.19×10-4~1.512×10-3mol·L-1范围内,改变体系中[NiL](ClO4)2的浓度,所得抑制时间(tin)与[NiL](ClO4)2浓度的关系如图2(b)所示.当[NiL](ClO4)2浓度区间为5.19×10-4~8.64×10-4mol·L-1时,抑制时间较长,在浓度区间为8.64×10-4~1.512×10-3mol·L-1时,抑制时间在逐渐缩短,由图2(b)可以观察到当c([NiL](ClO4)2)=8.64×10-4mol·L-1时抑制时间不会过长或过短,选取该浓度作为体系中[NiL](ClO4)2的最优浓度是合适的.
体系中最优KIO3浓度的探究.在温度(4±0.5) ℃;转速=500 r·min-1的反应条件下,体系中各组分浓度c([NiL](ClO4)2)=8.65×10-4mol·L-1;c(H2SO4)=0.025 mol·L-1;c(MA)=0.175 mol·L-1;c(H2O2)=1.45 mol·L-1保持不变,改变体系中KIO3的浓度范围0.014~0.028 mol·L-1,所得抑制时间(tin)与KIO3浓度的关系如图2(c)所示.从图中可以看到,当KIO3浓度区间为0.014~0.019 25 mol·L-1时,tin下降幅度较大;在浓度区间为0.019 25~0.024 5 mol·L-1时,tin平稳下降;在浓度区间为0.024 5~0.028 0 mol·L-1时,tin趋于平稳.最终选取平稳下降区间中的c(KIO3)=0.019 25 mol·L-1时作为实验最优浓度.
体系中最优MA浓度的探究.在温度(4±0.5) ℃;转速=500 r·min-1的反应条件下,体系中各组分浓度c(H2SO4)=0.025 mol·L-1;c(KIO3)=0.019 25 mol·L-1;c([NiL](ClO4)2)=8.65×10-4mol·L-1;c(H2O2)=1.45 mol·L-1保持不变,改变体系中MA的浓度范围0.15~0.25 mol·L-1,所得抑制时间(tin)与MA浓度的关系如图2(d)所示.选取便于实验探究的MA的浓度作为最佳体系浓度,选用c(MA)=0.175 mol·L-1.

(a) c(H2SO4)=0.018 75~0.040 mol·L-1,c(KIO3)=0.019 25 mol·L-1,c(MA)=0.175 mol·L-1,c([NiL](ClO4)2)=8.65×10-4 mol·L-1,c(H2O2)=1.45 mol·L-1;(b) c([NiL](ClO4)2)=5.19×10-4~1.512×10-3 mol·L-1,c(H2SO4)=0.025 mol·L-1,c(KIO3)=0.019 25 mol·L-1,c(MA)=0.175 mol·L-1,c(H2O2)=1.45 mol·L-1;(c) c(KIO3) =0.014~0.028 mol·L-1,c(H2SO4)=0.025 mol·L-1,c(MA)=0.175 mol·L-1,c([NiL](ClO4)2)=8.65×10-4 mol·L-1,c(H2O2)=1.45 mol·L-1;(d) c(MA) =0.15~0.25 mol·L-1,c(H2SO4)=0.025 mol·L-1,c(KIO3)=0.019 25 mol·L-1,c([NiL](ClO4)2)=8.65×10-4 mol·L-1,c(H2O2)=1.45 mol·L-1;(e) c(H2O2)=1.30~1.65 mol·L-1,c(H2SO4)=0.025 mol·L-1,c(KIO3)=0.019 25 mol·L-1,c(MA)=0.175 mol·L-1,c([NiL](ClO4)2)=8.65×10-4 mol·L-1. 共同条件:c(丹皮酚)=1.0×10-5 mol·L-1,T =(4±0.5) ℃,R =500 r·min-1.图2 体系组分浓度对抑制时间(tin)的影响
体系中最优H2O2浓度的探究.在温度(4±0.5) ℃、转速=500 r·min-1的反应条件下,体系中各组分浓度c([NiL](ClO4)2)=8.65×10-4·mol·L-1,c(KIO3)=0.019 25 mol·L-1,c(MA)=0.175 mol·L-1,c(H2SO4)=0.025 mol·L-1保持不变,改变体系中H2O2的浓度范围1.30~1.65 mol·L-1,所得抑制时间(tin)与H2O2浓度的关系如图2(e)所示.从图中可以看到,当H2O2浓度区间为1.40~1.55 mol·L-1时,tin平稳下降,选用区间中c(H2O2)=1.45 mol·L-1时作为H2O2的最优体系浓度.
2.2 丹皮酚的定量分析实验
在上述实验中探究出的最优体系浓度下(c(H2SO4)=0.025 mol·L-1,c(KIO3)=0.019 25 mol·L-1,c(MA)=0.175 mol·L-1,c([NiL](ClO4)2)=8.65×10-4mol·L-1,c(H2O2)=1.45 mol·L-1),进行BR振荡体系对丹皮酚的定量分析实验.实验结果表明,抑制时间(tin)与加入的丹皮酚浓度之间呈一定的线性关系,选用分段函数法来进行探究,结果如图3所示.

(a) 抑制时间(tin)与低浓度区间丹皮酚的线性关系图;(b) 抑制时间(tin)与高浓度区间丹皮酚的线性关系图. 共同条件:c(H2SO4)=0.025 mol·L-1,c(KIO3)=0.019 25 mol·L-1,c(MA)=0.175 mol·L-1,c([NiL](ClO4)2)=8.65 × 10-4 mol·L-1,c(H2O2)=1.45 mol·L-1,T=(4±0.5) ℃,R = 500 r·min-1.图3 抑制时间(tin)与丹皮酚浓度的线性关系图
结果表明,当丹皮酚浓度c(丹皮酚)在5.0×10-6~2.0×10-5mol·L-1区间时,所得的线性关系为:tin=-79.018+3.0×107c(丹皮酚)(R2=0.998 7),如图3(a)所示;当丹皮酚浓度c(丹皮酚)在2.0×10-5~8.75×10-5mol·L-1区间时,所得的线性关系为:tin=-1 072.2+8.0×107c(丹皮酚)(R2=0.998 7),如图3(b)所示.丹皮酚浓度与抑制时间(tin)的工作曲线表明,可以根据二者的响应关系建立出一种定量分析丹皮酚的新方法.
为验证该实验方法的可重复性,笔者将检测浓度为2.0×10-5mol·L-1的丹皮酚加入BR振荡体系中,记录出现抑制时间,并将该实验重复进行10次.最终求得RSD=2.64%,其回收率结果如表1所示.求证得出该检测方法有较好的重复率.

表1 丹皮酚的回收率
2.3 外来离子对定量分析的干扰
在丹皮酚的定量分析过程中,外来离子可能会造成干扰.对此笔者研究了外来离子对该实验的干扰效果,结果如表2所示.其中比率越小说明干扰程度越大.所以在使用该方法进行丹皮酚的定量分析时,要避免比率小的离子的干扰.

表2 外来离子对定量分析的干扰
2.4 反应机理的探究
以下是针对以[NiL](ClO4)2为催化剂的BR振荡体系的12步反应机理,该机理是基于NF模型[24]和FCA模型[25]提出的,反应机理如下
HOI+I-+H+↔I2+H2O,
(1)
HIO2+I-+H+→2HOI,
(2)
(3)
(4)
(5)
2HOO·→H2O2+O2,
(6)
HOI+H2O2→I-+O2+H++H2O,
(7)
IO2·+[NiL]2++H+↔[NiL]3++HIO2,
(8)
H2O2+[NiL]3+→[NiL]2++HOO·+H+,
(9)
(10)
MA↔MA(enol),
(11)
I2+MA(enol)→MAI+I-+H+.
(12)
通过以上的反应机制可以看到,由于反应步骤较多,无法确定丹皮酚参与其中哪一种反应步骤,丹皮酚可能与初始组分溶液发生反应,也可能与反应链中的中间产物发生反应.为了探究丹皮酚与体系中的哪种物质发生了反应,笔者利用循环伏安实验对以下4组溶液进行验证:(1)H2SO4+MA;(2)H2SO4+[NiL](ClO4)2;(3)H2SO4+KIO3;(4)H2SO4+H2O2.分别向这4组溶液中加入不同浓度梯度的丹皮酚溶液,观察加入丹皮酚前后的循环伏安图谱变化,判断是否进行了氧化还原反应.
循环伏安实验结果表明,丹皮酚在实验(3)中,即当酸性KIO3存在时,循环伏安曲线的氧化还原峰会发生位移,如图4所示.证实丹皮酚会与初始组分溶液中的KIO3发生氧化还原反应.
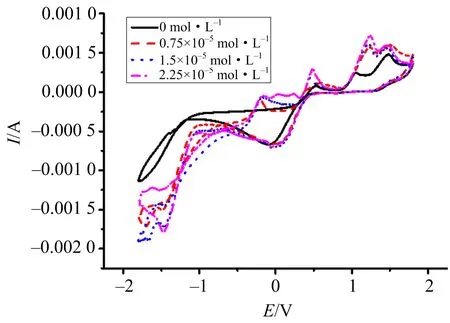
实验条件:c(H2SO4)=0.025 mol·L-1,c(KIO3)=0.019 25 mol·L-1,Scan rate=100 mV·s-1.图4 循环伏安曲线图
尽管在循环伏安实验中表明了丹皮酚可以与KIO3直接发生反应,但是如果考虑是二者之间的直接反应,则丹皮酚会被迅速消耗完,从而无法解释抑制时间的问题,因此说明该扰动行为不是KIO3与丹皮酚直接发生反应产生的.
基于FCA模型的BR振荡体系通常由许多重要的中间体I2、I-、HOI、IO2·和HOO·等组成,前期Cervellati等[26]发表的文献中,都提出并验证了中间体过氧基(HOO·)是引起振荡暂时停止的原因.在酸性介质中,笔者认为丹皮酚被氧化为苯醌类化合物,反应过程如反应(13)所示.将丹皮酚加入BR振荡体系后,其与反应中间体HOO·发生反应,这使得反应(10)中IO2·浓度降低,反应(8)受到了干扰,导致[NiL]3+和[NiL]2+的转化过程出现断裂,体系的振荡受到抑制,从而产生了抑制时间.又因参与到振荡体系中的丹皮酚的浓度是极其微量的,所以加入体系中的丹皮酚会被迅速消耗完,在被消耗完全后振荡体系的反应链将不受抑制,体系恢复振荡.因此在该实验中,同样认为丹皮酚与振荡体系中的中间体HOO·发生了反应,从而解释了出现的抑制时间(tin)问题.

(13)
为证实以上假设,用紫外分光光度计对产物进行实验分析.准备待测溶液:40 μL 0.01 mol·L-1丹皮酚溶液,34.5 mL 0.025 mol·L-1H2SO4溶液,5.5 mL 0.14 mol·L-1KIO3溶液,将以上溶液混合搅拌30 min,以保证待测物丹皮酚被完全氧化,将从该混合物中取1 mL溶液倒入比色皿中,进行UV实验,实验结果如图5所示.

实验条件:c(H2SO4)=0.025 mol·L-1,c(KIO3)=0.019 25 mol·L-1,c(丹皮酚)=1.0× 10-5 mol·L-1 .图5 产物的紫外吸收光谱图
图5的实验结果表明,吸收峰出现在360 nm处,此吸收峰为苯醌类化合物的特征吸收峰,结合丹皮酚的有机结构特征,认为在振荡体系中的氧化产物可能为4-甲氧基-1,2-苯醌.进一步证实了丹皮酚与振荡体系中存在的中间体HOO·发生了反应.
3 结束语
笔者探索出了一种检测丹皮酚的新方法,利用丹皮酚对BR振荡体系的微扰作用对其进行了定量分析.采用控制变量法调节BR体系组成中H2SO4、KIO3、[NiL](ClO4)2、丙二酸、H2O2的浓度,得到检测的最优体系浓度:c(H2SO4)=0.025 mol·L-1;c(KIO3)=0.019 25 mol·L-1;c(MA)=0.175 mol·L-1;c([NiL](ClO4)2)=8.65 × 10-4mol·L-1;c(H2O2)=1.45 mol·L-1.并在最优体系浓度下对丹皮酚进行检测,找出了丹皮酚加入体系中产生的抑制时间(tin)和浓度之间的线性关系,丹皮酚的检测范围为5.0×10-6~8.75×10-5mol·L-1,结果表明:在低浓度区间5.0×10-6~2.0×10-5mol·L-1时,所得的线性关系为tin=-79.018+3.0×107c(丹皮酚)(R2=0.996 1);在高浓度区间2.0×10-5~8.75×10-5mol·L-1时,所得的线性关系为tin=-1 072.2+8.0×107c(丹皮酚)(R2=0.998 7).通过CV和UV实验,证实了体系中的丹皮酚发生了氧化还原反应,丹皮酚被振荡的中间产物HOO·氧化为4-羟基-1,2-苯醌,从而使得实验的扰动机理得到解释.

