宫内发育迟缓对生长猪肠道形态、消化吸收功能及抗氧化能力的影响
陈亚楠, 张玉莹, 张 昊,程 康,李思勉,张莉莉,王 恬
(南京农业大学 动物科技学院,江苏 南京 210095)
宫内发育迟缓(intrauterine growth retardation,IUGR)是指哺乳动物胎儿及其器官在子宫内生长发育受阻的现象,它的发生增加了胎儿围产期发病率和死亡率,是困扰人类医学和动物生产的一大难题[1-2]。研究发现,子宫胎盘功能不全、宫内感染、遗传缺陷、环境应激等因素均可诱导IUGR的发生[3]。流行病学调查表明,IUGR不仅导致胎儿生长发育受阻,还会引发动物出生后期的代谢程序化,大大增加了胰岛素抵抗、II型糖尿病、肥胖症等代谢疾病的发生风险[4-6]。在生产中,猪是最易发生IUGR的多胎家畜[3]。除上述因素外,子宫容积不足和母体营养不良也是导致仔猪发生IUGR的两个主要原因[3]。不仅如此,对高窝产仔数的不断追求与初产母猪的提前配种进一步加剧了IUGR现象的发生,导致IUGR仔猪的自然发生率高达15%~20%[3]。因此,IUGR严重影响了动物生长发育与健康状况,给中国畜牧业生产造成了巨大损失[2]。
肠道不仅是机体营养物质消化、吸收和代谢的主要场所,也是防御外界有害物质(如抗原、毒素、氧化剂和病原体等)入侵的第一道屏障,其健康与否对于仔猪的正常发育具有重要意义。研究发现,IUGR仔猪肠道功能损伤明显,表现为绒毛萎缩、消化吸收能力较差、氧化应激程度偏高、免疫功能受损及代谢失调等[7-9]。然而,目前业内学者多以IUGR新生仔猪或断奶仔猪为研究对象,往往忽略了其在生长阶段的肠道健康状况。尤其是IUGR仔猪在生长育肥期易发生追赶生长,且伴随机体对养分利用效率及物质代谢特点的潜在转变[10]。因而,研究IUGR仔猪在生长阶段的肠道发育水平与消化吸收特点,对深入了解追赶生长的发生机制、完善饲养全程的营养调控策略均具有重要意义。因此,本研究以IUGR生长猪为试验动物,旨在探讨IUGR对其肠道形态、消化吸收功能和抗氧化能力的影响,为随后IUGR生长猪的营养调控提供参考依据。
1 材料与方法
1.1 试验设计与日粮
选择体况相似、胎次和预产期相近的妊娠母猪96头,母猪分娩时,保留窝产仔数为10~13头的杜×长×大新生仔猪30窝,每窝选择1头正常初生重(normal birth weight,NBW)和1头IUGR雄性仔猪。NBW新生仔猪的初生重介于群体平均初生重的0.5个标准差以内,IUGR新生仔猪初生重低于群体平均值2个标准差[11]。仔猪断奶前自由哺乳至21日龄,断奶后分为NBW组和IUGR组,每组6重复,每重复5头仔猪。所有仔猪断奶后饲喂相同的商品日粮至90日龄,日粮配制参考美国NRC(2012)[12],其配方和营养成分见表1。试验期间自由采食、饮水,日常管理、消毒和免疫程序按照猪场常规流程执行。
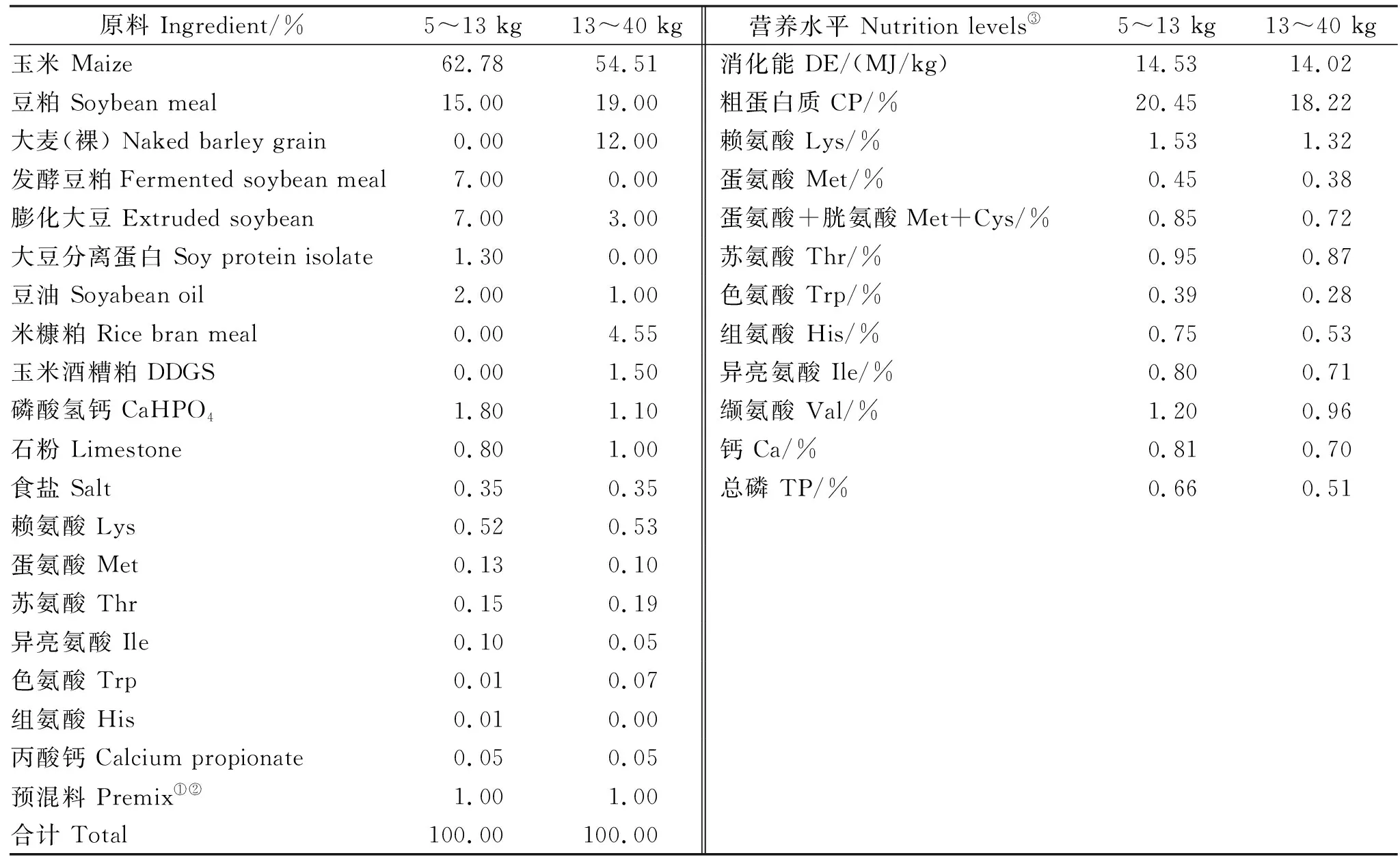
表1 日粮配方和营养水平Table 1 Composition and nutrient levels of the diets
1.2 样品采集
试验结束时,每重复随机选择1头仔猪进行采样。电击致晕,放血致死,迅速剖开腹腔,分离空肠和回肠。分别在每段肠道中间部位截取长度为1.0 cm的肠段,置于4%多聚甲醛溶液,固定后用于制备石蜡切片。采集大约2 g空肠和回肠食糜,置于冻存管中,使用液氮速冻后放于-80 ℃冰箱中保存。另外,使用手术剪剪开肠道,用无菌载玻片轻轻刮取肠道黏膜1.2~1.5 g,装入冻存管中,液氮速冻后转移至-80 ℃冰箱。
1.3 指标测定及方法
1.3.1 肠道组织形态观察 肠道组织在4%多聚甲醛溶液中固定24 h后,经脱水、透明、浸蜡、包埋,采用普通石蜡切片机进行切片,厚度为5 μm。肠道切片经脱蜡和复水后,进行苏木精-伊红染色,所用试剂购自南京建成生物研究所,染色步骤按说明书严格执行。使用Nikon ECLIPSE 80i光学显微镜对组织切片进行观察拍照。每张切片随机选择20个视野,用于测量绒毛高度(villus height,VH)、隐窝深度(crypt depth,CD)、绒毛宽度(villus width,VW),计算绒毛高度/隐窝深度比(villus height: crypt depth ratio,VCR),并按下列公式计算绒毛表面积(villus surface area,VSA):
1.3.2 肠道食糜消化酶测定 使用生理盐水将空肠和回肠食糜制备成20%稀释液,借助高速匀浆机使其充分混匀,随后于4 ℃、3 000 r/min条件下离心10 min,分离上清液用于测定脂肪酶、淀粉酶和胰蛋白酶活力。所用试剂盒均购自南京建成生物工程研究所,测定步骤按照试剂盒说明书进行。
1.3.3 肠道黏膜相关酶测定 取大约0.3 g空肠、回肠黏膜,经4倍体积生理盐水稀释后,使用高速匀浆机进行匀浆。随后于4 ℃、3 000 r/min条件下离心10 min,分离上清液用于测定二糖酶、碱性磷酸酶(alkaline phosphatase,ALP)、Na+/K+-ATP酶、总超氧化物歧化酶(total superoxide dismutase,T-SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)活性,总抗氧化能力(total antioxidant capacity,T-AOC)及丙二醛(malondialdehyde,MDA)含量。上述指标均采用南京建成生物工程研究所试剂盒进行测定,测定步骤严格按照说明书进行。
1.3.4 肠道黏膜基因转录表达检测 取空肠、回肠黏膜大约80 mg,使用Trizol试剂提取组织总RNA。样品经浓度、纯度及完整性检测合格后,采用大连宝生物Prime-ScriptTM试剂盒进行反转录,单链DNA(complementary deoxyribonucleic acid,cDNA)置于-20 ℃冰箱中保存。采用qRT-PCR技术检测肠道基因钠/葡萄糖共转运载体1(sodium/glucose cotransporter 1,SGLT1)、葡萄糖转运体2(glucose transporter 2,GLUT2)、脂肪酸结合蛋白3(fatty acid binding protein 3,FABP3)、小肠脂肪酸结合蛋白(intestinal fatty acid binding protein,I-FABP)、小肽转运体1(peptide transporter 1,PEPT1)、阳离子氨基酸运载体1(cationic amino acid transporter 1,CAT1)、超氧化物歧化酶1(superoxide dismutase 1,SOD1)、超氧化物歧化酶2(superoxide dismutase 2,SOD2)、谷胱甘肽过氧化物酶1(glutathione peroxidase 1,GPX1)和肌动蛋白(β-actin)的mRNA表达丰度。使用NCBI Primer-BLAST在线软件设计特异性上、下游引物,经GenBank Blast进行同源性检索合格后,由生工生物工程(上海)股份有限公司合成。引物序列及参数见表2。使用大连宝生物SYBR Premix Ex Taq试剂盒进行qRT-PCR反应,反应程序如下:在95 ℃下预变性30 s,在95 ℃下变性5 s,在60 ℃下退火30 s,共40个循环。溶解曲线分析条件按系统推荐设置。以β-actin作为内参,采用2-ΔΔCT方法对目的基因相对表达量进行计算。

表2 qRT-PCR所用引物信息Table 2 Information regarding the primers used in qRT-PCR
1.4 数据统计与处理
试验数据采用SPSS 22.0中独立样本t检验进行显著性分析,以P<0.05作为差异显著的标准。结果以平均值±标准误的形式表示。
2 结果与分析
2.1 IUGR对90日龄生长猪肠道形态的影响
由表3可见,与NBW组相比,IUGR组空肠VSA和回肠VH显著降低(P<0.05),空肠VH和回肠VSA均有降低趋势。两组之间空肠、回肠VW、CD和VCR均无显著差异(P>0.05)。

表3 IUGR对90日龄生长猪肠道形态的影响Table 3 Effect of IUGR on intestinal morphology of growing pigs at 90 days of age
2.2 IUGR对90日龄生长猪肠道食糜消化酶活性的影响
由表4可见,与NBW组相比,IUGR导致90日龄生长猪空肠食糜脂肪酶活性显著降低(P<0.05)。同时,IUGR组回肠食糜脂肪酶活性较NBW组有下降趋势。此外,IUGR对生长猪空肠和回肠食糜淀粉酶、胰蛋白酶活性均无明显影响(P>0.05)。

表4 IUGR对90日龄生长猪肠道食糜消化酶的影响Table 4 Effect of IUGR on digestive enzyme activities in the intestinal contents of growing pigs at 90 days of age
2.3 IUGR对90日龄生长猪肠道黏膜二糖酶和代谢酶活性的影响
由表5可见,IUGR生长猪在90日龄时空肠黏膜麦芽糖酶、回肠黏膜蔗糖酶、ALP和Na+/K+-ATP酶活性均较NBW生长猪显著降低(P<0.05),空肠黏膜Na+/K+-ATP酶活性较NBW生长猪有下降的趋势。而空肠黏膜蔗糖酶、乳糖酶和ALP,回肠黏膜麦芽糖酶和乳糖酶活性在两组之间均没有显著差异(P>0.05)。

表5 IUGR对90日龄生长猪黏膜消化吸收功能的影响Table 5 Effect of IUGR on digestive and absorptive function in mucosa of growing pigs at 90 days of age
2.4 IUGR对90日龄生长猪肠道氧化还原状态的影响
与NBW组相比,IUGR导致生长猪90日龄时空肠、回肠黏膜T-SOD活性显著下降,空肠黏膜MDA含量显著升高(P<0.05)。两组之间空肠、回肠黏膜T-AOC和GPX活性及回肠黏膜MDA含量没有显著差异(P>0.05)。

表6 IUGR对90日龄生长猪肠道氧化还原状态的影响Table 6 Effect of IUGR on redox status of intestine of growing pigs at 90 days of age
2.5 IUGR对90日龄生长猪肠道功能相关基因转录表达的影响
由表7可见,IUGR显著降低了90日龄生长猪空肠和回肠黏膜SGLT1、SOD2以及空肠黏膜SOD1 mRNA的相对表达量(P<0.05),且有抑制空肠黏膜GLUT2和I-FABP转录的趋势。此外,与NBW组相比,IUGR对90日龄生长猪空肠黏膜FABP3、PEPT1、CAT1、GPX1以及回肠黏膜GLUT2、FABP3、I-FABP、PEPT1、CAT1、SOD1、GPX1的转录水平均无明显改变(P>0.05)。

表7 IUGR对90日龄生长猪肠道功能相关基因转录表达的影响Table 7 Effect of IUGR on expression levels of genes related to intestinal function of growing pigs at 90 days of age
3 讨 论
3.1 IUGR对生长猪肠道形态的影响
肠道是营养物质消化、吸收和代谢的重要器官,其形态和功能的完整性对营养物质的利用至关重要。一般认为,肠黏膜VH增加、VSA增大可使小肠上的转运载体与营养物质的接触面积增大,从而有利于营养物质的吸收[13]。Dong等[14]研究发现,IUGR导致哺乳仔猪小肠绒毛受损明显,呈现锯齿状且高度变短。Li等[15]研究结果也证实,IUGR断奶仔猪空肠和回肠VH和VCR降低。这些研究均表明,IUGR可对仔猪出生后早期阶段的肠道形态造成损伤。在本试验中,IUGR显著降低了90日龄生长猪的空肠VSA和回肠VH,提示IUGR损伤仔猪肠道形态的现象至少会持续至生长阶段。尽管此时IUGR猪肠道损伤程度与其新生或断奶阶段相比已得到一定改善,但鉴于肠道在养分利用及机体代谢中的重要作用,上述损伤对IUGR生长猪发育水平和健康状况仍具有不可忽视的负面影响[16]。
3.2 IUGR对生长猪消化吸收功能的影响
脂肪、糖类和蛋白质是机体的三大营养物质,它们进入小肠后,在一系列消化酶作用下被分解为氨基酸、小肽、单糖和脂肪酸,这些小分子营养物质可通过相应的转运载体或以其他形式进入细胞以供机体利用[17]。因此,肠道消化酶活性和营养物质转运载体的数量影响着营养物质的利用效率。有研究报道,IUGR限制了仔猪胃肠道生长发育,降低了内源消化酶的活性[18]。本试验中,IUGR显著降低了90日龄生长猪空肠食糜脂肪酶活性,并使回肠食糜脂肪酶活性和空肠黏膜I-FABPmRNA表达量呈下降趋势,这或与IUGR损伤生长猪肠道代谢状态的现象有关[19]。I-FABP是肠道脂肪酸结合蛋白,可催化肠道游离脂肪酸进入细胞,从而参与脂肪酸的转运。本试验结果提示,在90日龄时IUGR生长猪肠道仍存在脂肪消化不良及转运吸收功能受损的现象。
本研究发现,IUGR显著降低了空肠和回肠SGLT1 mRNA表达水平,且有抑制空肠黏膜GLUT2转录表达的趋势。SGLT1和GLUT2是肠黏膜中重要的糖类转运载体,多糖经消化酶分解后转变成单糖,单糖可在肠道黏膜刷状缘与SGLT1结合,从而被转运至上皮细胞。另外,胞中的单糖也可同位于肠上皮基底中的GLUT2结合,经易化扩散进入血液,供机体利用[20]。SGLT1生理功能的正常发挥需由Na+/K+-ATP酶提供能量。本研究发现,IUGR抑制了生长猪空肠、回肠黏膜Na+/K+-ATP酶活性,这与黄强等[21]的研究结果基本一致。其研究发现,在断奶后早期阶段IUGR仔猪空肠黏膜Na+/K+-ATP酶活性显著低于NBW仔猪,SGLT1 mRNA表达水平亦有下调趋势[21]。因而,本试验结果表明,在90日龄时IUGR生长猪肠道功能损伤依然明显,对糖转运能力不足的问题仍存在[22]。
二糖酶是反映肠道消化吸收能力的标志性酶,是衡量肠道功能发育成熟的有力指标[23]。诸多研究表明,IUGR改变了肠道二糖酶的发育模式。周根来等[24]研究发现,IUGR会阻碍新生仔猪小肠乳糖酶的成熟。Su等[25]的试验结果也表明,IUGR会显著降低断奶仔猪空肠黏膜麦芽糖酶和回肠黏膜蔗糖酶活性。在本试验条件下,IUGR猪在90日龄时其空肠黏膜麦芽糖酶和回肠黏膜蔗糖酶活性依然显著低于NBW猪,提示此时IUGR猪的肠道发育依然滞后于NBW猪。同时,本研究发现,IUGR生长猪在90日龄时回肠ALP活性显著下降。这与前人的研究结果相似,黄强等[21]和王远孝[16]研究表明,IUGR显著降低了35和66日龄仔猪空肠黏膜ALP活性。ALP不仅是营养物质消化和吸收的关键酶,同时也是一种内源性解毒因子,可抵抗肠道内致病菌分泌脂多糖,从而保护肠道健康[26]。上述结果表明,IUGR阻碍仔猪肠道发育的现象可持续至生长期。因此,如何改善IUGR猪肠道的发育滞后是当前生猪养殖所面临的一项迫切的现实问题。
3.3 IUGR对生长猪肠道氧化还原状态的影响
健康状态下,机体中的氧化和抗氧化系统处于某种动态平衡状态。当机体产生的氧化产物超出其本身的清除能力时,容易发生氧化应激。氧化应激会破坏细胞及细胞器的结构和功能,导致DNA损伤和脂质过氧化,继而引起细胞死亡、组织损伤乃至某些疾病的发生[27-28]。本试验中,IUGR导致90日龄生长猪空肠黏膜MDA含量明显升高。MDA是脂质过氧化的主要产物之一,可反映机体氧化应激和细胞损伤的程度[29]。因而,本研究结果表明,IUGR猪在生长阶段肠道依然存在氧化应激程度偏高的现象,这可能与肠道黏膜T-SOD活性及SOD1、SOD2转录表达受到抑制有关。SOD是动物体内抗氧化系统中重要的抗氧化酶,可抵抗自由基损伤,维持细胞正常的结构和功能。与此相似,Huang等[30]研究表明,在断奶后早期阶段IUGR会降低仔猪空肠黏膜T-SOD活性和T-AOC。Su等[25]也发现,IUGR导致断奶仔猪空肠和回肠黏膜MDA含量显著升高,而还原型/氧化型谷胱甘肽比例明显下降。基于上述研究,我们推测合理使用抗氧化剂对于改善IUGR猪出生后早期及生长期的肠道氧化应激或具有积极作用,但其效果仍有待进一步研究证实。
4 结 论
本试验结果表明,IUGR导致生长猪肠道形态受损,肠道消化和代谢酶活性降低,营养物质转运载体表达减少,并造成空肠黏膜脂质过氧化水平升高,提示IUGR对仔猪肠道发育的不良影响至少会持续至其90日龄。上述结果可为酶制剂、抗氧化剂等营养素在IUGR生长猪上的应用提供参考依据。

