干扰素对ET和PV的JAK2V617F基因突变负荷和IL-8的表达的影响
黄继贤 潘成云 廖建军 谢治军 肖捷 肖健

【摘要】 目的 探討干扰素治疗原发性血小板增多症(ET)和真性红细胞增多症(PV)患者的效果及对JAK2V617F基因突变负荷和白细胞介素-8(IL-8)表达的影响。方法 30例JAK2V617F基因突变阳性ET患者(19例)和PV患者(11例), 采用干扰素α-2b治疗。观察治疗6个月后的临床指标, 比较治疗前后JAK2V617F基因突变负荷和IL-8的表达水平变化情况, 统计治疗后血液学疗效。结果 干扰素治疗6个月后, ET+PV患者的血液学总缓解率达86.67%, 其中完全血液学缓解(CHR)和部分血液学缓解(PHR)分别为70.00%和16.67%。ET和PV患者的血液学总缓解率、CHR、PHR分别为100.00%和63.64%、78.95%和54.55%、21.05%和9.09%。ET+PV、ET、PV患者干扰素治疗6个月后JAK2V617F基因突变负荷分别为(28.25±12.99)、(25.84±10.72)、(32.42±15.87)%, 均低于治疗前的(44.50±23.90)、(34.48±15.02)、(67.00±19.26)%, 差异均有统计学意义(P<0.05)。ET+PV、ET、PV患者干扰素治疗6个月后IL-8表达水平与治疗前比较, 差异均无统计学意义(P>0.05)。结论 干扰素治疗ET和PV患者6个月, 能明显降低JAK2V617F基因突变负荷, 使大部分患者达到血液学缓解, 但并未能明显降低IL-8水平。
【关键词】 干扰素;原发性血小板增多症;真性红细胞增多症;JAK2V617F基因突变;白细胞介素-8
DOI:10.14163/j.cnki.11-5547/r.2020.24.001
【Abstract】 Objective To discuss the effect of interferon on essential thrombocythemia (ET) and polycythemia vera (PV) as well as its effect on the JAK2V617F gene mutation load and expression of interleukin 8 (IL-8). Methods 30 patients with JAK2V617F gene mutation positive ET (19 cases) and PV (11 cases) were treated with interferon α-2b. The clinical indicators of 6 months after treatment were observed. JAK2V617F gene mutation load and IL-8 expression level changes before and after treatment was compared, and the hematological efficacy was analyzed. Results After 6 months of interferon treatment, the total hematological remission rate of ET + PV patients was 86.67%, in which complete hematological remission (CHR) and partial hematological remission (PHR) were 70.00% and 16.67% respectively. The total remission rate, CHR and PHR of ET and PV patients were 100.00% and 63.64%, 78.95% and 54.55%, 21.05% and 9.09% respectively. After 6 months of interferon treatment, JAK2V617F gene mutation load of ET+PV, ET and PV patients were (28.25±12.99), (25.84±10.72) and (32.42 ± 15.87)% respectively, which was lower than that before treatment (44.50±23.90), (34.48±15.02) and (67.00±19.26%), and the difference was statistically significant (P<0.05). After 6 months of interferon treatment, IL-8 level of ET+PV, ET and PV patients had no statistically significant difference compared with that before treatment (P>0.05). Conclusion 6 months of interferon treatment in ET and PV patients can significantly reduce the JAK2 V617F gene mutation load to hematologic response in most patients; however, it does not significantly reduce the level of IL-8.
【Key words】 Interferon; Essential thrombocythemia; Polycythemia vera; JAK2V617F gene mutation; Interleukin-8
Ph染色体阴性的骨髓增殖性肿瘤(myeloproliferative neoplasms, MPN)也常被称为经典型MPN, 以驱动基因激活JAK/STAT通路导致骨髓细胞持续克隆增殖, 且伴有多种细胞因子异常为特征的一组异质性造血干细胞疾病[1, 2], 包括原发性ET、PV和原发性骨髓纤维化(PMF)。虽然羟基脲和干扰素作为治疗MPN的常用药物在临床工作中已使用多年, 且迄今为止没有令人信服的证据证明羟基脲致白血病作用[3], 但是一项中位随访达16.3年的随机研究显示[4], 羟基脲治疗患者20年累计白血病发生率达22%。干扰素虽然需要反复皮下注射, 不如口服羟基脲方便使用, 但仍然有不少患者因其未致白血病效应而选用。为探讨MPN患者干扰素治疗前后IL-8和驱动基因负荷的变化情况, 本文总结和分析了近4年以来本院使用干扰素治疗MPN的情况, 现报告如下。
1 资料与方法
1. 1 一般资料 选取2016年10月~2019年8月就诊于本院接受干扰素治疗的30例JAK2V617F基因突变阳性的ET患者(19例)和PV患者(11例)。诊断均符合2016年WHO公布的MPN诊断标准[5]。
1. 2 方法 对所有患者进行干扰素治疗, 方法为:干扰素α-2b皮下注射, 每隔1日1次, 300 μg/次, 达到CHR后, 在维持治疗过程中如能持续缓解, 则干扰素则减量为1~2次/周, 300 μg/次。ET患者早期治疗均加用羟基脲0.5~1.0 g/d, 待达到CHR后逐渐减量和停用。而PV患者, 治疗过程中使用血细胞分离机祛除红细胞, 使红细胞压积(HCT)低于45%(男性)或42%(女性)。整个治疗过程中, 所有ET和PV患者如果无阿司匹林禁忌证, 则同时口服阿司匹林肠溶片, 100 mg/d。治疗6个月。
1. 3 观察指标及判定标准
1. 3. 1 观察患者临床特征 包括性别、年龄、白细胞、血红蛋白、血小板、脾大、JAK2V617F基因突变负荷。
1. 3. 2 检测JAK2V617F基因突变负荷[6] 留取标本检测的时间点为初诊时、干扰素治疗后6个月。方法如下:留取外周血或骨髓标本提取DNA后, 通过聚合酶链反应(PCR)采用TaqMan探针法检测JAK2野生型基因和JAK2V617F基因突变的表达水平。JAK2V617F基因突变负荷的计算方法为:JAK2V617F基因突变负荷=JAK2V617F突变拷贝数/(JAK2V617F突变拷贝数+JAK2V617F野生型拷贝数)。
1. 3. 3 酶联免疫吸附实验(ELISA)检测IL-8 留取标本检测的时间点为初诊时、干扰素治疗后6个月。方法如下[7]:留取患者外周血血清标本后, 酶标板设置待测样品孔、标准品孔和空白显色孔, 先后加IL-8抗体、亲和素-过氧化物酶复合物、显色液和终止液反应, 酶标仪测定各孔光密度(OD)值, 与标准品稀释后测定的标准曲线比对, 计算每孔IL-8的浓度。
1. 3. 4 比较干扰素治疗后血液学疗效 疗效判定标准:①PV的疗效判定标准[8]:CHR的定义为在无放血治疗的情况下男性HCT<45%, 女性HCT<42%;不伴脾大, 白细胞(WBC)<10×109/L, 血小板(PLT)<400×109/L。PHR的定义为男性HCT<45%, 女性HCT<42%;伴脾大, 或 PLT>400×109/L, 或放血频率减少50%以上。②ET的疗效判定标准[9]:CHR的定义为在未合用羟基脲和阿那格雷治疗的情况下, PLT≤400×109/L且无血栓和出血事件。PHR的定义为 PLT下降50%以上, 但仍>400×109/L, 且无血栓和出血事件。
1. 3. 5 观察干扰素治疗后不良事件发生情况。
1. 4 统计学方法 采用SPSS20.0统计学软件处理数据。计量资料以均数±标准差( x-±s)表示, 采用t检验;计数资料以率(%)表示, 采用χ2檢验;不服从正态分布的计量资料以[M(P25, P75)]表示, 采用秩和检验;P<0.05表示差异有统计学意义。使用GraphPad Prism 7.0绘制柱状图。
2 结果
2. 1 30例患者临床特征 30例JAK2V617F基因突变阳性的ET和PV患者接受干扰素α-2b治疗6个月以上, 男性12例, 女性18例。其中ET患者19例(男9例, 女10例), PV患者11例(男3例, 女8例)。见表1。
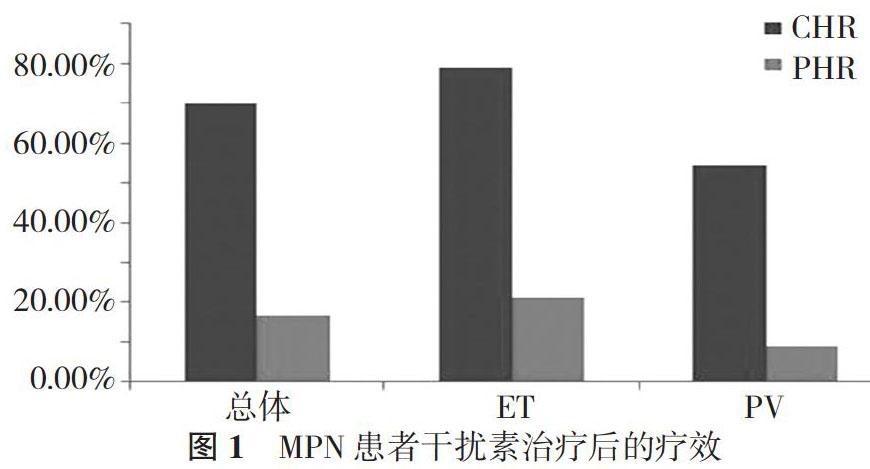
2. 2 治疗6个月后血液学疗效比较 干扰素治疗6个月后, ET+PV患者的血液学总缓解率为86.67%(26/30), 其中70.00%(21/30)达CHR, 16.67%(5/30)达PHR。ET患者的血液学总缓解率为100.00%(19/19), 其中78.95%(15/19)达CHR, 21.05%(4/19)达PHR;而PV患者的血液学总缓解率为63.64%(7/11), 其中54.55%(6/11)达CHR, 9.09%(1/11)达PHR。见图1。
2. 3 治疗前后JAK2V617F基因突变负荷变化比较
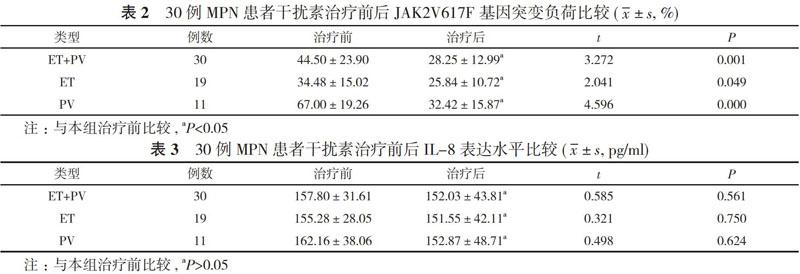
ET+PV、ET、PV患者干扰素治疗6个月后JAK2V617F基因突变负荷分别为(28.25±12.99)%、(25.84±10.72)%、(32.42±15.87)%, 均低于治疗前的(44.50±23.90)%、(34.48±15.02)%、(67.00±19.26%), 差异均有统计学意义(P<0.05)。见表2。
2. 4 治疗前后IL-8的表达水平比较 ET+PV、ET、PV患者干扰素治疗6个月后IL-8表达水平与治疗前比较, 差异均无统计学意义(P>0.05)。见表3。
2. 5 干扰素治疗后不良事件发生情况 本研究接受干扰素治疗的患者, 出现的不良事件均为1~2级, 无3~4级不良事件。首次使用干扰素后出现22例以畏寒、发热、骨痛为主要临床表现的流感样症状, 均出现于治疗早期;第2~4次后症状明显减轻和消失。此外, 3例出现脱发, 1例出现食欲减退。
3 讨论
驱动基因突变和细胞因子异常与Ph染色体阴性MPN的发病机制有关。表型驱动基因突变致使细胞信号通路(JAK-STAT)的激活, 继而导致骨髓造血干细胞的过度增殖, 是MPN发病机制的关键[10, 11]。此外, 有研究发现, MPN患者中IL-8、血管内皮生长因子(VEGF)、肝细胞生长因子(HGF)等众多细胞因子表达水平较健康人群存在明显差异[12], 与发病机制有关, 且可能是潜在的治疗靶点[13]。因此, 减少和消除驱动基因突变负荷和异常细胞因子成为探讨治疗MPN的重要研究方向。
MPN的表型驱动基因包括JAK2、CALR、MPL。JAK2基因突变中以JAK2V617F基因突变最常见。且JAK2V617F突变也是MPN中最常见的驱动基因突变, 其在PV、ET和PMF中的检出率分别为95%、50%~75%和40%~75%[11]。通过治疗减少MPN驱动基因突变负荷, 是目前一种有效且可行的方法。MPN的驱动基因与疾病的临床表型和预后有关[14]。有研究认为, 较重的JAK2V617F基因突变的肿瘤负荷可能与MPN进展为MF有关[14, 15]。长效干扰素可降低JAK2V617F和CALR基因突变的基因负荷[16, 17], 并达到持续的CHR[3, 18]。
国内外研究显示, 长效干扰素治疗MPN的疗效确切, 但结果差异较大。Masarova等[19]对40例ET(19例JAK2V617F基因突变阳性)和43例PV(41例为JAK2V617F基因突变阳性)患者使用长效干扰素(PEG-IFN-α-2a)治疗, 中位随访83个月, 血液学总缓解率为80%, 中位血液学缓解时间为66个月。该研究中有63%的患者在长效干扰素治疗后JAK2V617F基因突变负荷下降, 均表现为开始治疗后迅速下降, ET和PV患者分别在治疗后1年和2年达到平台期。患者能否达到血液学缓解和达到缓解时间与年龄、性别、基线临床特征、脾肿大、驱动基因类型及JAK2V617F基因突变负荷无关。Kiladjian等[8]对37例PV(29例JAK2V617F基因突变阳性)患者使用长效干扰素(PEG-IFN-α-2a)治疗12个月后全部达到血液学缓解, 其中35例(94.6%)为CHR, 2例(5.4%)为PHR。庞缨等[20]对73例MPN患者(ET 46例, PV27例)使用干扰素α治疗, 治疗12个月后ET和PV患者的血液学总缓解率分别为65.1%和85.1%, CHR分别为25.9%和59.3%, PHR分别为39.1%和26.1%。该研究未进行JAK2V617F基因突变负荷检测, 但定性检查发现, 干扰素α治疗1~3年的患者, ET和患者JAK2V617F基因突变的转阴率分别为41%和56%。本研究发现, ET+PV、ET和PV患者使用干扰素治疗6个月后, 血液学总缓解率分别为86.67%、100%和63.64%, 其中CHR分别为70.00%、78.95%和54.55%, PHR分别为16.67%、21.05%和9.09%, 且发现ET和PV患者的JAK2V617F基因突变负荷较治疗前明显下降, 差异有统计学意义(P<0.05)。
能否减少和消除MPN患者的异常细胞因子, 一直是学界探讨的话题之一。Tefferi等[21]对127例PMF患者的外周血检测后发现, IL-8、白介素介素-6(IL-6)、INF-α等19种细胞因子明显高于正常人, 升高的IL-8与体质症状和生存时间缩短相关, 并可预测无白血病进展的生存率。Vaidya等[22]对 65例PV患者检测外周血后发现IL-8、IL-6、IFN-γ等16种细胞因子较正常人异常升高。本文前期研究[7]对123例MPN患者(ET 63例、PV 28例、PMF 33例)检测外周血后也发现IL-8明显较正常人明显升高。PMF的發病假说[23]认为, 大量异常因子存在的炎性环境, 促使正常细胞转化为恶性细胞并克隆增殖, 继而导致MPN的发生和进展。因此, 改善MPN患者在异常的炎性环境日益受到血液学界的重视。芦可替尼能降低JAK2V617F基因突变负荷和肿瘤坏死因子-α(TNF-α)、IL-6等细胞因子的发现[24], 使作者猜想干扰素是否能有类似的作用。在本研究中, 虽然ET+PV患者经干扰素治疗6个月后, IL-8表达水平低于治疗前, 但差异无统计学意义(P>0.05), 仍未能提示干扰素能明显减低IL-8的表达。IL-8与干扰素治疗时间相对较短, 还是IL-8与干扰素治疗无相关性, 仍需进一步研究探讨。
综上所述, 干扰素治疗ET和PV患者6个月, 能明显降低JAK2V617F基因突变负荷, 使大部分患者达到血液学缓解, 但并未能明显降低IL-8水平。
参考文献
[1] Odenike O. How I treat the blast phase of Philadelphia chromosome-negative myeloproliferative neoplasms. Blood, 2018, 132(22):2339-2350.
[2] Lussana F, Rambaldi A. Inflammation and myeloproliferative neoplasms. J Autoimmun, 2017(85):58-63.
[3] Kiladjian JJ. Long-term treatment with interferon alfa for myeloproliferative neoplasms. Lancet Haematol, 2017, 4(4):e150-e151.
[4] Kiladjian J J, Chevret S, Dosquet C, et al. Treatment of polycythemia vera with hydroxyurea and pipobroman: final results of a randomized trial initiated in 1980. Journal of Clinical Oncology, 2011, 29(29):3907-3913.
[5] Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood, 2016, 127(20):2391-2405.
[6] 孫聪聪. 骨髓增殖性肿瘤中JAK2V617F突变及Il-6、TNF-α、Il-32、Il-37的定量测定及相关性研究. 山东大学, 2015.
[7] 黄继贤. MPNs分子遗传学与免疫特征及芦可替尼改善骨纤机制的探讨. 南方医科大学, 2019.
[8] Kiladjian JJ, Cassinat B, Chevret S, et al. Pegylated interferon-alfa-2a induces complete hematologic and molecular responses with low toxicity in polycythemia vera. Blood, 2008, 112(8):3065-3072.
[9] Quintas-Cardama A, Kantarjian H, Manshouri T, et al. Pegylated interferon alfa-2a yields high rates of hematologic and molecular response in patients with advanced essential thrombocythemia and polycythemia vera. Journal of clinical oncology : official journal of the American Society of Clinical Oncology, 2009, 27(32):5418-5424.
[10] Marneth AE, Mullally A. The Molecular Genetics of Myeloproliferative Neoplasms. Cold Spring Harbor Perspectlves in Medicine, 2020, 10(2):34876.
[11] Ferreira CS, Polo B, Lacerda JF. Somatic Mutations in Philadelphia Chromosome-Negative Myeloproliferative Neoplasms. Semin in Hematology, 2018, 55(4):215-222.
[12] Mondet J, Hussein K, Mossuz P. Circulating Cytokine Levels as Markers of Inflammation in Philadelphia Negative Myeloproliferative Neoplasms: Diagnostic and Prognostic Interest. Mediators of Inflammation, 2015(1):1-10.
[13] Luque LFM, Blackmon AL, Ramanathan G, et al. Key Role of Inflammation in Myeloproliferative Neoplasms: Instigator of Disease Initiation, Progression. and Symptoms. Curr Hematol Malig Rep, 2019, 14(3):145-153.
[14] Grinfeld J, Nangalia J, Baxter EJ, et al. Classification and Personalized Prognosis in Myeloproliferative Neoplasms. New England Journal of Medicine, 2018, 379(15):1416-1430.
[15] Passamonti F, Rumi E, Pietra D, et al. A prospective study of 338 patients with polycythemia vera: the impact of JAK2 (V617F) allele burden and leukocytosis on fibrotic or leukemic disease transformation and vascular complications. Leukemia, 2010, 24(9):1574-1579.
[16] Verger E, Cassinat B, Chauveau A, et al. Clinical and molecular response to interferon-α therapy in essential thrombocythemia patients with CALR mutations. Blood, 2015, 126(24):2585-2591.
[17] Tashi T, Swierczek S, Kim SJ, et al. Pegylated interferon Alfa-2a and hydroxyurea in polycythemia vera and essential thrombocythemia: differential cellular and molecular responses. Leukemia: Official journal of the Leukemia Society of America, Leukemia Research Fund, U. K, 2018, 32(8):1830-1833.
[18] Desterro J, Mclornan DP, Curto GN, et al. Essential thrombocythaemia treated with recombinant interferon: 'real world' United Kingdom referral centre experience. British Journal of Haematology, 2019, 186(4):561-564.
[19] Masarova L, Patel KP, Newberry KJ, et al. Pegylated interferon alfa-2a in patients with essential thrombocythaemia or polycythaemia vera: a post-hoc, median 83 month follow-up of an open-label, phase 2 trial. Lancet Haematol, 2017, 4(4):e165-e175.
[20] 龐缨, 蔡晓东, 刘凌, 等. 干扰素-α对骨髓增殖性肿瘤JAK2V617F基因表达的影响. 中山大学学报(医学科学版), 2011, 32(3):316-320.
[21] Tefferi A, Vaidya R, Caramazza D, et al. Circulating interleukin (IL)-8, IL-2R, IL-12, and IL-15 levels are independently prognostic in primary myelofibrosis: a comprehensive cytokine profiling study. Journal of Clinical Oncology, 2011, 29(10):1356-1363.
[22] Vaidya R, Gangat N, Jimma T, et al. Plasma cytokines in polycythemia vera: phenotypic correlates, prognostic relevance, and comparison with myelofibrosis. American Journal of Hematology, 2012, 87(11):1003-1005.
[23] Desterke C, Martinaud C, Ruzehaji N, et al. Inflammation as a Keystone of Bone Marrow Stroma Alterations in Primary Myelofibrosis. Mediators of Inflammation, 2015(2):1-6.
[24] Verstovsek S, Mesa RA, Gotlib J, et al. A double-blind, placebo-controlled trial of ruxolitinib for myelofibrosis. N Engl J Med, 2012, 366(9):799-807.
[收稿日期:2020-05-22]

