文件管理系统DMS在集团化医药企业的规划和应用
过明祺 邵扬
摘 要 医药工业企业的GMP文件普遍是以纸质形式保存,随着历史版本的文件越来越多,人工管理出现很多问题从而带来合规性风险。本文阐述了从集团层面,如何推动下属医药企业共同参与,集中部署一套经过计算机化系统验证的文件管理系统,以及集中部署的优势及意义。
关键词 文件管理系统;集中部署;计算机化系统验证;集团型医药企业
引言
(1)制药企业文件管理水平参差不齐:上海医药的集团化工业体系由三个层级、30个生产企业、50个生产基地组成。每个药品生产企业与GMP相关的文件包括:生产工艺、质量标准、管理类文件、操作类文件、各类记录等,单个企业与质量相关文件超过3000个。原先采用纸质及人工管理出现很多问题,海量文件存储占用空间,造成文件管理困难、版本混乱、易出错、易遗失、查找缓慢、效率低下、无法协作共享、审批过程不受控、安全性缺乏保障等一系列弊端,难以满足GMP合规和管理的要求。有部分生产企业已尝试使用一些信息化软件来支持相关的药品生产和质量管理,但集团发现各个企业的成效并不相同,有的子公司对质量管理理解程度比较高,做得就相对比较全面,在接受监管检查的时候,这样的子公司能够对答如流,满足监管的相关要求。但有的企业相对来说水平会差一些,就不能完全符合监管要求。如果能统一用一套符合行业高标准的系统来管理,就能确保相应子公司能够高水平、高质量地应对监管的检查。
(2)集团发展的战略要求:随着近几年集团业务发展及信息化整体建设快速推进,集团已在决策层、管控层、属地层同步推进信息化建设。目前,智能工厂的推进已成为集团战略,信息化是支撑智能工厂的五大支柱之一,而文件管理系统(DMS)是工业板块信息化架构中不可或缺的组成部分,更是维持良好GMP体系的核心系统之一。集团希望能够以此次质量文件管理系统的实施项目为契机,在质量管理工作的管控模式上形成一定的转变,逐步打造一个合规、高效的管理体系。
我们对文件管理系统提出了如下需求:①建立管理GMP文件标准:审批流程标准化、文件格式标准化、文件编码标准化;②实现集团总部对下属企业文件进行查看和管控;③统分结合,在标准化统一的前提下,满足各企业的个性化受控使用文件的需求;④满足计算机化系统验证(CSV)要求,保证文件管理系统的安全性。
1集中部署的优势和难点
经过慎重的比较分析,我们选择了集团集中部署的方案进行推进。
1.1 集中部署的优势
①采用集中部署,各子公司不用单独进行本地文件系统建设,大大节约软件购买和服务器资源费用。②集团及各子公司统一使用一套系统对质量相关文件进行管理,文件可根据管控需要实现共享。③集团部署并同步做计算机化系统验证(CSV),总部承担了大部分验证工作,且验证文件可以重复利用,大大节约各子公司单独做验证的时间和成本。
1.2 DMS功能与架构
根据GMP对文件管理的要求,DMS系统具备对一类、二类、三类文件全生命周期管理的功能。
1.3 面临的主要挑战与解决策略
为了完成最终覆盖所有生产基地的总目标,我们采用“总体规划,试点先行,积累经验,全面覆盖”的推进策略。项目一期范围:集团总部及5家试点企业。
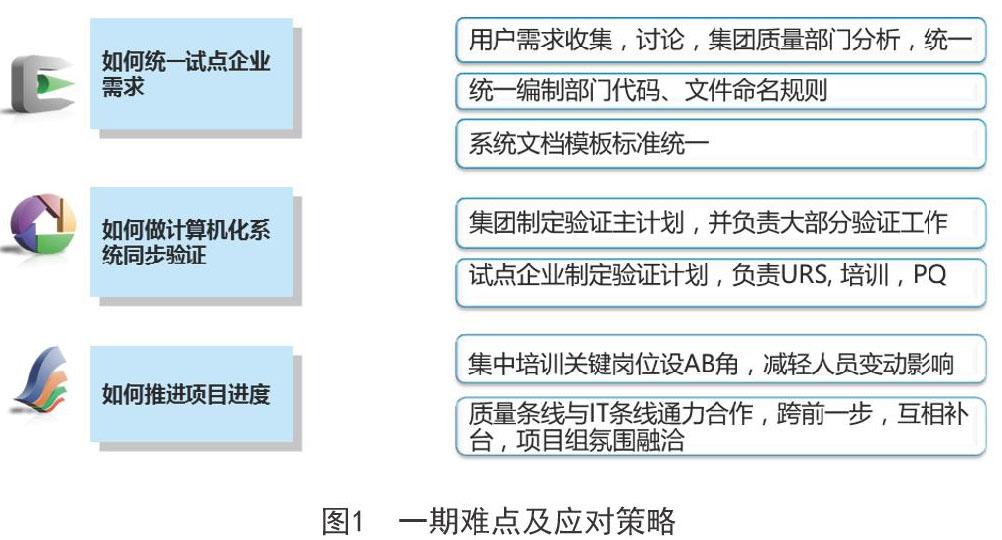
在一期,我们面临三个难点,分别是:①如何统一试点企业需求?②如何做计算机化系统同步验证?③如何推进项目进度?
我们的应对策略如图1:
通过充分借鉴所选软件承载的管理模式与最佳实践,充分吸取管理良好企业的经验方法,我们形成统一规范和标准,上下达成共识,发布后严格执行,使一期项目得以顺利上线并平稳运行[1]。
2CSV验证方法
因为DMS系统和质量相关,根据法规要求,必须同步完成计算机化系统验证(CSV)。由于项目实施主要是采用产品配置方式实现,根据GAMP5指南,用4类(可配置产品)验证方法进行计算机化系统验证工作。
本次实施中质量部门全程参与项目,且有对应的业务负责人、验证负责人和质量负责人参与进行审核,项目经理对项目风险进行把控,多方紧密配合,完全依据CSV的要求和方法论推进,确保了CSV的顺利完成。
因为采用集中部署,具有共性的计算机化系统验证工作由集团总部完成,具体包括:供应商审计、验证主计划、验证计划模板、系统影响性评估、需求说明书、功能说明书、功能性风险评估、系统架构说明书、系统配置说明、设计审查报告、安装说明书、IQ方案脚本和报告、OQ方案脚本和报告、PQ方案、系统操作手册、追溯矩阵、验证总结报告。
由于集团总部已完成上述工作,各子公司仅需完成验证计划、需求调研、系统培训和PQ部分的工作,80%的验证工作量由集团总部这边统一完成,避免子公司进行不必要的重复性计算机化验证工作。
项目过程中一旦出现一些偏差或者是需要变更之类的,集团总部发起一份变更就好,不用各个子公司再发起一遍。一期做过的供应商审计和IQ验证等工作也可以在二期中进行简化,这对于将来在全集团的生产单位推广使用该系统的时候,将会节省巨大的CSV工作量和时间,积累了经验。
3效益分析
通过一期项目建设和软件的平稳运行,我们总结取得的效益如下:①DMS的文件分类使用了DIA(药品信息协会)的模型,符合行业标准,对于不同的文件分类,依据最佳实践对应不同的生命周期以及审批流程,系统能够对文件版本进行管理,审计追踪功能保留了对文件所有的修改信息。系统提供的这些功能使得GMP相关文件合规性大大提升。②协同编辑功能使文件修改更方便高效,审批流程都是自动推送,缩短审批时间。系统对文件版本进行了有效管理,文件生效后自动升版本号,避免了文件流转过程中的丢失现象。③灵活强大的搜索功能既可以方便业务部门的使用,又可以大大节约监管机构的检查时间,提升检查效率和正确通过率,给监管部门树立良好形象。④通过集团统一部署质量文件管理系统,整个集团范围内实现标准统一,各个子公司的文件架构以及相关流程架构都得到了统一规范。通过这一系统,各子公司的文件管理遵守集团统一要求,并由经过验证的计算机系统进行管控,在满足运营管控战略要求下,同时为其提供高效的文件管理系统工具。⑤相关部门能够更为有效、透明地管控质量,集团与子公司更为高效地协同,在整体上将合规的能力提升到新的水平,向获取完全的运营管控能力迈出了坚实的第一步。⑥通过这个项目的实施,可以很好地起到练兵的作用,项目参与人员的能力都得到提升,制造环节的质量部门与信息化部门也可以形成良好的工作关系和默契,為后续系统的建设积累经验并打下坚实的人员基础。
4结束语
通过统一部署质量文件管理系统,集团可以在权限合规的情况下,方便查阅目标子公司的相关文件,在必要的情况下,也可以参与相关质量管控工作,从而使得原先松散的集团与下属企业之间的关系变得更为紧密,让集团在履行药品上市持有人职责时没有后顾之忧。
本次质量文件管理系统的实施是集团集中部署的针对GMP计算机验证与合规方面进行的首次项目,也是一次积累经验和学习的过程。通过这次质量文件管理系统计算机化验证的统一工作,集团也可以带领子公司来熟悉这项工作的过程,让子公司来学习如何做计算机化系统验证,并积累相关经验,熟悉流程中各个节点要注意哪些问题。同时,由集团质量部门和IT部门一块出面,来完成计算机化系统验证的工作,形成一份集团规划的指导性文件,再把这份指导性文件推广到下属生产企业去。我们将借鉴和总结一期成功经验,今后将大规模向集团下属的其他药品生产企业推广DMS实施工作,让全集团共同提升这方面的能力。
参考文献
[1] 良好自动化生产实践指南第五版[ED/OL].https://ishare.iask.sina.com.cn/f/34351981.html,2012-10-22.
作者简介
过明祺(1977-),男,江苏无锡人;学历:本科,研究方向:软件项目管理。

