花生肽亚铁胃肠仿生消化产物对金黄色葡萄球菌的抑菌机理
肖怀秋,李玉珍,林亲录,刘军,姜明姣,赵谋明
1(湖南化工职业技术学院 制药与生物工程学院,湖南 株洲,412000)2(中南林业科技大学 食品科学与工程学院,湖南 长沙,410004)3(湖南中威制药有限公司,湖南 株洲,412000)4(华南理工大学 食品科学与工程学院,广东 广州,510000)
Antibacterialmechanismofgastrointestinalbiomimeticdigestantsfrompeanutpeptide-ferrousonStaphylococcusaureus
XIAO Huaiqiu1,4,LI Yuzhen1*,LIN Qinlu2,LIU Jun1,JIANG Mingjiao3,ZHAO Mouming4
1(School of Pharmaceutical and Bioengineering, Hunan Chemical Vocational Technology College, Zhuzhou 412000, China)2(College of Food Science and Engineering, Central South University of Forestry and Technology, Changsha 410004, China)3(Hunan Zonwe Pharmaceutical Co., Ltd., Zhuzhou 412000, China)4(College of Food Science and Engineering, South China University of Technology, Guangzhou 510000, China)
ABSTRACTTo explore the potential of peanut peptide ferrous (PPF) gastrointestinal bionic digestants (GBDs) as an antibacterial agent, antibacterial activity (ABA), surface hydrophobicity (SHP), minimum inhibitory concentration (MIC), cell membrane permeability (CMP), the extracellular leakage of ultraviolet absorption biomacromolecules and K+were studied. The results showed that the ABA of PPF can be enhanced by gastrointestinal biomimetic digestive treatment. The SHP attained its’ peak at 270 min. Simulated intestinal fragment (SIF4) at the concentration of 0.2×10-3g/L (MIC) exerted a significant bacteriostatic effect onStaphylococcusaureus(S.aureus). There were significant differences (P<0.05) for these indices such as CMP, extracellular leakage of ultraviolet absorption biomacromolecule and K+between the experimental group and the control group. After being treated using 1/2 MIC,1/4 MIC and MIC, the extracellular leakage of intracellular K+ofS.aureusincreased with the elongation of incubation time, especially for the MIC group. Research inferred that the cell membrane ofS.aureuscan be damaged after being treated with different concentrations of SIF4, which causes the cell membrane perforation and make the leakage of bioactive biomacromolecules such as protein and nucleic acid, and resulting in bacterial necrosis and exerting a good antibacterial activity. All results indicated that peanut peptide-ferrous gastrointestinal bionic digestants (GBDs) can service as a potential new polypeptide metal antibacterial agent used in food industry.
Keywordspeanut peptide ferrous (PPF); metal peptide; gastrointestinal biomimetic digestants (GBDs); food antibacterial peptide (FABP); antimicrobial mechanism
抗菌肽一般由10~60个氨基酸残基组成,具有热稳定性好、抗菌活性高、特异性强、生物毒性低、副作用较少且不易产生耐药性等优势,有望成为抗生素理想替代品[1]。近几年,抗菌肽(或金属抗菌肽)备受关注,如YE等[2]从花生种子提取液分离得到的抗菌肽Hypogin具有较好抗真菌活性;付云等[3]从螺旋藻渣发酵液分离的抗菌肽SP-AP-1和Iturin A均表现良好的金黄色葡萄球菌抑菌活性;SHIN等[4]合成的具有β-转角的十二肽对大肠杆菌和枯草芽孢杆菌有良好抑菌活性;邓尚贵等[5]制备的鱼蛋白肽亚铁(80%乙醇分级沉淀物)对枯草芽孢杆菌和金黄色葡萄球菌有显著抗菌效果;林慧敏等[6]对舟山海域4种低值鱼进行酶解,酶解物均无抑菌活性,但经亚铁螯合修饰后均表现出对金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌不同程度抑菌活性;杨玉蓉等[7]制备的桃仁多肽亚铁螯合物(PKP3-Fe)对大肠杆菌和金黄色葡萄球菌有很好的抑菌作用。金黄色葡萄球菌是自然界广泛存在的G+球菌[8],易造成乳制品、水产品及肉类加工制品污染并产生肠毒素而造成食物中毒[9],抑制其在食物中增殖,对保障食品安全有重要意义。花生肽亚铁作为一种金属肽,可作为一种潜在的抑菌剂进行研究。目前,除本课题组[10-12]外,对花生肽亚铁研究较少,特别是其抑菌活性研究未见报道。本试验系统研究了花生肽亚铁(peanut peptide ferrous,PPF)及其胃肠仿生消化产物(gastrointestinal bionic digestants,GBDS)对金黄色葡萄球菌抑菌活性并对抑菌机理进行了初步研究,以期为花生肽亚铁抑菌剂开发提供理论与技术支持。
1 材料与方法
1.1 材料与设备
花生肽亚铁(PPF),由本课题组[12]制备;胃蛋白酶、胰蛋白酶,诺维信(中国)生物技术有限公司;溴酚蓝(分析纯),国药集团化学试剂有限公司;牛肉膏、胰蛋白胨(生化级),北京博星生物技术有限公司;金黄色葡萄球菌ATCC25923,本实验室保存。
牛肉膏蛋白胨培养基(g/L):牛肉膏3.0,蛋白胨10.0,NaCl 5.0,pH 7.0,121 ℃灭菌20 min。添加20 g/L琼脂即为固体培养基。
DDS-307型电导率仪,上海雷磁仪器厂;UV-2500紫外可见分光光度计,日本岛津;HERMLE Z323K冷冻离心机,德国Hermle公司;H1650台式高速离心机,湘仪离心机仪器有限公司。
1.2 试验方法
1.2.1 人胃肠仿生消化过程
准确称取10.0 mg花生肽亚铁加入至1 000 mL胃仿生消化液中,(37±0.5) ℃、100 r/min仿生消化2 h,每隔30 min取样,命名为胃仿生消化产物(simulated gastric fragment,SGF1~SGF4);用0.5 mol/L NaOH调pH至7.6终止胃仿生消化,用十二指肠仿生消化液(37±0.5) ℃、50 r/min条件下仿生消化1 h,每间隔30 min取样,命名为十二指肠仿生消化产物(simulated duodenal fragment,SDF1~SDF2);调节pH至6.8,(37±0.5)℃、50 r/min条件下仿生小肠消化3 h,每间隔30 min取样检测,命名为小肠仿生消化产物(simulated intestinal fragment,SIF1~SIF6);不同胃肠仿生阶段消化液经冷冻干燥后备用。模拟胃肠仿生消化液配制参考《中国药典》(2010版)配制。
1.2.2 抑菌活性测定
准确吸取0.1 mL菌悬液(6×108CFU/mL)均匀涂布在培养基表面,将灭菌后的4只牛津杯置于培养皿中并分别加入0.1 mL质量浓度为0.1、0.2、0.4 和0.8×10-3g/L花生肽亚铁或仿生消化产物。为使试液充分扩散到琼脂层,将培养皿于4 ℃放置2 h后于37 ℃培养24 h,用游标卡尺测定抑菌圈直径并用平均直径(mm)表示抑菌活性[13]。
1.2.3 表面疏水性测定
准确移取1 mL 0.01 g/L花生肽亚铁或仿生消化产物,加入200 μL 1 g/L溴酚蓝,以磷酸盐缓冲溶液为对照,于6 000×g离心15 min,取上清液稀释10倍,测定A595nm。表面疏水性用溴酚蓝结合量表示[14],如公式(1)所示:
(1)
式中:AC为对照样品在595 nm的吸光值;AS为测试样品在595 nm的吸光值。
1.2.4 最小抑菌浓度测定
准确吸取1.0 mL质量浓度为1.0×10-3g/L的花生肽亚铁或仿生消化产物加入培养皿中,倒入牛肉膏蛋白胨培养基并充分混匀,待凝固后准确吸取0.1 mL金黄色葡萄球菌(6×108CFU/mL)于培养皿中并涂布均匀,37 ℃培养24 h,菌落被完全抑制的最低浓度即为该试样最小抑菌浓度(minmum inhibitory concentration,MIC)。
1.2.5 抑菌曲线绘制
将培养至对数生长中期(16 h)的金黄色葡萄球菌稀释至107CFU/mL,添加SIF4使终质量浓度为0.2×10-3g/L(MIC),制备成菌悬液,37 ℃、100 r/min振荡培养36 h,每间隔2 h取样5 mL,5 000 r/min离心15 min,弃上清液,加入无菌水制成菌悬液并测定A600nm[15]。
1.2.6 对细胞膜渗透性的影响
将培养至对数生长中期的菌体制备成A600nm=0.5的菌悬液。取5 mL菌悬液于5 000 r/min离心10 min,取上清液2 mL并加入无菌水8 mL,测定电导率(L2);取菌悬液5 mL和浓度为MIC、1/2 MIC和1/4 MIC的SIF45 mL作用24 h,离心后取上清液2 mL加入无菌水8 mL并测定电导率(L3);取5 mL浓度为MIC、1/2 MIC和1/4 MIC的SIF4与5 mL生理盐水混匀,取2 mL加入无菌水8 mL,测定电导率(L1);将金黄色葡萄球菌煮沸10 min,冷却至室温后作为对照并测定电导率(L0)[15]。相对电导率计算如公式(2)所示:
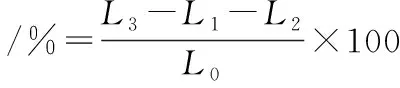
(2)
1.2.7 对紫外吸收物质渗透性的影响
取培养至对数生长中期的培养液10 mL,5 000 r/min离心10 min,收集菌体,用5 mmol/L灭菌磷酸缓冲液(pH 6.5)清洗3次,与终浓度为MIC、1/2 MIC和1/4 MIC的SIF437 ℃温育18 h,每间隔2 h取样5 mL于5 000 r/min离心15 min,上清液用0.22 μm的滤膜过滤除菌并分别测定A260nm和A280nm[15]。
1.2.8 对胞内K+泄漏的影响
向培养至对数生长中期的菌悬液(1×108CFU/mL)中加入仿生消化产物SIF4,使终浓度为MIC、1/2 MIC和1/4 MIC,37 ℃共同温育60 min,每间隔10 min取样1次,10 000 r/min离心10 min,取上清液用原子吸收光谱法测定K+浓度[3]。
1.2.9 试验数据处理
2 结果与分析
2.1 花生肽亚铁及其胃肠仿生消化产物抑菌活性分析
花生肽亚铁及其仿生消化产物抑菌活性如表1所示。

表1 花生肽亚铁及仿生化产物抑菌活性 单位:mm
由表1可知,花生肽亚铁及胃仿生消化90 min内消化产物在0.8×10-3g/L时表现抑菌活性;胃仿生消化120 min和十二指肠仿生消化150 min时,质量浓度为0.4×10-3g/L的消化产物开始表现抑菌活性;十二指肠仿生消化180 min和小肠仿生消化210~270 min段的消化产物在0.2×10-3g/L时也开始表现抑菌活性;小肠仿生消化300 min后产物均具有较好抑菌活性,且抑菌活性与仿生消化产物质量浓度成良好正相关关系;同一质量浓度仿生消化产物(如0.8×10-3g/L),抑菌活性随仿生消化进行呈递增趋势,各阶段仿生消化产物抑菌活性有显著差异(P<0.05),其他几个浓度的仿生消化产物抑菌活性也呈递增趋势,差异显著(P<0.05)。由此可知,花生肽亚铁经胃肠仿生消化后抑菌活性可得到显著增强。
2.2 仿生消化对表面疏水性的影响
仿生消化对花生肽亚铁表面疏水性的影响如图1所示。

图1 花生肽亚铁及其仿生消化产物表面疏水性Fig.1 The surface hydrophobicity of PPF and GBDs注:图中不同小写字母表示差异显著(P< 0.05)(下同)
由图1可知,仿生消化产物表面疏水性呈递增趋势。胃仿生消化30 min时,消化产物表面疏水性(7.64±0.64) μg与未仿生消化花生肽亚铁表面疏水性(7.12±0.58) μg差异不显著;胃仿生消化120 min时表面疏水性显著增加至(11.46±0.41)μg(P<0.05);十二指肠仿生消化阶段120~180 min和小肠仿生消化240 min时,表面疏水性增幅不显著(P>0.05);消化270 min时,消化产物表面疏水性达到最大(15.84±0.33) μg,随后消化产物表面疏水性增幅不显著,说明仿生消化270 min时疏水性基团充分暴露,研究结果与CHEN等[17]一致。AMADOU等[18]认为,多肽表面疏水性与抗菌活性有重要关系,LEE等[19]和YE等[20]研究也发现,多肽疏水基团暴露有利于抗菌活性发挥。
2.3 最小抑菌浓度(MIC)分析
花生肽亚铁及其仿生消化产物MIC分析结果如表2所示。

表2 花生肽亚铁及其仿生消化产物最小抑菌浓度Table 2 Minimum inhibitory concentration (MIC) of PPF and GBDs
由表2可知,仿生消化不同程度增强了花生肽亚铁的抗菌活性。花生肽亚铁和胃仿生消化30~60 min产物的MIC为0.8×10-3g/L;胃仿生消化90 min产物MIC为0.5×10-3g/L;仿生消化120~150 min产物MIC为0.4×10-3g/L;仿生消化180~270 min的消化产物MIC降至0.3×10-3g/L;小肠仿生消化300 min后,MIC均为0.2×10-3g/L。结合消化产物表面疏水性变化趋势,花生肽亚铁抑菌活性变化与表面疏水性变化基本一致,与LEE等[19]和JIANG等[21]报道相似。考虑到小肠仿生消化300 min(SIF4)及随后消化产物表面疏水性和MIC变化不明显,后续试验采用SIF4进行抑菌机理研究,MIC确定为0.2×10-3g/L。
2.4 抑菌曲线
MIC组与对照组生长曲线如图2所示。

图2 花生肽亚铁及其仿生消化产物抑菌曲线Fig.2 Antibacterial curve of PPF and GBDs
由图2可知,MIC组培养0~6 h时与对照组相比生长差异不显著(P<0.05),培养8 h后,MIC组与对照组均呈现显著性差异(P<0.05);对照组在培养16~18 h进入到对数生长中期,24 h和30 h分别进入稳定期和衰亡期,而MIC组菌体生长慢,培养20 h时达到生长高峰(A600nm=0.52),仅为对照组最高值的39.83%,由此可知,MIC浓度的SIF4对菌体生长有明显抑制。研究还发现,对照组稳定期维持时间相对较长,而MIC组不仅生长相对缓慢,培养20 h后也逐渐进入衰亡期,相比对照组衰亡时间提前,林慧敏[15]在研究带鱼蛋白肽亚铁螯合物时也得到类似结论。
2.5 对细胞膜渗透性的影响
花生肽亚铁及其仿生消化产物对细胞膜渗透压的影响如图3所示。相对电导率是衡量细胞膜透性的重要指标,数值越大表示胞内电解质渗漏越多,反映细胞膜受损越明显[22]。由图3可知,试验组与对照组有显著差异(P<0.05),特别是MIC组。MIC组与1/2 MIC和1/4 MIC组也存在显著差异(P<0.05);细胞膜受损程度随SIF4处理时间延长而增加,其可能机理是由于花生肽亚铁的疏水性C端嵌入膜内疏水区引起膜上蛋白质构象改变,使细胞膜裂解并促使膜内离子外逸,或与细胞膜相互作用形成瞬态孔隙和离子通道并使胞内离子外逸[23],现有研究发现,抑菌肽对真核生物正常细胞影响较小[24]。

图3 花生肽亚铁及其仿生消化产物对细胞膜渗透性的影响Fig.3 The effect of PPF and GBDs on cell membrane permeability
2.6 对胞内紫外吸收物质泄露的影响
花生肽亚铁及其仿生消化产物对胞内紫外吸收物质泄露的影响如图4所示。

a-A280nm测定结果;b-A260nm测定结果图4 花生肽亚铁及其仿生消化产物对紫外吸收物质泄露的影响Fig.4 The effect of PPF and GBDs on leakage of ultraviolet absorbing substances
蛋白质与核酸最大吸收波长为280 nm和260 nm,吸收值大小可反映胞内紫外吸收物质含量[25]。由图4-a可知,随着加入到样品中SIF4增多,胞内蛋白质泄露增加,MIC组与1/4 MIC组和1/2 MIC组差异显著(P< 0.05);由图4-b可知,胞内核酸物质泄露存在类似现象。试验表明,金黄色葡萄球菌经SIF4处理后,细胞膜遭到不同程度损伤,造成细胞膜穿孔,胞内蛋白质与核酸等紫外吸光大分子物质泄露,进而引发细胞坏死[3,26],可能是由于Fe2+与菌体细胞接触后,带负电荷的细胞壁脂多糖与Fe2+正电荷相吸,使多肽金属络合物穿透细胞壁进入菌体,并与膜蛋白质或胞内蛋白质和核酸结构中活性基团(如—NH2、—SH等)发生反应,破坏细胞膜和影响活性生物大分子结构,进而扰乱细胞代谢发挥抑菌活性[27]。
2.7 对胞内K+泄漏的影响
花生肽亚铁及其仿生消化产物对胞内K+泄露影响如图5所示。

图5 花生肽亚铁及其仿生消化产物对胞内K+泄露的影响Fig.5 The effect of PPF and GBDs on intracellular potassium leakage
细胞内K+泄露与细胞膜完整性有重要关系,泄露程度可反映细胞膜损伤程度[28]。由图5可知,试验组与对照组存在显著差异(P< 0.05);对照组胞内K+检测浓度极低,试验组随SIF4添加量的增加,细胞膜损伤也越趋严重,MIC组细胞膜受损程度显著高于其他组(P<0.05);随着温育时间延长,细胞膜受损也越趋严重,10~30 min组别间,1/2 MIC组与MIC组差异不显著(P>0.05),1/4 MIC组与对照组差异仍有显著差异(P<0.05),随着温育时间延长,MIC组细胞内K+泄露显著高于其他组别(P<0.05),由此可说明,处理浓度与温育时间对细胞膜损伤有重要影响,呈正相关关系;随着处理浓度与温育时间的延长,胞内K+泄露也越来越多,可能是由于仿生消化产物破坏了细胞膜完整性,膜孔径增大和膜透性增加,破坏了细胞保钾机制,使胞内K+泄露,从而表现出抑菌活性甚至导致菌体死亡[28]。
3 结论与讨论
考察了花生肽亚铁及其胃肠仿生消化产物对金黄色葡萄球菌的抑菌作用并进行了抑菌机理研究。研究发现,花生肽亚铁经胃肠仿生消化后抑菌活性得到显著增强,各阶段仿生消化产物抑菌活性有显著差异,特别是小肠仿生消化300 min后的产物均具有较好抑菌活性,且抑菌活性与产物浓度有良好量效关系;消化产物表面疏水性随仿生消化时间延长而呈递增趋势,消化270 min时表面疏水性达到最大;仿生消化产物MIC为0.2×10-3g/L。MIC组对金黄色葡萄球菌生长有明显抑制作用且比对照组菌体提前坏死。试验组与对照组细胞膜透性有显著差异,特别是MIC组。试验组与对照组胞内紫外物质泄露和胞内K+泄露也均存在显著差异。
花生肽亚铁胃肠仿生消化产物破坏金黄色葡萄球菌细胞膜完整性是否为导致其细胞坏死的主要原因还需进一步确证。课题组通过研究消化产物表面疏水性、细胞膜渗透性、紫外吸收物质泄露和胞内K+泄漏等变化,认为抑制机理可能是由于花生肽亚铁疏水性C端嵌入膜内疏水区并引起膜上蛋白质构象改变,通过与细胞膜相互作用形成瞬态孔隙,使细胞膜裂解,膜孔径增大和膜透性增加,破坏细胞膜完整性,使胞内蛋白质与核酸等生物大分子由胞内逸出,同时,形成离子通道促使胞内K+外逸,从而起到抑菌作用甚至导致菌体死亡。同时,Fe2+正电荷也可能与带负电荷的细胞壁脂多糖相吸,使多肽金属络合物穿透细胞壁进入菌体,并与细胞膜蛋白质或胞内蛋白质与核酸等生物大分子中的活性基团发生反应,破坏细胞膜和影响生物大分子结构,扰乱细胞代谢而起到抑菌作用。

