pH偏移对花椒籽蛋白理化指标及乳化性能的影响
刘庆庆,黄 河,罗宇柯,何玉鑫,袁永俊
(西华大学食品与生物工程学院,四川 成都 610039)
花椒籽是花椒(果皮)生产的副产物,产量比花椒(果皮)高约20%,含油脂27.1%、蛋白质18.7%[1]。花椒籽的蛋白由清蛋白(27.65%)、球蛋白(35.68%)、醇溶蛋白(8.75%)、谷蛋白(12.33%)和剩余蛋白(15.59%)组成[2]。花椒籽蛋白的提取和功能性质研究[2-3]、酶解制备降血压肽的研究[4]等已有相关报道。
蛋白质的结构决定其功能,改变蛋白质结构可以改变其功能。pH偏移使蛋白质分子展开-重折叠,可得到结构介于天然态和完全伸展态之间的“熔球态”[5]而改变其功能。经适宜的pH偏移处理后,乳清蛋白[6]、大豆分离蛋白[7-8]、大豆浓缩蛋白[9]、豌豆蛋白[10]和肌球蛋白[11]等的功能得到不同程度的改善,将pH偏移联合超声处理豌豆蛋白[12]、联合热处理大豆分离蛋白[13]使其表面疏水性、乳化性等部分功能得到进一步改善。
花椒籽蛋白的重要应用领域有乳化食品、药物递送载体等,但有关改善花椒籽蛋白乳化性能的研究却鲜见报道。为此,本文研究了pH偏移对花椒籽蛋白乳化性能的影响,以期为花椒籽蛋白的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
花椒籽,蛋白质含量为30.5%±0.25%,购于成都市本地菜市场;脱脂花椒籽粉(80目),实验室自制;SDS、β-巯基乙醇、NaOH、HCl、考马斯亮蓝等均为分析纯;SDS-PAGE凝胶电泳试剂盒、蛋白质Marker,上海源叶生物科技有限公司。
1.2 仪器与设备
电子天平(JA2003),上海舜宇恒平科学仪器有限公司;紫外可见分光光度计(UV-2600A),上海尤尼柯仪器有限公司;pH计(PHS-3S),上海仪电科学仪器股份有限公司;电泳仪(DYY-8C),北京市六一仪器厂;全自动凯氏定氮仪(K1100),山东海能科学仪器有限公司;纳米粒度及电位分析仪(ZEN 3 600),马尔文仪器有限公司;冷冻干燥机(Lyolab 3 000),丹麦Heto Holten公司。
1.3 实验方法
1.3.1 花椒籽蛋白质的提取
按寇明钰[2]的方法并适当修改。取适量脱脂花椒籽粉,按料液比1∶10加入蒸馏水,调pH10并维持pH恒定条件下,于25 ℃搅拌提取1 h后,4 000 r/min离心10 min,收集上清液并调pH 5.5酸析2 h后,10 000 r/min离心10 min,沉淀用蒸馏水溶解并调节pH7.0,于4 ℃透析48 h(截留分子量,3 500 Da)后,冻干得到花椒籽蛋白,-20 ℃保存。所得花椒籽蛋白的蛋白质含量为85.45%±0.31%。
1.3.2 pH偏移处理花椒籽蛋白质
按JIANG等[8]以及YILDIZ[9]的方法并适当修改。配制1 mg/mL的花椒籽蛋白溶液,用0.1 mol/L的 HCl或NaOH分别调pH1、pH2、pH3和pH11、pH12、pH13并于20 ℃维持pH恒定1 h后,调pH7.0并于4 ℃透析(3 500 Da)48 h后冻干,于-20 ℃保存。
1.4 分析方法
1.4.1 还原与非还原电泳(SDS-PAGE)
按孙雪梅等[14]的方法并适当修改。聚丙烯酰胺凝胶电泳的浓缩胶与分离胶浓度分别为5%和12%(w/v)。将浓度1 mg/mL的花椒籽蛋白溶液与上样缓冲液(25 mL 0.5 mol/L Tris,20 mL甘油,40 mL10%SDS,15 mL水,pH6.8)按4∶1混合并煮沸5 min后,冰浴并离心(10 000 r/min)10 min。还原电泳中的每1 mL上样缓冲液含50 μL的 β-巯基乙醇,非还原电泳中上样缓冲液不加β-巯基乙醇,开始电压为80 V,样品进入分离胶后调整电压为120 V。
1.4.2 粒径
按YILDIZ[9]的方法并适当修改。将花椒籽蛋白用磷酸盐缓冲液(10 mmol·L-1,pH7.0)稀释成1 mg/mL的溶液,用注射器取样于马尔文纳米粒度与电位分析仪的样品池中,动态光散射(DLS)于25 ℃测定。
1.4.3 Zeta电位
按JIANG等[15]的方法并适当修改。将花椒籽蛋白用磷酸盐缓冲液(10 mmol·L-1,pH7.0)稀释成1 mg/mL的溶液,用注射器取样于马尔文纳米粒度与电位分析仪的样品池中,激光多普勒测速法(LDV)于25 ℃测定。
1.4.4 表面疏水性
按潘成磊等[16]的方法并适当修改。称取一定质量的花椒籽蛋白于磷酸缓冲溶液中,于转速1 500 r/min匀浆1 min。取1 mL样液于2.5 mL离心管中,加入200 μL(1 mg/mL)溴酚蓝溶液,在常温下振荡均匀,随后8 000 r/min离心10 min。将上清液用蒸馏水稀释10倍后在595 nm处测定吸光值A,用磷酸盐缓冲液替代样液做空白。花椒籽蛋白的表面疏水性表示为溴酚蓝的吸附量,计算公式如下:

式中:A对照为空白溶液的吸光值;A样品为被测样品溶液的吸光值。
1.4.5 蛋白溶解度
按MIR等[17]的方法并适当修改。10 mg花椒籽蛋白分散于1 mL蒸馏水中并搅拌1 h,然后于20 ℃离心分离(10 000 r/min)30 min,上清液中溶解的蛋白质采用考马斯亮蓝法测定。溶解度的计算公式为

式中:S为溶解度;NS为上清液中蛋白质数量;N总为样品中的蛋白质数量。
1.4.6 乳化性
按CHEN等[6]以及YILDIZ[9]的方法并适当修改。取1 mg/mL的花椒籽蛋白溶液8 mL与2 mL大豆油混合,于16 000 r/min匀浆1 min后,分别在0和10 min时从底部吸取100 μL乳化液并以0.1% SDS溶液稀释50倍,于500 nm处测定吸光值,以0.1% SDS溶液作为空白。乳化活性指数(EAI,m2/g)和乳化稳定性指数(ESI,min)计算公式如下:

式中:A0为0时吸光值;A10为10 min时吸光值;N为稀释倍数,50;C为蛋白质质量浓度,g/mL;θ为油相体积分数,0.2。
1.5 数据分析
数据结果采用OriginPro 2018C作图。每组实验重复3次,结果以“平均值±标准差”显示。使用IBM SPSS Statistics 20软件对数据结果进行显著性分析,在P<0.05水平上显著相关。
2 结果与分析
2.1 SDS-PAGE电泳图谱
非还原SDS-PAGE电泳中,SDS作为变性剂和助溶剂,能断裂分子内和分子间的氢键,使分子去折叠而破坏蛋白分子的二、三级结构,可观察蛋白质原始状态。还原SDS-PAGE电泳中,强还原剂β-巯基乙醇能断裂蛋白分子间的二硫键,可观察蛋白单体甚至亚基。以未经pH偏移的花椒籽蛋白为对照,实验结果如图1和图2所示。

图1 非还原SDS-PAGE电泳图谱
由图1可见:pH1和pH2泳道中分子量大于45 kDa的条带消失,14.4 kDa下方出现新的条带,pH3泳道的条带与对照相似但颜色变浅;pH11和pH12泳道中的条带与对照相似但14.4、45~66.2 kDa之间的条带颜色加深,pH13泳道中18.4~35 kDa之间出现新条带,分子量大于116 kDa的条带颜色变浅,14.4和45 kDa上方的条带颜色变深。由图2可见:pH1、pH2泳道新增了条带,25、35 kDa的条带消失或颜色变浅,pH3泳道的条带与对照相似;pH11、pH12和pH13泳道中的条带与对照相似,但pH13泳道中35 kDa的条带颜色比对照深。

图2 还原SDS-PAGE电泳图谱
综上,pH1-3偏移处理后使得非还原及还原电泳图谱中大量大分子条带消失而小分子条带增多,而pH11-13偏移处理对花椒籽蛋白的非还原及还原电泳图谱的影响相对较小,与YONGSAWATDIGUL等[18]的报道类似。原因可能在于pH1-3偏移处理对蛋白质共价作用的影响较大,使蛋白质的部分肽键断裂,但同时通过二硫键连接形成了更多的聚集产物,从而使其在电泳上样缓冲液中的溶解度降低(与下文图3、图6的实验结果相对应),而pH11-13偏移处理主要改变了蛋白质内部非共价作用,如氢键、范德华力、疏水相互作用等。
2.2 pH偏移对花椒籽蛋白粒径的影响
蛋白质粒径是影响其乳化活性和乳化稳定性的重要指标,一般来讲,粒径小有利于提高乳液的乳化稳定性。pH偏移对花椒籽蛋白粒径的影响如图3所示。
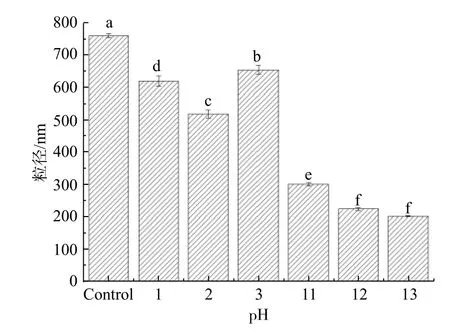
图3 pH偏移对花椒籽蛋白粒径的影响
由图3可知:对照组的聚集粒径最大(762.82±6.95 nm),pH偏移使花椒籽蛋白在pH7.0缓冲溶液中的聚集粒径减小,但pH1-3处理的聚集粒径减小幅度小于pH11-13处理;pH2处理后的聚集粒径(521.23±12.33 nm)为对照组的0.684,而pH11、pH12、pH13处理后的聚集粒径为303.7±5.5、226.53±4.19和204.2±1.39 nm,分别为对照组的0.398 1、0.297和0.267 7。可能原因是pH11-13处理时,花椒籽蛋白因远离等电点而结构更容易被破坏,分子内及分子间的氢键、疏水力、范德华力等作用力减弱而使其较大的聚集体发生集聚,蛋白质重折叠(pH 7.0)后依然保持着较小的粒径[6,9]。
2.3 pH偏移对花椒籽蛋白表面疏水性的影响
表面疏水性与蛋白质的乳化性能、起泡性能、凝胶性能等功能密切相关[12]。pH偏移对花椒籽蛋白表面疏水性的影响如图4所示。

图4 pH偏移对花椒籽蛋白表面疏水性的影响
由图4可知:对照组疏水性最小(55.3±2.35 μg),pH偏移显著提高了表面疏水性。pH1-3处理后,表面疏水性随pH增加而降低,pH1时表面疏水性最大(165.7±1.34 μg);pH11-13处理后,表面疏水性大于pH1-3处理,pH11、pH12和pH13的表面疏水性为187.3±0.54、201.3±0.46 和221.2±1.23 μg,分别是对照组的3.39、3.64、4.0倍。这可能是pH11-13远离花椒籽蛋白质的等电点,由于静电斥力增强迫使蛋白质结构严重破坏,分子充分展开而暴露出更多的疏水基团,蛋白质重折叠(pH7.0)后依然保持着较高的表面疏水性[6,9]。
2.4 pH偏移对Zeta电位的影响
Zeta电位表示粒子在溶液中的带电情况,可反映蛋白质在溶液中的悬浮稳定性[19]。pH偏移处理对Zeta电位的影响如图5所示。

图5 pH偏移对花椒籽蛋白Zeta电位的影响
由图5可知:除pH3处理的花椒籽蛋白的Zeta电位(-17.5±1.11 mV)绝对值略低于对照组(-18.3±1.01 mV)外,其余pH处理的花椒籽蛋白其Zeta电位绝对值均高于对照组;pH1-3处理后,pH2所得花椒籽蛋白的Zeta电位绝对值最高(-23.4±1.26 mV);pH11-13处理使Zeta电位绝对值的增大幅度整体大于pH1-3处理,pH12所得花椒籽蛋白的Zeta电位绝对值最高(-28.3±1.79 mV),为对照组的1.55倍。Zeta电位绝对值的增大表明静电斥力增大,因而有利于防止蛋白质在溶液中聚集而提高其悬浮稳定性。
2.5 pH偏移对花椒籽蛋白质溶解度的影响
溶解性是蛋白质重要的功能性质之一,极大影响蛋白质在溶液中的使用比例,良好的溶解度是其作为乳化剂的先决条件[12]。pH偏移对花椒籽蛋白质溶解度的影响如图6所示。

图6 pH偏移对花椒籽蛋白溶解度的影响
由图6可知pH偏移处理可提高花椒籽蛋白的溶解度。pH1-3处理使溶解度略有提高,pH11-13处理使溶解度大幅度提高,pH12处理所得花椒籽蛋白的溶解度为85.31%±1.15%,为对照组(15.7%±1.4%)的5.43倍。可能原因是pH11-13偏移处理后蛋白质分子内及分子间的氢键、疏水力、范德华力等减弱,使得蛋白质聚集体发生部分解聚,粒径降低且表面积增大,暴露出更多亲水基团,从而蛋白质与水的离子关系得到强化[6,9],进而促进了溶解度提高。pH12处理大豆分离蛋白(SPI)、大豆浓缩蛋白和豌豆蛋白[7-10]也显著提高了溶解度。
2.6 pH偏移对花椒籽蛋白乳化性能的影响
乳化性能是蛋白质重要的功能性质,常用乳化活性指数(EAI)与乳化稳定性指数(ESI)进行评价。pH偏移对花椒籽蛋白乳化性能的影响如图7所示。
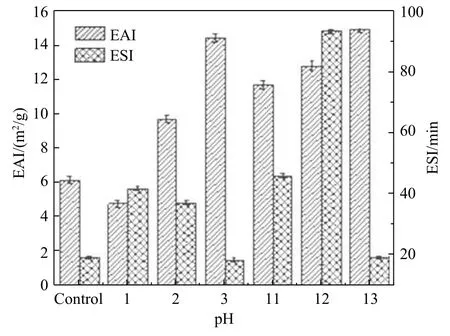
图7 pH偏移对花椒籽蛋白乳化性能的影响
由图7可知pH偏移处理可提高花椒籽蛋白的乳化活性和乳化稳定性。pH1-3处理后,乳化活性指数随pH增加而增加,乳化稳定性指数则随pH增加而降低,无法兼顾高乳化活性和高乳化稳定性。pH11-13处理后,pH11和pH13同样难以兼顾乳化活性和乳化稳定性,但pH12处理的样品则较好地兼顾了高乳化活性和高乳化稳定性,其乳化活性指数(13.44±0.71 m2/g)为对照组(6.69±0.53 m2/g)的2.01倍,乳化稳定性指数(97.80±0.74 min)为对照组(19.48±0.67 min)的5.02倍。pH12处理的花椒籽蛋白能兼顾高乳化活性和高乳化稳定性,可能是因为花椒籽蛋白具有较小的粒径、较大的表面疏水性和较强的静电斥力及其三者之间的平衡,有助于蛋白质快速吸附于油水界面并形成稳定的界面弹性膜。
3 结论
pH偏移能明显改变花椒籽蛋白的理化指标及乳化特性,pH1-3与pH11-13的处理均能降低花椒籽蛋白的粒径并提高花椒籽蛋白的Zeta电位、表面疏水性、溶解度、乳化活性指数和乳化稳定性指数。综合来看,pH12的处理效果对于花椒籽蛋白理化指标及乳化性质的改善最为明显,具体表现为pH12偏移处理后所得到的花椒籽蛋白的粒径由762.82±6.95 nm降低至226.53±4.19 nm、Zeta电位由-18.3±1.01 mV降低至-28.3±1.79 mV、表面疏水由55.3±2.35 μg增大至201.3±0.46 μg、溶解度由15.7%±1.4%增大至85.31%±1.15%、乳化活性指数由6.69±0.53 m2/g增大至13.44±0.71 m2/g、乳化稳定 性 指 数 由19.48±0.67 min增 大 至97.80±0.74 min。该结论为花椒籽蛋白的开发提供了理论依据,对于提高花椒籽综合利用水平具有积极意义。

