轮虫表型可塑性及其生态学效应研究进展
何雨晗 徐 军 姚 慧 张 欢
(1. 中国科学院水生生物研究所, 武汉 430072; 2. 中国科学院大学, 北京 100049; 3. 中南民族大学生命科学学院, 武陵山区特色资源植物种质保护与利用湖北省重点实验室, 武汉 430074)
轮虫是一类营浮游、底栖或周丛生活的小型无脊椎多细胞动物, 属于轮虫动物门 (Phylum Rotifera)。轮虫体型微小, 大多数种的体长在100—500 μm。目前世界上已知约有2030种轮虫, 其中约1570种属于单巢纲 (Monogononta), 其余则分别属于蛭态纲 (Bdelloidea) 和尾盘纲(Seisonidea)[1]。
表型可塑性 (Phenotypic plasticity), 是指在不同环境因素或生物内在因素诱导下, 生物形态由单一转变为多样的外观防御性变化[2]。简而言之, 表型可塑性指的是生物体在周围环境发生变化时能够产生不同的适应表型[2]。表型可塑性在自然界中广泛存在, 是生物体对改变的理化及生物环境因子的适应。如萼花臂尾轮虫 (Brachionus calyciflorus)在与捕食者晶囊轮虫 (Asplanchna) 共同培养时, 具有较长的防御性棘刺以及更大的体型[3—5]。随着表观形态的改变, 一个物种与其他物种及环境之间的关系也随之发生改变[2]。这种表观形态的改变是生物能在不同环境及影响因素下保持生存的重要原因[2,6]。对表型可塑性的研究有助于更深入地理解生物的种间关系及其与环境的相互作用。
单巢纲中多种轮虫可展现出不同表型形态变化[7—10]。轮虫的表型可塑性自20世纪50年代首次被Beauchamp发现以来[11], 一直吸引着许多科研工作者对其进行研究[4,12—15]。轮虫的表型形态改变大多数是针对外源环境因素, 包含对捕食者及竞争者信息素 (Kairomone) 的响应, 也有一部分是对低温及较低食物质量的应答。如部分臂尾轮虫及龟甲轮虫 (Keratella) 在上述环境因素存在时, 可被诱导产生棘刺增长, 体型增大, 被甲 (Lorica) 增厚等形态改变。部分轮虫的形态改变如图 1所示[7,8, 10,16—21]。除了外源环境因素, 内源性因素也会影响轮虫的形态防御表达[22—24]。轮虫对内源因素的响应多为母体效应及休眠卵阶段带来的影响[23,24]。母体效应对萼花臂尾轮虫的形态改变是通过带卵母体进行影响, 从而改变后代形态。当母体暴露于捕食者信息素或其他环境因素时, 母体将这些外部信息呈递给卵, 卵孵化后的幼体具有形态防御改变[24]。而由休眠卵孵化而来的轮虫通常具有基础形态[22]。
既然表观形态的改变能使生物在环境因素改变时及时适应, 为何这种表型改变并非总是存在?原因是表观形态的改变需要付出一些代价[26,27]。例如, 部分轮虫产生形态防御性改变的同时会降低繁殖率以及有性生殖率[28,29]。在产生形态防御改变, 获得适合度收益的同时, 有部分轮虫也相应地付出了适合度代价[26,28—30]。这些代价包括繁殖速率降低, 沉降率增加, 有性繁殖率降低等[29]。
综合以上各论点, 本文综述了环境因子诱导的轮虫形态防御特征, 以及这种防御产生的内源性因素, 并对防御的适合度收益及适合度代价进行阐述。通过对目前国内外已有的研究进行整理, 为广大学者提供参考。

图1 轮虫形态改变对比图Fig. 1 Comparison of rotifer morphology
1 环境因素
许多轮虫的形态防御反应可由一种或多种不同环境因子引发[7]。信息素、温度及食物是目前已知能诱导轮虫产生形态响应的主要的环境因素[8,10]。通过试验及野外观测, 已知目前约有22种轮虫能够被环境因子诱导形态响应(表 1)。其中, 已知萼花臂尾轮虫与热带龟甲轮虫对三种环境因素(信息素、温度及食物)均响应; 螺形龟甲轮虫 (K. cochlearis) 对信息素及低温有形态响应。三肢轮属的Filinia pejleri与F. temtinalis对低温具有形态响应[31]。镜轮属的微凹镜轮虫 (Testudinella mucronata) 与盘镜轮虫 (T. patina) 具有诱导性的形态响应, 但诱导因素还未明确[32]。除此之外, 其余轮虫均对信息素产生形态响应(表 1)。在这22种轮虫之外, 目前还未有研究发现环境因素对其他轮虫的形态诱导响应。

表1 已知对环境因素产生形态塑形响应的轮虫种类Tab. 1 Rotifer species known to respond to environmental factors at present
1.1 信息素
信息素简介 信息素(利它素, Kaironmone)是一种由不同捕食者 (Predator) 或竞争者 (Interference competitor)释放于环境中从而诱导被影响的生物产生防御性响应的物质[46]。尽管Weiss等[47]已分析出幽蚊幼虫 (Chaoborussp.) 产生的能够诱导蚤状溞 (Daphnia pulex) 颈齿 (Neckteeth) 形态防御的信息素的结构组成, 并发现这种信息素是由脂肪酸与蛋白共轭结合组成的化合物, 但目前还没有研究发现任何一种轮虫捕食者信息素的具体成分组成[7]。Gilbert[48]通过链霉蛋白酶处理认为晶囊轮虫信息素可能是一种蛋白质。而它也具有不稳定的特性,在20℃ 时仅需1.5d活性便可下降一半[33,48,49]。但信息素的具体组成仍待探究。
部分轮虫、枝角类、桡足类、节肢动物或鱼类等分泌的信息素在一些情况下可诱导轮虫产生棘刺增长或缩小、被甲增厚、体型增大或减小等变化[7, 9, 13, 28, 50]。萼花臂尾轮虫则是第一例被发现具有对捕食者信息素形态防御反应的浮游生物[11,51]。除捕食者信息素以外, 对轮虫活动、摄食等产生干扰的竞争者信息素也可诱导部分轮虫棘刺产生变化[12, 21, 25, 50, 52]。信息素对轮虫的影响与捕食者本身所属种类、捕食者体型大小以及是否依赖视觉进行捕食等因子都有关[9,43]。
不同种类的捕食者或竞争者信息素可诱导轮虫产生不同的响应。晶囊轮虫的信息素可以诱导多数臂尾轮虫和龟甲轮虫棘刺显著增长, 而仰泳蝽(Buenoa fuscipennis)和拟鲤 (Rutilus rutilus) 仔鱼信息素等可以抑制热带龟甲轮虫棘刺增长[13,43]。轮虫对竞争者的形态响应总体弱于对捕食者的响应,防御性棘刺增长程度也许与信息素种类有关[50]。与晶囊轮虫相比, 热带龟甲轮虫对蚤状溞信息素的响应较为不敏感, 蚤状溞信息素浓度需达到454 μg/L才可诱导热带龟甲轮虫棘刺长度达到最大值的一半[10]。对于同种诱导生物, 棘刺增长程度也许与信息素浓度有关[10]。随着晶囊轮虫密度从空白增至8 ind./L, 萼花臂尾轮虫后侧棘刺与热带龟甲轮虫右后侧棘刺长度先是出现指数性增长, 然后逐渐到达最大值。在晶囊轮虫数目为1.2或1.8 ind./L(或信息素干物质含量为1.7或2.5 μg/L时)时二者被诱导的棘刺长度分别达到最大值的一半[7]。
信息素诱导轮虫棘刺长度变化的机制目前仍然未知。在萼花臂尾轮虫中, 个体是否具有棘刺在幼体尚未孵化, 处于细胞分裂阶段时已决定[7]。目前有三种关于信息素诱导轮虫产生防御性表型特征的理论[53]。第一, 认为信息素直接作用于卵, 这一作用可能是在成熟的卵母细胞被几丁质包裹并产出之前, 诱导细胞膜上的受体发生改变, 而信息素并不能渗透卵。第二, 认为外界的信息素能够渗透卵, 且开始分裂的细胞也对信息素产生响应。第三, 信息素通过诱导母体而产生棘刺增长的后代[53]。
捕食者信息素轮虫感知捕食者信息素后,能非常迅速地产生形态防御响应[15]。例如, 当处于繁殖期的萼花臂尾轮虫暴露于晶囊轮虫信息素富集液时, 其产出的雌性后代在较短时间(24h内)内便能陆续地被诱导出棘刺[11,48]。而从诱导形态回复到初始形态则需要更长时间。由于捕食者持续存在, 轮虫无需在其短暂的生命中从诱导形态恢复到原始形态[54]。具有诱导性棘刺的母体在信息素影响消失后会继续生产具有棘刺的幼体[15]。
目前已发现大约有20种捕食者信息素可诱导轮虫产生形态响应, 主要包括多种无脊椎动物如轮虫、桡足类和昆虫类, 也包括某些脊椎动物鱼类等[4, 9, 28, 43, 50, 52, 55]。轮虫对不同类别的捕食者响应存在差异。各类别捕食者按体型可分为大型捕食者(脊椎动物鱼类、昆虫类)和小型捕食者(轮虫、桡足类)。例如, 当与体型较小的捕食者的信息素(如晶囊轮虫, 体型为萼花臂尾轮虫的两倍左右)共存时, 萼花臂尾轮虫响应表现为棘刺增长、体型增大以及被甲增厚, 这类响应也许有助于轮虫逃脱捕食者的捕猎[4,28]。而当较大型的捕食者仰泳蝽、拟鲤仔鱼和介形动物Cypris pubera存在时, 龟甲轮虫的棘刺及体型缩小能够帮助其躲避视觉捕食者(Visual predator) 的捕食, 增加存活率[13,43,55]。轮虫能根据捕食者的大小改变自己的防御体型以更好地适应环境变化[43]。表 2罗列了目前已发现能诱导轮虫产生形态响应的捕食者, 以及轮虫对这些捕食者的不同的形态响应。
在已知捕食者中, 对晶囊轮虫信息素的研究较多。目前已发现有6种臂尾轮虫、5种龟甲轮虫、1种平甲轮虫对晶囊轮虫信息素具有棘刺增长的响应[7]。此外, 也发现跃进三肢轮虫 (Filinia passa) 对晶囊轮虫信息素有刚毛增长的响应[38]。Lecane stokeii对多突晶囊轮虫 (Asplanchnopus multiceps) 有棘刺增长的响应等[45]。轮虫对晶囊轮虫信息素的响应比较强烈且迅速。臂尾轮虫及龟甲轮虫对卜氏晶囊轮虫 (A. brightwellii) 及盖氏晶囊轮虫 (A.girodi) 的形态防御响应较为显著[4,12, 25, 44,48]。卜氏和盖氏晶囊轮虫可诱导萼花臂尾轮虫双侧后侧新生棘刺, 以及使其增长以及体型增大[4]。而晶囊轮虫又可诱导热带龟甲轮虫和K. slacki右后侧棘刺显著增长, 以及有时伴随左后侧棘刺缩短, 甚至消失。这种单侧棘刺增长, 另一侧略微缩短的形态防御对晶囊轮虫也有良好甚至更好的防御效果, 并且被认为能够最大程度地减小棘刺增长的代价[18,44]。
总体来看, 由于较长的棘刺长度或体长可使其自身较难被晶囊轮虫捕获, 轮虫对晶囊轮虫信息素的响应是通过增加棘刺长度、体长、体宽及被甲厚度来实现。诱导产生的棘刺使被捕食轮虫体长超过晶囊轮虫口径大小, 即使被吞食, 具有防御性棘刺的被捕食轮虫相比基础形态个体也较容易逃脱[10, 29]。
同样作为捕食者的桡足类, 其信息素也可以诱导龟甲轮虫产生棘刺增长或缩短的防御反应, 目前已知有1种臂尾轮虫, 4种龟甲轮虫对桡足类具有形态防御响应[9, 12, 18, 21, 25, 52]。轮虫对桡足类信息素的响应总体上弱于对晶囊轮虫的响应, 这或许是由于桡足类对轮虫的捕食效率相对较低, 在一组试验中,每只盖氏晶囊轮虫每日可摄食约15只螺形龟甲轮虫, 而中剑水蚤 (Mesocyclops pehpeiensis) 或近剑水蚤 (Tropocyclops prasinus) 每日仅可摄食6或5只螺形龟甲轮虫[25]。
轮虫对介形类、昆虫、扁虫及脊椎动物鱼类信息素产生的形态响应, 总体表现为体型缩小, 棘刺缩短。有3种龟甲轮虫对昆虫信息素产生防御性形态响应[9,12,13]。例如, 当仰泳蝽存在时, 热带龟甲轮虫尾部棘刺缩短, 甚至消失[13]。螺形龟甲轮虫对霓虹脂鲤 (Paracheirodon innesi) 和拟鲤仔鱼信息素产生的形态防御反应为体型缩小, 棘刺变短[9,43]。B. havanaensis与热带龟甲轮虫被分别发现对扁虫Stenostomum leucope和介形类C. pubera有棘刺轻微增长及棘刺缩小, 或者不产生棘刺防御[21,55]。

表2 可诱导轮虫产生形态响应的捕食者Tab. 2 Predators induced morphological response in rotifers
在自然环境中, 捕食者及其信息素在不同水域的分布也可能会影响轮虫的形态响应。Otake等[57]发现当菱作为庇护所存在时, 萼花臂尾轮虫的防御性棘刺比开放水域的同种轮虫短, 丰度较低, 且晶囊轮虫在开放水域丰度较高。这也许是庇护所降低了轮虫与捕食者相遇的概率的原因。
竞争者信息素除了捕食者, 一部分不捕食轮虫但与轮虫形成竞争关系的竞争者 (Interference competitor), 如枝角类及桡足类也可以诱导轮虫形态发生改变[12, 21, 25, 50, 52]。轮虫对竞争者的形态响应主要在于抵抗干扰。例如, 在轮虫与枝角类蚤状溞共存时, 防御体型可保护螺形龟甲轮虫, 从而使其更快地摆脱枝角类缠绕[12]。轮虫对竞争者的形态响应总体上弱于对捕食者的响应[12,21,50]。表 3 罗列了目前已知可诱导轮虫产生形态响应的竞争者。

表3 可诱导轮虫产生形态响应的竞争者Tab. 3 Interference competitors induced morphological response in rotifers
1.2 温度
在外温动物 (Ectotherms) 中, 动物形态变化一定程度上符合温度-大小规律 (Temperature-size rule)[58]。温度也是一种诱导轮虫形态响应的重要环境因子, 在低温条件下, 轮虫可出现体型增大, 棘刺轻微增长的响应。
Gilbert[10]通过室内试验发现热带龟甲轮虫的棘刺长度改变与水温呈负相关。室内试验研究发现在低温下, 萼花臂尾轮虫、螺形龟甲轮虫及热带龟甲轮虫可表现出一定程度的棘刺增长[7,10, 33,42]。在室外种群研究中, 螺形龟甲轮虫棘刺或被甲长度也与水温负相关[59]。不过与晶囊轮虫信息素作为诱导因素相比, 温度对萼花臂尾轮虫和热带龟甲轮虫的诱导程度较低[10,34]。
全球地理区域的温度差异似乎也会影响轮虫体型大小。项贤领等[60]发现尽管随着温度升高, 各地理品系萼花臂尾轮虫体现均呈现缩小趋势, 但不同地理品系轮虫体型缩小程度存在差异。这种形态响应的差异或许是轮虫长期适应当地环境, 从而具有的对恶劣条件的不同的抵抗力[60,61]。轮虫棘刺长度对温度的响应也可能反映在不同纬度区域的差异上。如图 2所示, Zhang等[43]总结了全球10个不同纬度区域水生态系统的螺形龟甲轮虫年均棘刺长度, 发现轮虫棘刺长度随纬度升高而增长。
轮虫形态对温度的响应可能是对不同水温水体理化环境的适应。Carlin[62]最早提出低温可能会增加水体粘滞力, 降低水体涡流, 因此轮虫需要一定程度上增长棘刺以抵抗沉降。Pejler[63]认为增长的体型和棘刺长度可以降低轮虫下沉速率。但Gilbert[17]认为轮虫是否通过增长棘刺或增大体型抵抗沉降还与轮虫自身重力和被甲厚度有关, 例如具有较长棘刺的螺形龟甲轮虫个体在水体中的沉降速率高于基础形态的个体, 这或许是由于螺形龟甲轮虫被甲更厚, 在水中重力较大。
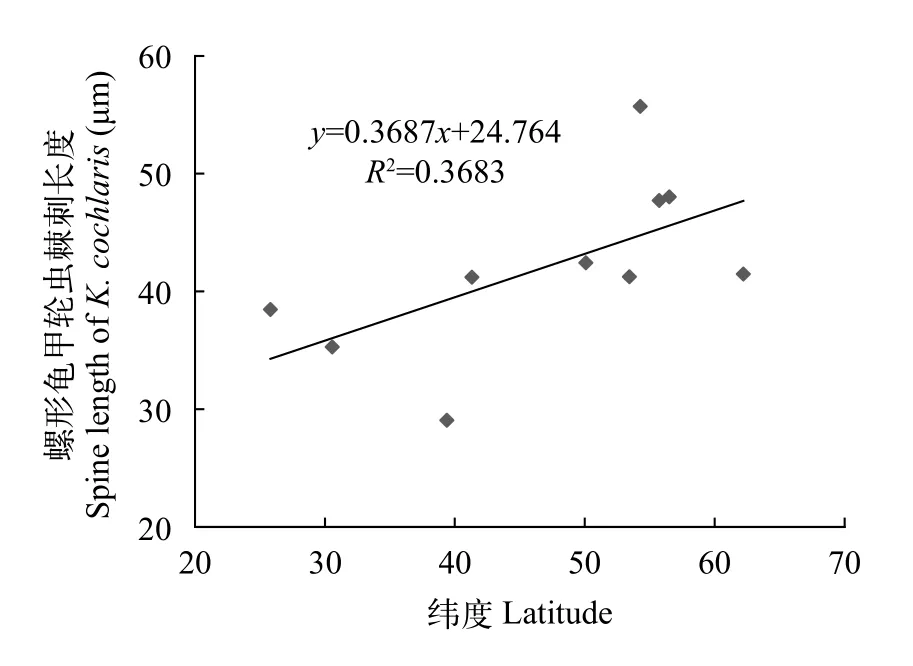
图2 轮虫棘刺长度与纬度的相关性(改自文献 [43])Fig. 2 The relationship between spine length of rotifer and latitudes(modified from [43])
1.3 食物
室内研究发现食物浓度的高低在一定程度上也影响轮虫棘刺的生长[13]。在低食物浓度情况下,萼花臂尾轮虫与热带龟甲轮虫表现出一定程度的棘刺增长[13,33]。B. havanaesis在小球藻食物浓度为1×106cell/mL时, 其后侧棘刺长度长于食物浓度为0.5×106和2×106cell/mL时[8], 并且在水温20℃及25℃, 晶囊轮虫信息素存在时, 后侧棘刺增长, 而在信息素不存在时, 未表现出棘刺增长, 这种响应产生的原因仍然不明。食物浓度与某些捕食者信息素(如晶囊轮虫信息素)对轮虫棘刺生长可产生叠加效应[10]。在控制实验中, 萼花臂尾轮虫同时暴露在低食物浓度和晶囊轮虫的处理中, 棘刺长度被诱导达到最长, 新生幼体在低食物浓度处理组中具有较长的棘刺及较小的个体[20]。食物浓度与温度也存在叠加效应。在食物浓度适宜时, 高温或低温都可诱导B. havanaesis体型减小[8]。尽管有研究认为增长的体型可以增加轮虫对食物的获取, 但目前还未有研究探究体型与摄食效率及其相关影响因素的关系[8]。
信息素、温度及食物这三种因素都受到棘刺能增长的最大长度的制约, 轮虫能产生的最长防御棘刺长度在孵化前已经决定[33]。Gilbert[7]认为信息素、低温及劣质食物都是对母体带卵阶段产生影响。除了已具有形态防御反应的臂尾轮科 (Brachiondae) 轮虫外。还有研究发现——微凹镜轮虫(T. mucronata) 和盘镜轮虫 (T. patina) 中的部分个体体表向身体内部凹陷。但这一现象由什么因素引发仍然未知[32]。
2 内部因素
目前研究发现影响轮虫防御形态的内部因素主要有两类, 分别为母体效应及休眠卵孵化带来的影响。这两种效应并非直接作用于轮虫, 而是通过其带卵及休眠卵阶段对轮虫产生的形态塑形影响[22,24]。
2.1 母体效应
母体效应即母体的基因或表型对子代的影响[64]。母体效应被认为是生物为了增加后代适合度的一种适应[65]。在萼花臂尾轮虫与晶囊轮虫的捕食-被捕食关系中, 当晶囊轮虫密度较低, 信息素浓度不足以引起轮虫产生迅速的形态防御, 但其存在又足以对轮虫产生威胁时, 轮虫母体产出的幼体会随着其出生顺序的增加而逐渐具有更强的防御体型[24]。在没有诱导因素时, 有一部分萼花臂尾轮虫的克隆种群也表现出棘刺的分化[66]。而且在这部分轮虫繁殖的后代中, 有些轮虫完全不具有棘刺, 而有些棘刺长度可达到被晶囊轮虫诱导的程度。这一表现与母体年龄有关。母体较早带卵产出的幼体仅具有很短的棘刺, 甚至没有棘刺。而较晚产出的幼体具有较长的棘刺, 棘刺长度随着幼体出生顺序的增加而增加[15,24,66]。萼花臂尾轮虫的这种母体年龄效应在后生动物中十分独特, 因为它能在短短的一代内便发生显著的形态改变[7]。这种母体效应可能是动物应对变化未知的环境做出的“双面下注”(Bet-hedging strategy) 对策[66]。
2.2 休眠卵
Li等[22]通过研究不同环境条件下的休眠卵孵化后的形态, 发现受到晶囊轮虫信息素影响的混交雌体母体产生的休眠卵及内部胚胎尺寸小于未暴露于信息素的母体, 并且其休眠卵孵化出的幼体及后代对于晶囊轮虫信息素产生防御性棘刺的敏感度低于母体没有暴露过的休眠卵后代。Gilbert等[67]也观察到尽管母体具有防御形态, 通过休眠卵孵化的轮虫个体通常具有较短的棘刺, 甚至不具备防御体型, 他认为这也许是休眠卵阶段可能会抑制轮虫产生防御体型。不论是母体效应或由休眠卵孵化产生的形态塑性改变, 都可能是轮虫为了增加后代适合度作出的响应[67]。
3 轮虫防御形态的收益与代价
轮虫在产生形态响应时, 会获得适合度收益(Fitness benefit) 或付出适合度代价 (Fitness cost)[29]。具有防御性棘刺响应的轮虫在与捕食者共存时, 被发现具有更低的被摄食率。这种防御性形态响应使得轮虫在捕食者存在时能保证种群的存活。但试验研究发现捕食者及其信息素不存在时, 这种防御性特征并不普遍, 这显示防御性形态比普通形态可能需要更多的代价[17,68,69]。
3.1 适合度收益
轮虫能通过产生防御性形态变化减少被捕食的概率, 增加适合度收益。首先, 晶囊轮虫及其他捕食者信息素诱导产生的棘刺增长可以增加晶囊轮虫的捕食难度, 降低轮虫的被消化率, 因此这一形态变化可增加轮虫与晶囊轮虫共存时的适合度[25,28,70]。Gilbert[68]与Halbach[71]发现轮虫对捕食性晶囊轮虫密度变化十分敏感, 当晶囊轮虫密度一旦达到阈值,轮虫迅速响应, 表现为产出棘刺增长的后代。在萼花臂尾轮虫等轮虫中, 新生个体具有最大的棘刺体长比, 这种分布能较好保护种群中较弱小个体。而年龄较大的个体其较小的棘刺即使不能带来最大适合度, 但其较大的体型同样能减少其被捕食的概率[68]。Yin等[28]研究发现卜氏晶囊轮虫可诱导角突臂尾轮虫 (B. angularis) 被甲增厚, 从而降低被摄食率及延长被摄食的时间。角突臂尾轮虫被摄食率对比见图 3。

图3 基础形态与防御形态角突臂尾轮虫 (B. angularis) 被摄食率对比[被摄食率=100×(被摄食轮虫个数/成功被捕获轮虫个数)][28]Fig. 3 Prey ingestion rate between basic form and defensive form of B. angularis fed by A. brightwellii [Prey ingestion rate = 100 ×(number of ingestion/number of successful capture)][28]
K. slacki与热带龟甲轮虫在与晶囊轮虫接触后, 诱导产生的单侧棘刺能有效抵御捕食[18,44]。这种单侧棘刺能提供不输双侧棘刺的防御, 并最小化棘刺增长带来的代价[44]。
枝角类及桡足类诱导龟甲轮虫产生的棘刺短于晶囊轮虫诱导臂尾轮虫产生的棘刺, 但这种短棘刺面对甲壳动物时, 防御效果仍然较好[25,52]。由于枝角类不是轮虫的主要捕食者, 热带龟甲轮虫响应枝角类的棘刺与响应晶囊轮虫的棘刺相比带来的适合度收益较低[13]。晶囊轮虫诱导产生的被捕食轮虫棘刺及体型变化可能反过来使晶囊轮虫体型增大[72]。
除了应对捕食压力, 低温诱导棘刺增长也可降低轮虫在水体中的下沉。有两种解释: 较长的棘刺能抵消低温带来的水体低扰动, 使轮虫保持在水体中漂浮; 或较长的棘刺能抵消低温下体型增大带来的下沉[7,10]。较低食物浓度诱导的棘刺增长和体型增大或许同样能降低轮虫在水中的下沉率[20]。或者可能在食物浓度较低时, 增加食物摄取[8]。
除了环境因素, 由内部因素影响产生的形态塑性也可使幼体在晶囊轮虫密度未达到阈值时便具有防御能力。母体效应使轮虫将感受的外界压力传递给未孵化的幼体, 诱导幼体产生防御性体型,以更好地抵御外界不良环境[24,66]。
3.2 适合度代价
捕食者及其信息素不存在时, 轮虫的防御性特征并不普遍, 这似乎显示防御性形态比普通形态需要付出更多的适合度代价[17,68,69]。
塑形的代价多是由诱导该种防御而产生[73]。根据试验情况, 环境条件的不同, 不同轮虫产生防御所需的代价程度有差异。
固定代价 (Fixed costs) 指在任何条件下均会产生的代价[29]。固定代价中最为显著的则是分配代价(Allocation costs), 指能量从繁殖向防御转移的权衡分配。由防御形态带来的流体动力方面的能量支出也属于分配代价[74]。在许多生态系统中, 尽管多年没有发现晶囊轮虫, 热带龟甲轮虫和K. morenoi仍然保留了对晶囊轮虫产生防御的潜力[44]。这显示保留这一能力似乎代价很小。当然, 还有可能是晶囊轮虫, 或者其休眠卵通过风传播、动物携带等方式从别的生态系统进入而未被发现。剪形臂尾轮虫 (B. forficula) 中具有长棘刺的个体相比短棘刺个体将分配更多的能量用于个体生长, 用于繁殖的能量则减少[35]。无论食物浓度高低, 观察发现龟形龟甲轮虫中具有针对卜氏晶囊轮虫防御的个体生殖率明显低于基础形态个体[17]。这可能是由于长棘刺的个体将能量用于棘刺增长或者抵抗下沉。并且在龟形龟甲轮虫中, 这一代价与其胸甲的密度相关, 长棘刺的个体更大概率具有胸甲, 而胸甲增加了龟形龟甲轮虫的重力。因此, 对于一部分具有防御形态的轮虫而言, 棘刺及胸甲的生长可能会将原本用于繁殖的能量用于棘刺增长或者抵抗下沉[7]。
在萼花臂尾轮虫和热带龟甲轮虫中, 与上述繁殖率降低的情况相反, 具有防御性棘刺的个体繁殖率不低于, 甚至超过基础形态的个体[20,44, 55, 68,75]。与龟形龟甲轮虫相比, 这些轮虫胸甲也许更薄, 因此棘刺增长带来的代价也许十分微小。更多观察研究显示与基础形态个体相比, 具有防御形态的萼花臂尾轮虫无论是游泳行为还是摄食率没有明显差异[7,76]。也有研究认为防御体型的轮虫具有棘刺和较大的体型, 也许在食物充足时具有较高的繁殖率[12,25]。不过Gilbert[7]认为室内试验可能低估了水流带来的影响。
形态防御带来的另一种代价为机会代价 (Opportunity costs)[29], 即一些不可避免的, 但不涉及能量消耗的代价。例如, 一部分具有防御性棘刺的个体无法成功孵化即属于这种代价。这一代价有时可能会降低轮虫的繁殖率[29]。
有些类型的代价不一定与被诱导的防御形态相关, 这种代价称为可变代价 (Variable costs) 或环境代价 (Environmental costs)[29,74]。这种代价也许只在一定的环境中表现, 在实验室则不一定能发现。野外及室内试验显示萼花臂尾轮虫对捕食者产生防御需要付出一些代价[77], 但在生命表实验中,可响应晶囊轮虫的防御型萼花臂尾轮虫也没有显示出明显的代价, 这可能由于具有防御性棘刺的基因型在晶囊轮虫密度人为控制增大的时候占有优势[7]。代价是否明显也与食物浓度有关。在食物浓度较低时, 轮虫显示出较明显的性别倾向, 较少产生休眠卵[29,70]。
值得注意的是, 适合度代价所带来的影响本身可能也会再次影响轮虫的适合度。例如, 由防御带来的休眠卵数目减少可能会进一步影响轮虫的短期或长期适合度[70]。
4 总结与展望
轮虫的形态防御可以展现出极高的可塑性[7]。具体表现为: (1)在捕食者存在的情况下, 被捕食轮虫的棘刺可从几乎不可观察增长至与体长相当, 部分轮虫体表的被甲也相应地增厚。(2)竞争者也会诱导轮虫产生一定程度的形态防御。(3)在低温与食物缺乏的情况下, 轮虫表现出一定程度的棘刺增长。这些变化都可能是在条件不利于自身的情况下的一种适应性的改变[4, 28, 67]。
在内源性影响因素中, 母体效应也会造成同种轮虫形态的差异[22,24,66]。(1)随着母体年龄的增长,晚出生的幼体与早出生的幼体相比倾向于带有更长的防御性棘刺, 这是由于母体可能随着时间的增长, 暴露于诱导因子的机会增加, 产出带有较长棘刺的幼体有利于增加幼体的存活[66]。(2)由休眠卵孵化的个体通常为不具防御体型的个体, 这也许是休眠卵阶段抑制了防御体型的发生[67]。
轮虫的防御特征为其自身带来适合度收益的同时, 也存在适合度代价[28,29]。轮虫在繁殖与防御之间存在权衡[29]。在萼花臂尾轮虫的室内试验中,尽管没有发现棘刺对种群增长产生明显影响, 但在野外这种影响是否存在并未探明。对于一部分具有防御形态的轮虫, 如龟形龟甲轮虫而言, 棘刺及胸甲等防御性特征的生长会令其将原本用于繁殖的能量用于棘刺增长或者抵抗下沉, 从而降低繁殖率。因此, 在捕食者不存在的情况下, 较强的防御性特征并不总是存在[17,78]。
尽管轮虫的快速防御性特征已被许多实验及观察证实, 但这种防御的产生机制目前仍不明确。
轮虫对不同环境因素快速响应的差异, 及不同地区的轮虫对同一环境因素响应的差异是由何种因素引起, 未来需要对这种防御的分子及遗传机理、信息素的具体作用进行更深的研究。
———在龟甲、兽骨上刻字的朝代

