菌根真菌对重度干旱胁迫下桃叶杜鹃生理生化的影响
李林盼,欧 静,陈荣建,杨舒婷,何跃军
(贵州大学 林学院,贵州 贵阳 550025)
桃叶杜鹃(Rhododendronannae)系杜鹃花科杜鹃属植物,其树形、花色都极具观赏性[1]。桃叶杜鹃分布于高海拔地区,是典型的杜鹃花类菌根(ERM,Ericoidmycorrhizas)植物,但其不耐干旱的特性使其在园林观赏应用方面受到限制。因此,迫切需要解决桃叶杜鹃在栽培养护中不耐干旱的难题。迄今,关于ERM对桃叶杜鹃的影响研究集中在种子萌发及幼苗移植[2]、光合性能[3]、促生效益及生理生化[4]方面,同时也从生长[5]、光合参数[6]、荧光参数[7]、内源激素[8]、生理特性[9]、显微结构[10-11]等方面报道了ERM对桃叶杜鹃抗旱能力的影响。但关于ERM是如何动态调节桃叶杜鹃游离脯氨酸(Pro)含量、超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量及内源激素含量来缓解重度干旱对其造成伤害的研究鲜见报道,而往往重度干旱对桃叶杜鹃生长更为不利。鉴于此,以桃叶杜鹃菌根苗为材料,通过人工盆控水试验,研究重度干旱环境下,ERM对桃叶杜鹃生理生化指标的影响,以期为阐明ERM提高桃叶杜鹃抗重度干旱胁迫机制提供理论依据。
1 材料和方法
1.1 材料
PDA培养基:马铃薯200.0 g、葡萄糖20.0 g、琼脂粉20.0 g、蒸馏水1 000 mL,121 ℃条件下高温高压蒸汽灭菌20 min。
供试菌株:TY29(AB158314:Trametesochracea)、TY35(AB378554:Pochoniabulbillosa)由野外桃叶杜鹃根系分离保存[2],在PDA培养基上进行平板培养,接种后置于25 ℃、暗环境下培养14 d,待菌丝长满基质后作为菌剂使用;桃叶杜鹃种子:采自贵州省百里杜鹃方家坪,用0.5% KMnO4溶液消毒15 min,再用无菌水漂洗干净后播种;播种基质:腐殖土、珍珠岩按3∶1体积比混合,在121 ℃条件下高温高压蒸汽灭菌20 min,自然冷却备用。育苗基质:采自百里杜鹃方家坪桃叶杜鹃林下腐殖质土。
1.2 方法
在花盆(高18.5 cm、内口径21 cm)中装入2/3高度的播种基质,铺上长满菌丝的PDA培养基(CK铺无菌丝PDA培养基)后覆盖少量基质,均匀播撒桃叶杜鹃种子,用灭菌后的松针覆盖,放入温度25 ℃、相对湿度85%、光照24 h的人工气候箱内培养。待幼苗出土生长120 d后,将各接菌处理移栽到装入等量育苗基质的塑料花盆(高10 cm、内口径11 cm)中,每盆1株,放置贵州大学林学院苗圃大棚内进行菌根苗培育管理。2016年7月,选择长势一致的植株开始控水。试验设2个土壤相对含水量处理,即W:80%~90%(正常水分条件),T:35%~40%(重度干旱胁迫)。每个处理重复30盆。按盆栽控水法,每天17:00称质量(电子称质感0.1 g),维持土壤相对含水量在试验所需范围内,在水分处理期间的当天(0 d)和7、14、21、28 d取顶芽向下第4片功能叶,根系取样部位为须根,对各项指标进行随机取样检测。
1.3 测定指标及方法
游离Pro含量采用酸性茚三酮显色法测定,MDA含量采用硫代巴比妥酸法测定,SOD活性采用氮蓝四唑光还原法测定[12]。内源激素含量测定取样方法参照陈荣建等[8]方法,待全部取样完成后送中国农业大学采用酶联免疫吸附检测法测定。
1.4 数据处理
采用WPS记录数据及绘图,使用SPSS 20.0软件进行统计分析,采用单因素方差分析和Duncan’s多重比较法进行方差检验分析。
2 结果与分析
2.1 不同处理对桃叶杜鹃游离Pro含量的影响
由图1可见,正常水分条件下,各处理游离Pro含量变化不明显;重度干旱初期,接种ERM菌株桃叶杜鹃游离Pro含量与CK差异不大,随着重度干旱胁迫时间持续,7 d时,各处理游离Pro含量上升,与CK相比接菌处理游离Pro含量上升较快;14 d时,TY29和TY35处理游离Pro含量达到最大值,较CK分别增加278.45%、437.62%。在21 d和28 d,桃叶杜鹃游离Pro含量下降,接种ERM菌株桃叶杜鹃游离Pro含量均高于CK;在28 d,重度胁迫下CK Pro含量较正常水分降低54.96%,而TY29和TY35处理在重度干旱胁迫下仍保持接近正常水分条件的游离Pro含量。

不同小、大写字母表示同一时间同一水分条件下不同接菌处理差异显著(P<0.05)、差异极显著(P<0.01),下同
2.2 不同处理对桃叶杜鹃SOD活性的影响
由图2可知,在正常水分条件下及干旱初期,桃叶杜鹃苗SOD活性差异不大;随着重度干旱胁迫时间增加,桃叶杜鹃SOD活性呈上升变化,在14 d时达到最大值,接种ERM菌株处理与CK差异极显著(P<0.01),TY29和TY35处理较CK分别增加194.82%、160.70%;在21 d和28 d,桃叶杜鹃SOD活性随着胁迫的持续呈逐渐降低的趋势,低于各处理正常水分条件下的含量,接菌处理始终高于CK。

图2 不同水分条件下桃叶杜鹃菌根苗SOD活性变化
2.3 不同处理对桃叶杜鹃MDA含量的影响
由图3可知,重度干旱下,桃叶杜鹃MDA含量随胁迫增加呈升高-降低变化,接菌处理与CK差异明显。在干旱胁迫初期,MDA含量随胁迫时间持续呈增加变化,CK重度干旱下变幅最大,在14 d达到最大值,较正常水分条件下增加120.69%,随后呈下降变化。21 d时,TY29和TY35处理在重度干旱下MDA含量急剧上升并达到最大值,分别较正常水分条件下增加116.48%、198.41%,与CK差异极显著(P<0.01)。与21 d相比,28 d时各处理在重度干旱条件下MDA含量急剧下降,接菌处理始终高于CK。
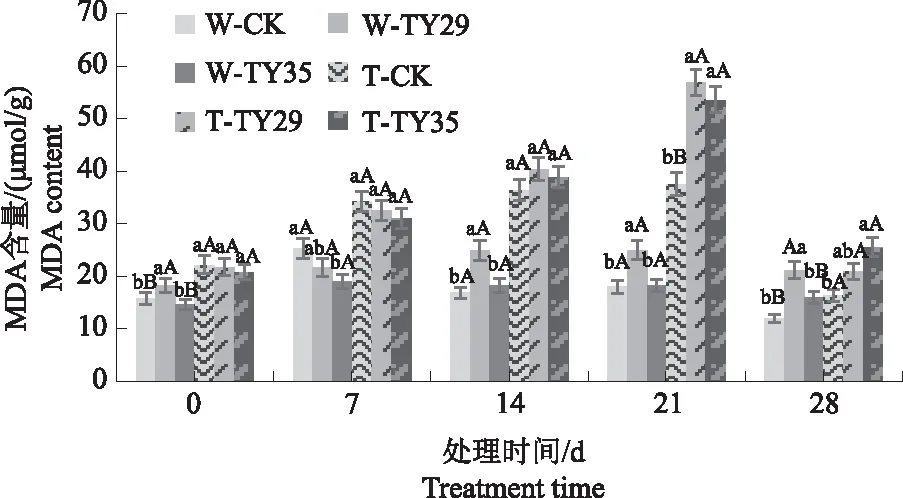
图3 不同水分条件下桃叶杜鹃菌根苗MDA含量变化
2.4 不同处理对桃叶杜鹃IAA含量的影响
由图4可知,重度干旱胁迫0 d和7 d,接种ERM菌株叶片、根系IAA含量都有不同程度的增加,以7 d增幅最大,TY29和TY35处理叶片IAA含量分别较CK增加48.41%、47.71%,TY35处理根系IAA含量较CK增加29.39%,TY29处理则稍低于CK,差异不显著。14 d和21 d,叶片IAA含量呈下降变化,根系IAA含量达到最大值,接菌处理高于CK,差异极显著(P<0.01);21 d,TY29、TY35处理叶片IAA含量较CK分别增加121.7%、60.21%,根系IAA含量较CK分别增加48.64%、69.09%。28 d,接种ERM菌株叶片IAA含量迅速增加,与CK差异极显著(P<0.01),TY29和TY35处理分别较CK在重度胁迫下增加181.46%、140.65%,根系IAA含量呈降低变化。

图4 不同水分条件下桃叶杜鹃菌根苗叶片、根系IAA含量变化
2.5 不同处理对桃叶杜鹃ABA含量的影响
由图5可见,正常水分条件下,CK与接菌处理桃叶杜鹃叶片及根系ABA含量差异不一;随着重度胁迫时间的持续,桃叶杜鹃叶片及根系ABA含量急剧上升,根系ABA含量高于叶片。0 d时,正常水分条件下,TY29和TY35处理叶片、根系ABA含量分别较CK增加26.36%、49.90%和20.24%、38.47%;重度干旱下,叶片ABA在始终保持较高的含量,根系ABA在7、14 d呈上升变化,在14 d达到最大值并维持较高的ABA含量,TY29和TY35处理叶片、根系ABA含量分别较CK增加16.36%、32.72%和23.43%、46.26%。

图5 不同水分条件下桃叶杜鹃菌根苗叶片、根系ABA含量变化
2.6 不同处理对桃叶杜鹃GA3含量的影响
由图6可见,重度干旱胁迫下,桃叶杜鹃GA3含量随着胁迫时间持续呈升高变化,接种ERM菌株能增加桃叶杜鹃GA3含量。随着胁迫持续,叶片和根系GA3含量都有不同程度的增加;桃叶杜鹃叶片GA3含量整体变化不大,以重度干旱28 d时差异最大,TY29和TY35处理较CK分别增加42.48%、44.61%;重度干旱下,CK根系GA3含量在7 d较0 d增加后呈降低变化,接菌处理根系GA3含量呈增加趋势并保持较高水平,以14 d增幅和差异最大,TY29处理较正常水分条件下增加43.57%,较CK增加43.60%,TY35处理较正常水分条件下增加23.30%,较CK增加37.93%。

图6 不同水分条件下桃叶杜鹃菌根苗叶片、根系GA3含量变化
2.7 不同处理对桃叶杜鹃ZR含量的影响
由图7可见,随着胁迫时间持续,桃叶杜鹃ZR含量呈升高降低变化,接种ERM菌株对桃叶杜鹃ZR含量影响不一。重度干旱下,CK桃叶杜鹃叶片ZR含量变化不大,接菌处理能适当增加叶片ZR含量,TY35处理在21 d和28 d差异极显著(P<0.01),21 d时各处理叶片ZR含量达到最大值,28 d各处理叶片ZR含量呈降低变化,重度干旱下CK、TY29和TY35处理分别较21 d下降32.35%、39.71%、39.05%;0~7 d,CK根系ZR含量变化不大,TY29处理呈降低变化,TY35处理呈增加变化,在14 d和21 d,根系ZR含量均有不同程度增加,根系ZR含量高于叶片,14 d重度干旱胁迫下根系ZR含量的增幅最大,CK、TY29和TY35处理分别较正常水分下增加37.77%、17.23%、51.28%,重度干旱胁迫28 d根系ZR含量呈降低变化,CK、TY29和TY35处理分别较21 d下降24.53%、31.51%、25.40%。

图7 不同水分条件下桃叶杜鹃菌根苗叶片、根系ZR含量变化
2.8 不同处理对桃叶杜鹃IAA/ABA、ZR/ABA、(IAA+ZR+GA3)/ABA值的影响
重度干旱下IAA/ABA、ZR/ABA、(IAA+ZR+GA3)/ABA值总体呈下降变化。IAA/ABA值越高,生长越快,IAA/ABA值越小越促进植物休眠。由表1可见,重度干旱下,接种ERM菌株IAA/ABA值高于CK,IAA/ABA值降幅小于CK,CK、TY29和TY35处理在28 d较0 d分别下降66.30%、35.35%和22.29%。由表2可见,重度干旱胁迫下,接种ERM菌株ZR/ABA值低于CK,对桃叶杜鹃生长起抑制作用,28 d时,TY29和TY35处理的ZR/ABA值分别低于CK 0.29%和11.36%,随着胁迫持续,接菌处理可以通过减少ZR含量来降低细胞分裂活动,降低对水分的消耗,增强桃叶杜鹃保水能力。重度水分胁迫下,接种ERM菌株(IAA+ZR+GA3)/ABA值高于CK,在28 d时,TY29和TY35处理分别较CK增加51.20%和40.70%(表3)。
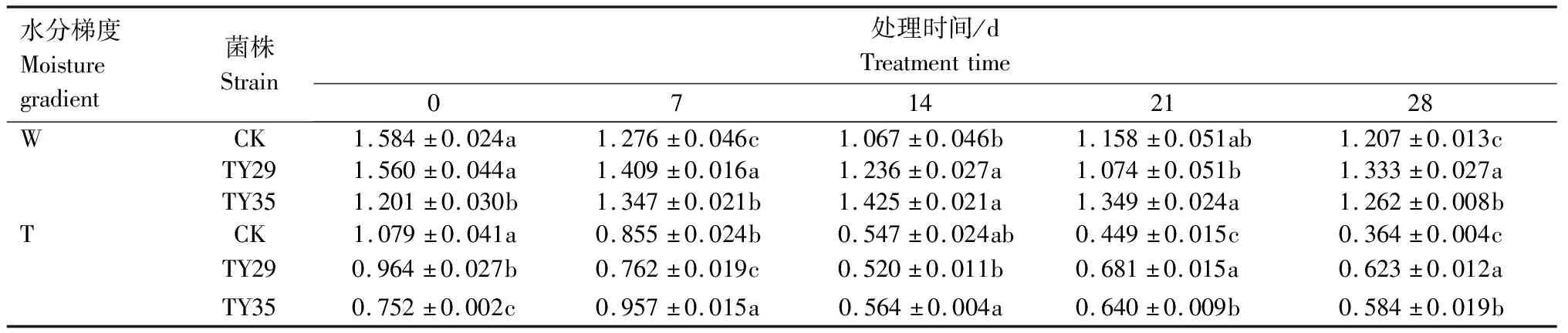
表1 不同水分条件下桃叶杜鹃菌根苗IAA/ABA值变化

表2 不同水分条件下桃叶杜鹃菌根苗ZR/ABA值变化
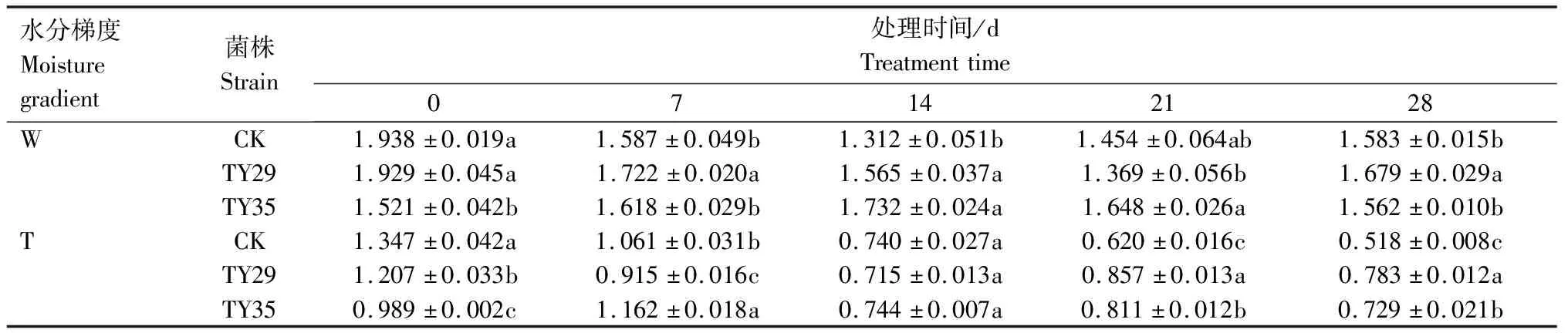
表3 不同水分条件下桃叶杜鹃菌根苗(IAA+ZR+GA3)/ABA值变化
2.9 不同处理对桃叶杜鹃内源激素与生理生化指标的相关性分析
由表4可知,对重度干旱胁迫下桃叶杜鹃菌根苗内源激素与生理生化指标进行相关性分析得出,菌株与SOD活性、Pro、IAA、ABA、GA3、ZR含量显著正相关,IAA、ABA、GA3、ZR与Pro含量、SOD活性呈显著正相关,IAA含量与GA3、ZR含量呈显著正相关,ABA含量与GA3含量呈显著正相关,表明接种ERM菌株能增加桃叶杜鹃内源激素含量及协作能力,有利于提高桃叶杜鹃渗透调节物质、保护酶活性,降低重度干旱的伤害,维持桃叶杜鹃在重度干旱下的生长能力,表现出较强的抗旱能力与适应能力。
3 结论与讨论
干旱环境下,植物通过多种因素的相互作用来增强其抗旱能力,本试验通过测定几个生理指标的变化来研究ERM对桃叶杜鹃抗旱能力的作用。Pro含量是反映鉴定植物抗逆性的生理指标[13]。本研究中,重度胁迫处理的14 d,TY29、TY35处理游离Pro含量分别较CK增加278.45%、437.62%,其原因可能为此时桃叶杜鹃遭受严重的干旱胁迫,ERM菌株迅速合成更多的游离Pro来进行生理调节,但调节能力随胁迫时间持续在21 d开始呈下降变化;重度干旱胁迫28 d时CK游离Pro含量下降最快,较正常水分降低54.96%,而TY29和TY35处理仍保持正常水分条件的游离Pro含量,可能是此时干旱胁迫已经对桃叶杜鹃形成严重的伤害,影响游离Pro的合成,但接种ERM菌株桃叶杜鹃游离Pro含量始终高于CK,表现出较强的抗旱能力。
有研究认为,SOD和CAT活性上升能增强植物耐旱性[14],本试验与前人对山杏接种丛枝菌根真菌的研究结果相似[15],重度干旱下,ERM菌株显著提高了桃叶杜鹃SOD活性并延缓了MDA生成,说明接种ERM菌株能明显缓解干旱对苗木细胞造成的伤害。重度胁迫21 d,接菌处理MDA含量迅速上升而CK增幅不大,可能是因为此时干旱胁迫的伤害超过了SOD调节修复能力,ERM菌株较CK有较强的干旱伤害承受能力。
干旱逆境下植物可以通过调节内源激素的增加或者减少来传递干旱信息进而调节植物的生长发育,缓解胁迫压力[16],耐旱性强的品种较耐旱性弱的品种将积累更多的ABA含量[17]。有研究表明,菌根真菌在促进菌根植物营养吸收、增强对逆境因子的抗性等方面作用重大[18],土壤水分胁迫、接菌处理对植株内源激素含量都有不同程度的影响[19]。一般来说,植物在受到逆境胁迫时,为了提高水分利用率从而增强抗旱能力,其内源激素会产生相应的变化[20]且接菌处理能让植物内源激素发生变化且大多具有偏好性[21],本研究表明,重度胁迫下接菌处理均显著影响了桃叶杜鹃幼苗内源激素含量的变化,且对其变化产生了积极的影响,这与已有研究结果相似[8]。有研究表明,受到干旱胁迫的植物体内IAA含量总体呈下降变化,本研究表明,ERM菌株显著增加桃叶杜鹃根系IAA含量,随着重度干旱持续,桃叶杜鹃叶片IAA含量呈升高-降低-升高变化,根系IAA含量则呈先升高后降低趋势。这可能是因为胁迫初期高含量的IAA有利于根系保持旺盛的生命活动诱导侧根的起始和延伸[22],降低干旱带来的伤害;而当胁迫时间过长,根系通过减少IAA含量来降低细胞生命活动应对干旱伤害。有研究表明,ABA对气孔的关闭有调控作用[17],重度干旱胁迫下接菌处理叶片ABA含量始终保持在较高水平,可能是ERM菌株通过合成更多的ABA来调节气孔运动与细胞膨压,增加桃叶杜鹃在干旱条件下的保水能力。本研究中接菌处理根系GA3含量呈增加趋势并保持较高水平,在重度干旱胁迫14 d时增幅最大,这可能是ERM菌株促进了GA3的合成,而GA3是减缓植物生长的负调控信号[23],接菌能增加GA3含量来减缓桃叶杜鹃生长使其更好地适应干旱胁迫。重度干旱下,CK桃叶杜鹃叶片和根系ZR含量变化不大,接种ERM菌株处理桃叶杜鹃叶片和根系ZR含量随重度胁迫时间的持续呈先升高后降低变化,在28 d时ZR含量急剧下降,这与已有研究类似[24],可能是因为ZR含量减少降低植株生长速率,利于植物保持较高的水分状态[25],施用ERM菌株利于桃叶杜鹃降低其体内ZR含量以此增加抗性。
很多研究都证实了干旱胁迫下内源激素相互协调作用以调节植物的抗旱性[26],植物受到胁迫后通过调节IAA和ABA的含量来控制侧根发育从而影响植株的抗旱能力[27],有研究发现,植物叶片的气孔关闭和蒸腾作用减弱是ABA含量增加和ZR含量下降共同作用的结果,而(IAA+ZT)/ABA值下降幅度越大,植物耐旱性越强[28-29]。本研究中,重度干旱胁迫下,接菌处理IAA/ABA值降幅小于CK,表明接菌可以维持桃叶杜鹃较强的生长能力;在重度胁迫28 d,接菌处理(IAA+ZR+GA3)/ABA值高于CK,可能是因为随着胁迫时间的增加,ERM 菌株可有效调节多种内源激素来应对干旱胁迫,与CK相比表现出较强的内源激素综合调节能力。

